铱(III)光敏剂:诱导焦亡和铁死亡以构建多网络协同肿瘤免疫治疗
在肿瘤治疗中,肿瘤对细胞凋亡的抵抗以及药物诱导的细胞死亡模式的缺陷是肿瘤治疗效果不佳的主要原因。因此,诱导非凋亡的调节性细胞死亡已成为推进癌症治疗的新策略。此外,鉴于肿瘤对不同细胞死亡机制的敏感性存在差异,同时调控细胞死亡杂合模式具有协同增强治疗效率和拓宽肿瘤治疗适用性的潜力。理性设计的金属配合物通过其金属-配体协调效应可高效诱导活性氧(ROS)生成。目前金属药物同时整合细胞死亡的杂合模式(如细胞凋亡、坏死和铁死亡)的研究发展趋势日益增长,但是,对杂合死亡协同机制缺乏深入研究,而与免疫密切相关的焦亡、铁死亡杂合死亡尚无报道。
中山大学毛宗万教授团队长期致力于肿瘤金属诊疗及其化学生物学研究,如:金属诱导肿瘤细胞焦亡(Angew. Chem. Int. Ed. 2022, 61, e202115800; Angew. Chem. Int. Ed. 2022, 61, e202210988; Angew. Chem. Int. Ed. 2023, 62, e202310158)或铁死亡(Angew. Chem. Int. Ed. 2022, 61, e202115247;Angew. Chem. Int. Ed. 2023, 62, e202312897)等。近日,该团队又与吴超医生和刘柳宜博士合作开发了两例纳摩尔级光毒性的铱(III)-三苯胺光敏剂 (IrC和IrF) 来构建细胞焦亡和铁死亡的联合调控网络 (图1)。研究表明,光照后IrC和IrF发生光驱动细胞内迁移,造成Kelch 样 ECH 相关蛋白 1 (KEAP1)、DNA等生物大分子的级联损伤,从而引发细胞死亡杂合模式。一方面,受损的DNA引起黑色素瘤 2 (AIM2) 相关细胞质核酸传感通路的激活,导致诱发 gasdermin D介导的细胞焦亡;另一方面,氧化还原稳态的破坏导致脂质过氧化;更重要的是,IrC和IrF通过作用 KEAP1/核因子红细胞 2 相关因子 2 (NRF2) 复合物,上调血红素加氧酶 1 (HO-1) 的表达,促进HO-1催化血红素 (Heme) 释放亚铁离子,引起铁应激。作为关键节点,铁应激不仅激活铁死亡,还促进gasdermin E介导的非经典焦亡,进一步诱导触发免疫原性死亡。在动物实验中通过双侧瘤模型及再挑战模型验证了IrC和IrF有效抑制体内肿瘤生长,且激活机体长期免疫的能力(图2-3)。此研究表明细胞焦亡和铁死亡的联合诱导在肿瘤免疫治疗中的关键作用。
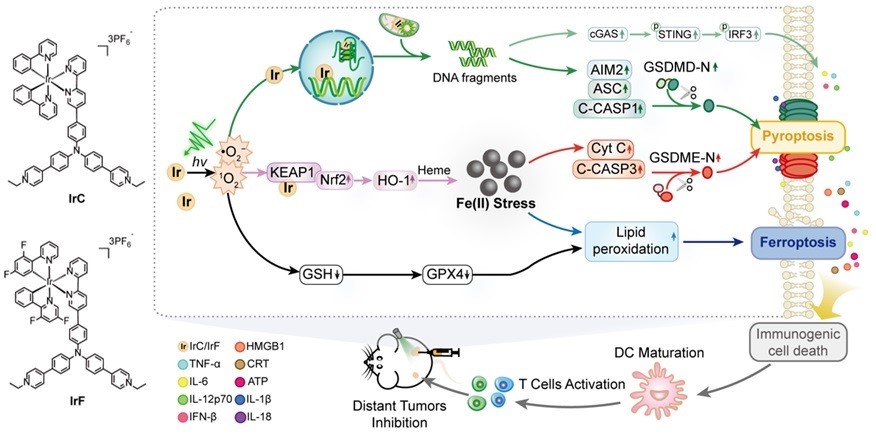
图1. IrC和IrF光敏剂的结构及其构建的细胞焦亡和铁死亡调控网络
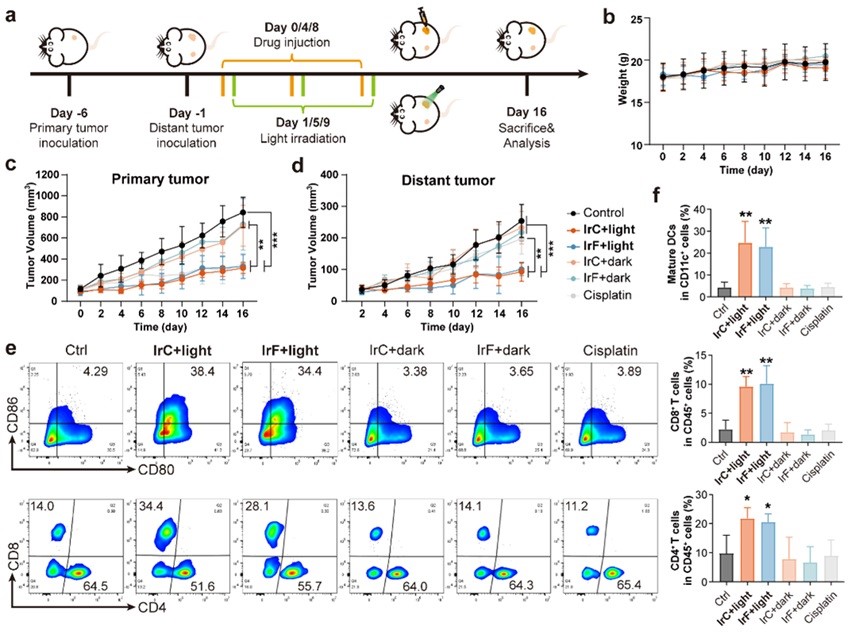
图2. 双侧肿瘤模型反映IrC和IrF的抗肿瘤功效和免疫反应激活能力
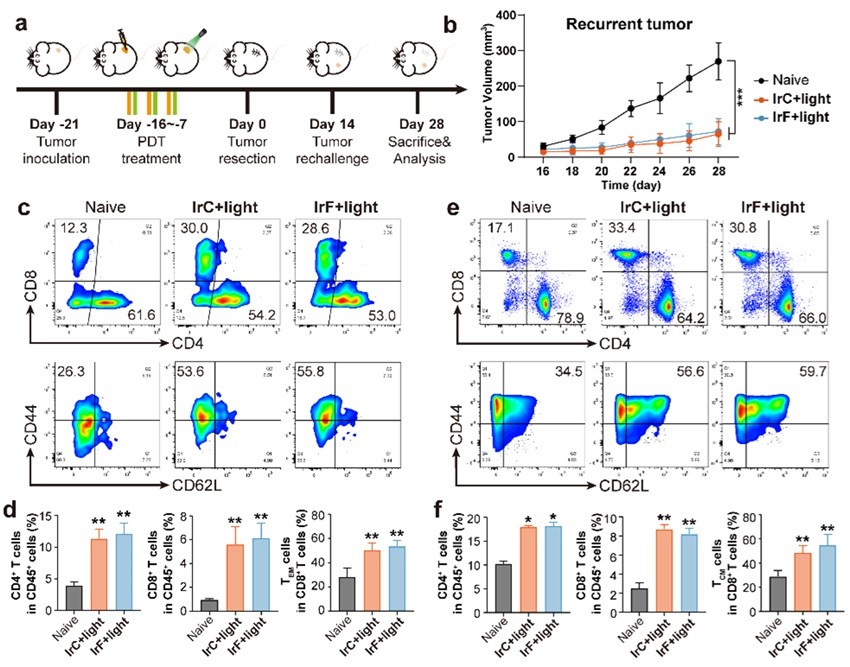
图3. 肿瘤再挑战模型表明IrC和IrF激活机体长期免疫反应
该项工作首次提出铁应激介导的多网络协同肿瘤免疫治疗,并强调铁稳态作为连接细胞焦亡和铁死亡的枢纽的重要性。这一成果近期发表在Angewandte Chemie International Edition 上,中山大学博士研究生曾友梁为第一作者,中山大学毛宗万教授、中山大学附属第一医院吴超医生和中山大学刘柳宜博士(现为南京大学博士后)为论文的共同通讯作者。特别感谢中山大学提供的研究平台、国家基金委基金项目等支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Iridium(III) Photosensitizers Induce Simultaneous Pyroptosis and Ferroptosis for Multi-Network Synergistic Tumor Immunotherapy
You-Liang Zeng, Liu-Yi Liu,* Tian-Zhu Ma, Yu Liu, Bin Liu, Wenting Liu, Qing-Hua Shen, Chao Wu,* and Zong-Wan Mao*
Angew. Chem. Int. Ed., 2024, DOI: 10.1002/anie.202410803
导师介绍
毛宗万
https://www.x-mol.com/university/faculty/15322
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
诱导肿瘤细胞凋亡-铁死亡的铱(III)纳米双光子光敏剂 2022-06-01
-
新型光敏铱配合物诱导铁死亡和凋亡协同作用抑制癌细胞 2021-03-20
-
Angew. Chem.:碳酸酐酶IX锚定的铼光敏剂诱导细胞焦亡激活抗肿瘤免疫 2021-12-12
-
Endoplasmic reticulum-targeted iridium(III) photosensitizer induces pyroptosis for augmented tumor immunotherapyJournal of Inorganic Biochemistry (IF 3.8) Pub Date : 2024-08-11 ,DOI:10.1016/j.jinorgbio.2024.112695Yun-Shi Zhi, Tie Chen, Bin-Fa Liang, Shan Jiang, Da-Hong Yao, Zhen-Dan He, Chen-Yang Li, Liang He, Zheng-Yin Pan
-
Mitochondria-targeted iridium(III) complexes encapsulated in liposome induce cell death through ferroptosis and gasdermin-mediated pyroptosisEuropean Journal of Medicinal Chemistry (IF 6.0) Pub Date : 2024-01-01 ,DOI:10.1016/j.ejmech.2023.116112Chunxia Huang, Yuhan Yuan, Gechang Li, Shuang Tian, Huiyan Hu, Jing Chen, Lijuan Liang, Yi Wang, Yunjun Liu


































 京公网安备 11010802027423号
京公网安备 11010802027423号