哺乳动物细胞中实现小分子诱导的激酶催化赖氨酸的乙酰化
蛋白翻译后修饰在细胞信号转导、蛋白稳定性调控、蛋白识别与相互作用以及空间定位等发挥着重要作用,其中的赖氨酸乙酰化修饰是报道的最为广泛的修饰之一。深入认识蛋白乙酰化修饰的机制以及乙酰化修饰对蛋白功能的调控机制对相关药物开发和设计至关重要。近日,新加坡国立大学的Yao Shao Qin 教授(点击查看介绍)团队联合暨南大学药学院张志民(点击查看介绍)团队在J. Am. Chem. Soc.上发表研究论文,首次在哺乳动物细胞中利用小分子对激酶催化中心的赖氨酸实现了选择性乙酰化修饰,为激酶的生物学研究和靶向药物的开发提供了一个新的化学工具。

赖氨酸乙酰化状态失调与心血管疾病、癌症和神经性疾病等均存在密切的联系。生物体中的赖氨酸乙酰化稳态由众多赖氨酸乙酰化酶(KACs)和去乙酰化酶(KDACs)精确调控。在哺乳动物细胞中对蛋白进行选择性修饰的化学工具是研究赖氨酸乙酰化生物学功能的利器,但在开发过程中面临着一系列的挑战。一些传统的生物方法操作复杂,如通过工程化改造的pyrrolysyl tRNA synthetase / tRNACUA系统在表达过程中插入非天然的乙酰化赖氨酸;已报道的可以诱导蛋白乙酰化修饰的小分子缺乏广谱性和修饰位点选择性,如AceTAC 和 BAHA试剂。本文作者以激酶为对象,尝试开发同时具有高选择性和高反应性的乙酰化分子工具。
激酶可以通过水解ATP来磷酸化底物蛋白,从而调控一系列信号通道的开放。在激酶的活性中心,大都存在一个非常保守的催化性赖氨酸,目前人们已经开发了多个可以共价修饰这个赖氨酸的小分子,包括一个可以在体外对PI3Kδ (K779) 进行选择性乙酰化修饰的分子。为了实现在哺乳动物细胞中对这个赖氨酸的乙酰化修饰,作者以3-aminopyrazole这个可以跟众多激酶结合的分子作为化学支架,在它的末端芳香环上引入一个活化酯并通过不同的取代基来微调该warhead的反应性与稳定性,成功的合成Ac1-Ac8。这些分子在PBS中都具有较高的稳定性(t1/2 > 12 h) 和与氨基的反应活性,而含有两个F作为吸电子取代基的Ac4表现最佳。
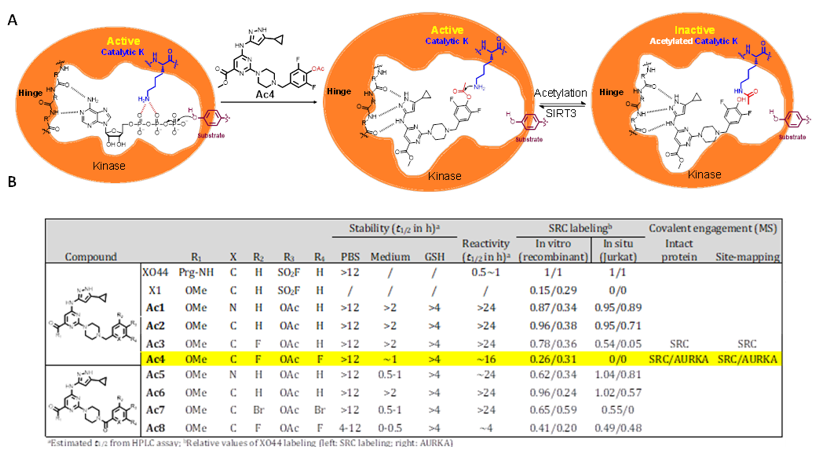
Ac4在细胞中也可以很好的修饰激酶SRC和AURKA的催化赖氨酸。XO44是一个非常成熟的激酶赖氨酸共价修饰分子,PD/WB实验显示在细胞提前孵育了Ac4后,XO44与SRC和AURKA的结合能力急剧降低,证明催化性赖氨酸被Ac4乙酰化后阻止了XO44与SRC/AURKA的共价反应。蛋白组学实验证明Ac4可以乙酰化上百个内源性激酶,显示了该方法的普适性;而且IP-WB显示Ac4孵育后细胞中SRC和AURKA的乙酰化程度都出现了剂量依赖性的提高,更直接证明Ac4可以在细胞中对SRC和AURKA进行乙酰化;最后竞争条件下的IP-WB研究显示活细胞中的AURKA催化赖氨酸被其它小分子共价占据后,Ac4将不能乙酰化AURKA,显示出了乙酰化位点选择性。

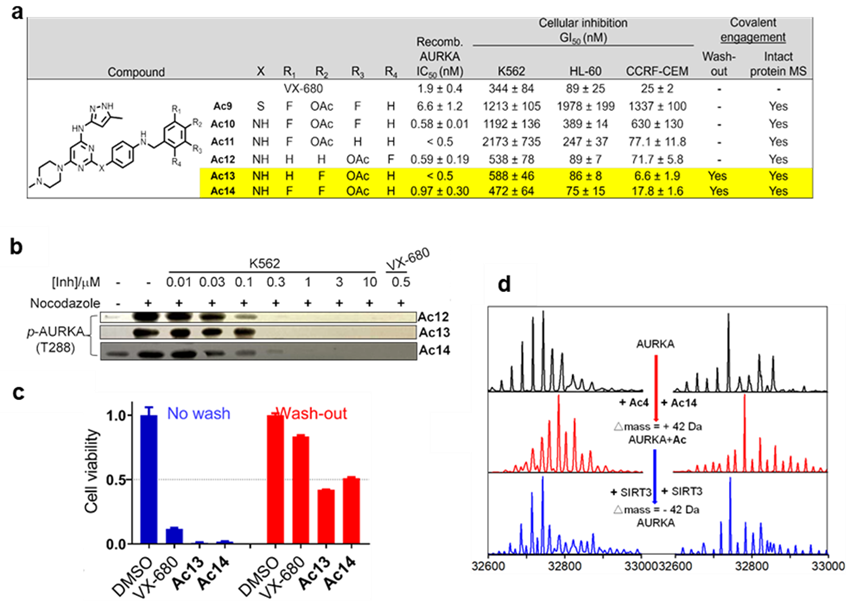
作者接下来利用这一策略研究了AURKA的催化赖氨酸K162的乙酰化。目前还没有证据显示AURKA 上的K162可逆乙酰化在细胞中是否真实存在。通过对前期开发了一个AURKA选择性非共价抑制剂VX-680进行改造,在靠近K162的苯环上引入活化酯作为乙酰化基团,并将旁边位置引F取代对该活化酯反应性和稳定性进行微调,合成了Ac9-Ac14等系列分子。其中最优异的Ac13不仅显示出与VX-680类似的对AURKA体外抑制活性和细胞毒性,也保留了对AURKA 激酶的高选择性;并且还可以高效地选择性乙酰化AURKA上的K162。Ac13孵育后,细胞中AURKA(K162)的乙酰化明显提高,相应的AURKA(T288)的自磷酸化水平则显著降低。洗脱实验中Ac13也显示出持续的细胞活性和乙酰化AURKA能力。被Ac13乙酰化的AURKA在SIRT3调控下可以实现去乙酰化,这一点在体外和细胞内都被证明。在HCT116细胞中,AURKA可以通过磷酸化p53蛋白,促进其泛素化进而被降解。Ac13孵育的细胞中p53的稳定性显著提高,而当在细胞中过表达去乙酰化酶SIRT3时则可以发现AURKA的乙酰化水平几乎被完全逆转,p53的稳定性也随之降低。
综上所述,本论文首次开发成功了一类可以在活细胞中对激酶催化赖氨酸进行选择性乙酰化修饰的化学分子,并以此为基础证明了AURKA的催化赖氨酸K162的可逆乙酰化,显示该方法在深入研究激酶的赖氨酸乙酰化调控领域的广阔应用空间。
相关论文发表于J. Am. Chem. Soc.,第一作者为新加坡国立大学唐光辉博士和中山大学王璇博士(现为暨南大学药学院博士后),通讯作者为新加坡国立大学Shao Q. Yao教授和唐光辉博士以及暨南大学药学院张志民研究员。这项工作得到了新加坡NMRC和教育部相关基金、国家重点研发计划和广东省重大基础与应用研究基金的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Small Molecule-Induced Post-Translational Acetylation of Catalytic Lysine of Kinases in Mammalian Cells
Guanghui Tang*, Xuan Wang, Huisi Huang, Manyi Xu, Xingyu Ma, Fengfei Miao, Xiaoyun Lu, Chong-Jing Zhang, Liqian Gao, Zhi-Min Zhang*, Shao Q. Yao*
J. Am. Chem. Soc. 2024, 146, 23978–23988, DOI: 10.1021/jacs.4c07181
导师介绍

Shao Q. Yao教授博士毕业于美国普渡大学,随后分别于加州大学伯克利分校癌症研究院和斯克里普斯研究所从事博士后研究工作。2011年起获聘新加坡国立大学终身正教授,2012年起被聘为首席教授。Shao Q. Yao教授以化学生物学为主要研究方向,长期致力于酶及相关生物分子对生命调控的研究,以小分子荧光探针、蛋白质组学、微阵列芯片、高通量筛选等为手段,积极推进疾病的机理研究及治疗手段的开发,先后在Nature、Acc. Chem. Res.、 J. Am. Chem. Soc.、 Angew. Chem. Int. Ed.、 Nat. Commun.和 Proc. Natl. Acad. Sci. U.S.A.等国际著名期刊上发表高水平学术论文200余篇。
https://www.x-mol.com/university/faculty/4395

张志民研究员,博士毕业于中科院上海有机化学研究所,随后在加州大学河滨分校(UCR)从事博士后研究,2017年入职暨南大学药学院生物制药系。入选国家级青年拔尖人才和广东省“珠江人才”计划青年拔尖人才。长期以具有重要生理功能和新颖催化机制的酶为研究对象,致力于酶的结构生物与结构药理学研究。近年来以(共)第一/通讯作者在Nature、Nature Communications、Nature Plants、Nature Structural & Molecular Biology、J. Am. Chem. Soc. 、Angew. Chem. Int. Ed.和J. Med. Chem.等国际知名期刊发表研究论文多篇。
https://www.x-mol.com/university/faculty/385555

唐光辉博士毕业于北京大学,随后加入新加坡国立大学Yao Shao Qin课题组从事博士后研究。长期致力于新型激酶共价抑制剂的开发和活性化合物的药物靶点鉴定。近年来以(共)第一/通讯作者在J. Am. Chem. Soc. 、Angew. Chem. Int. Ed.和Eur. J. Med. Chem. 等国际知名期刊发表研究论文多篇。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号