JACS:铜催化联烯sp² C-H键选择性芳基化和炔基化反应
联烯具有独特的互相垂直的二烯拓扑结构特征,在天然产物、药物研发以及有机合成中间体中受到了广泛的关注。例如从Maresmius ramealis 中分离的marasin,含有共轭的联烯结构,是对抗金黄色葡萄球菌的强效活性抗生素成分(图1);联烯基作为生物电子等排体环替代前列腺素中的C=C双键时,较传统胃酸分泌抑制剂能展现出更优的效果。此外联烯刚性的轴手性骨架还可以作为新型的生物偶联的链接子、作为活性受体在抑制酶活性等方面均有所应用。然而,目前含有联烯基结构的天然产物的存量仍然相对较少,其在药物研发中的研究也方兴未艾。为满足新型药物、功能分子的研发所需的海量分子作为分析数据,发展高效、广谱、条件温和的合成联烯的方法学从而在应用层面拓展联烯的化学空间有着迫切的现实需求。
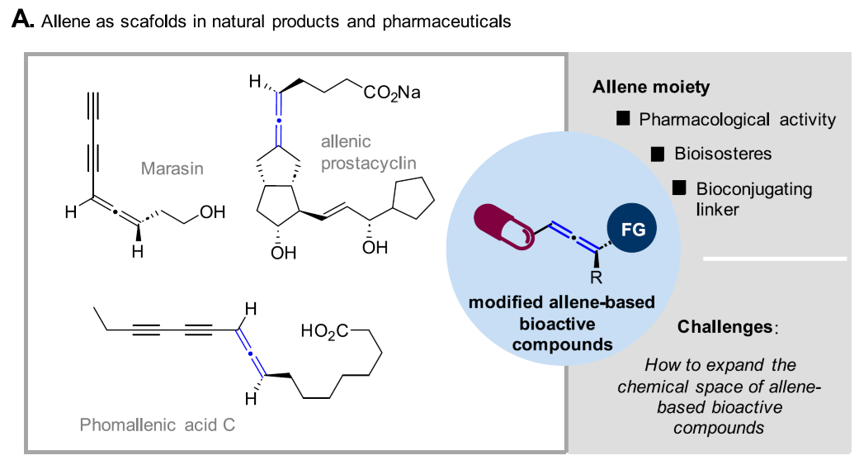
图1. 天然产物和药物中的联烯
发展C-H键的直接官能团化反应可以避免进一步转化中存在的基团兼容性以及基团保护等带来的挑战,从而为复杂结构的后期修饰提供便捷。2021年,Carreira课题组采用吡啶酰胺作为导向基,实现了钯催化CMD历程的联烯sp2 C-H的烯基化反应。麻生明课题组采用过渡金属Pd或者Rh先对双键加成,再历经β-H消除重构联烯的策略实现了sp2 C-H键的芳基化反应。2023年,中国科学院上海有机化学研究所刘国生(点击查看介绍)课题组基于前期发展的铜催化自由基接力策略(Science 2016, 353, 1014, 点击阅读详细)以及铜配位的氮自由基攫氢策略(Nature 2019, 574, 516, 点击阅读详细)的基础上,与中国科学院上海有机化学研究所麻生明(点击查看介绍)团队以及香港科技大学林振阳(点击查看介绍)团队合作,实现了自由基历程的联烯的高位点选择性sp2 C-H键氰化反应(J. Am Chem. Soc. 2023, 145, 25995,点击阅读详细)。机理实验和理论计算表明氮自由基配位的Cu(II)-F物种上的F原子与底物联烯丙位的sp3 C-H键存在较强的氢键作用,从而在构象上导向氮自由基优先攫取联烯sp2 C-H键(Csp2 -H : Csp3 -H > 10:1)。基于这一发现,他们发展了联烯sp2碳氢的芳基化、炔基化反应,并实现了基于联烯碳氢键连续转化的发散式合成(图2)。
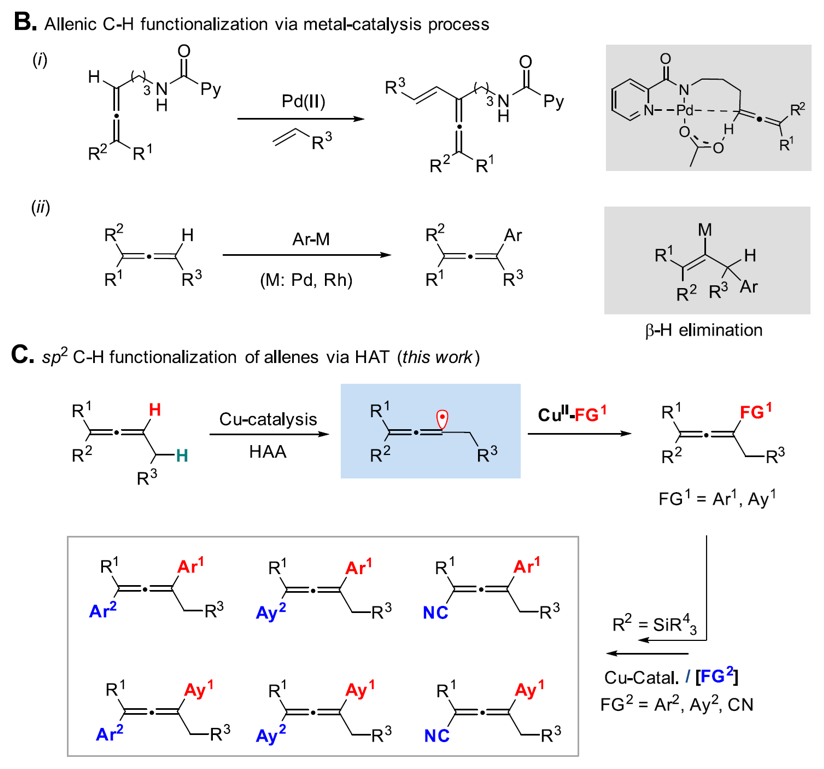
图2. 联烯sp2 C-H键官能团化
采用芳基硼酸作为亲核试剂进行条件筛选,以81%的收率、优异的位点选择性(Csp2: Csp3 >20:1)实现了联烯sp2 C-H键芳基化。控制实验显示:当菲罗啉配体由6 mol%提高到12 mol%时,反应完全不转化,这是由于两个菲罗啉配体螯合的铜催化剂无法与NF试剂发生单电子转移所致;尽管Box类型配体与Cu(I)的络合物有着更低的还原电位,但是在-30℃条件下没有转化。此外溶剂种类、NF试剂种类、添加剂以及反应温度都是影响反应收率的因素。当没有DMAc时,反应体系混乱且仅有3%的收率。极性配位性的DMAc可能作为L型配体稳定Cu(II)-Ar物种,从而能更好地与联烯基自由基结合(见图3)。当采用三甲氧基硅基炔作为炔基化反应的亲核试剂,反应在0.1 mol% CuOAc的条件下具有最优的收率。当铜催化剂用量增加时,亲核试剂和氧化剂大量消耗且转化为Glaser偶联类型的副产物。相比之下,芳基化需要5 mol%的催化剂用量时才能有较好的收率,这可能是由于Cu(II)-Ar稳定性较差,因而需要较高浓度的催化剂来维持较高浓度的Cu(II)-Ar物种,从而更高效地捕获联烯基自由基。
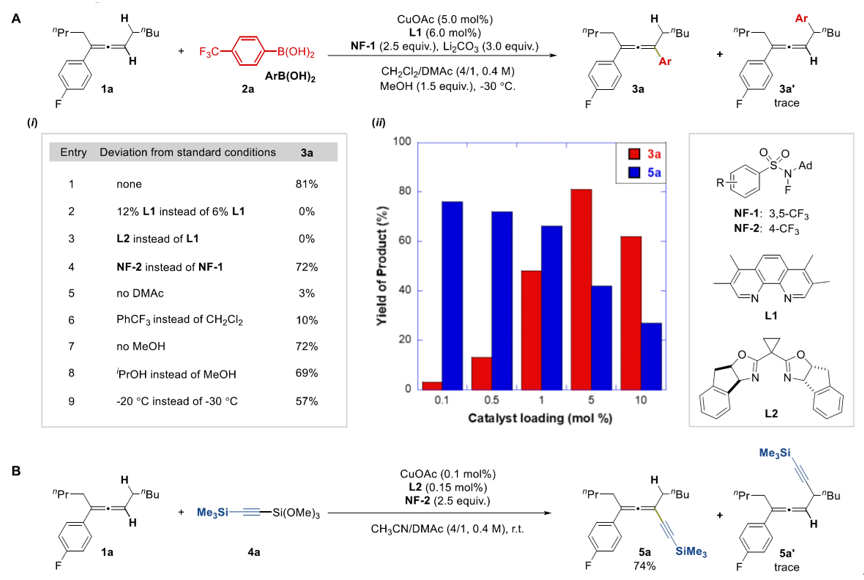
图3. 联烯sp2 C-H键官能团化条件筛选
在获得芳基化反应的最优条件后,作者对一系列取代的芳基硼酸的兼容性进行了考察。如对位取代的三氟甲基(3a)、甲磺酰基(3b)、氰基(3c,3g~3i, 3m~3r)、三氟甲氧基(3d);当邻位或者对位取代的酯基(3e、3f)时,反应均可以拿到良好的分离收率,以及Csp2: Csp3 >20:1的位点选择性。此外,对各种杂环硼酸,也能以良好到优异的转化和选择性得到相应的吡啶取代的联烯(3s~3x)。当底物为烷基(3l~3q,3v)、炔基(3w)、卤素(3m)取代的联烯时,也能获得良好的分离收率。底物中可以兼容活泼烯丙位sp3 C-H键(3r、3s),主要获得联烯sp2 C-H芳基化产物。
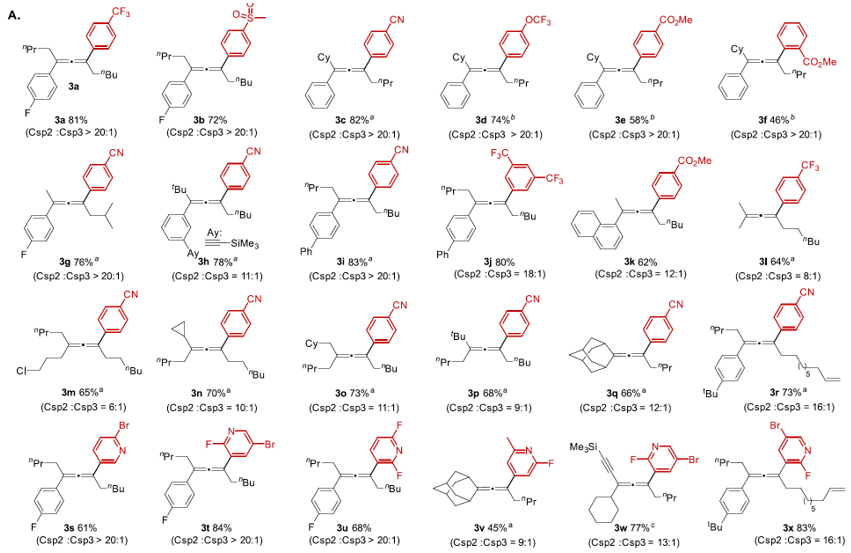
图4. 联烯sp2 C-H键芳基化底物考察
在炔基化转化中,底物也可以兼容一系列硅基(5a、5e、5f)、烷基(5b、5c)和芳基(5d)取代的炔基化试剂。当底物为炔基取代的1b时,尽管形成的自由基存在多种共振式(见图5),Box配位的铜催化剂可以高化学选择性地获得联烯炔基化产物(5m)。
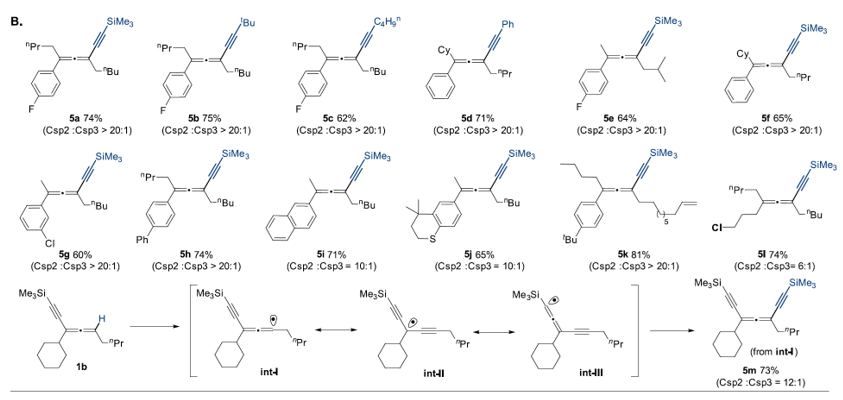
图5. 联烯sp2 C-H键炔基基化底物考察
对于一系列天然产物、药物分子衍生物等复杂结构,反应可以兼容苄位(9a)、烯丙位(9h)、酯基(9c)、醇(9a)、醚(9e)等许多具有活性sp3碳氢键的官能团,以及容易发生自由基加成的双键(9a,9e, 9h)。这展现了该方法在含有联烯骨架的复杂药物分子和天然产物的后期修饰中具有非常稳健的底物普适性。
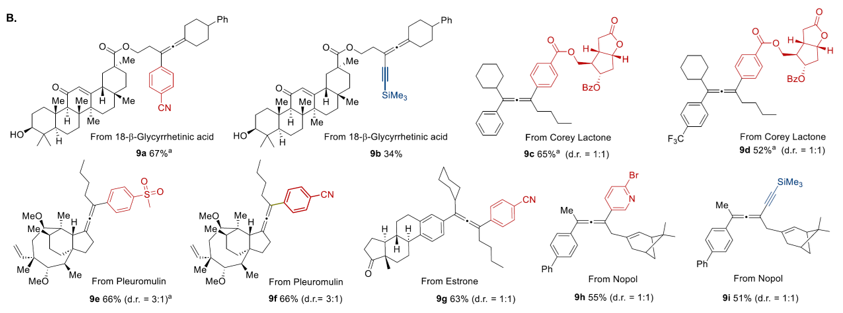
图6. 对复杂结构衍生物的考察
当使用TMS作为取代基的联烯6为底物时,在进行芳基化/炔基化后反应后,经历TBAF高效地脱去TMS得到芳基/炔基化后的新的含有sp2 C-H键的联烯7b/8b,选择氰基化、芳基化、炔基化反应条件作为方法包进一步地进行官能团化,可以高效地得到联烯两次sp2 C-H键双官能团化的产物。若开发更为丰富的方法学包,再结合这一模块化、发散式合成的策略将可以极为高效地实现联烯骨架的多官能团化转化,这将极大地拓展联烯化合物库(见图7)。
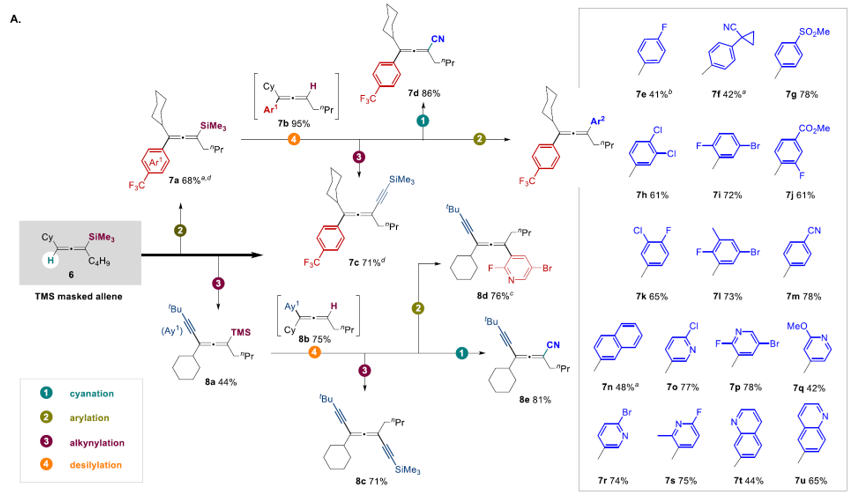
图7. 硅基取代联烯的连续官能团化
为了排除该反应历程可能涉及到N自由基先加成芳基化/炔基化后,再消除NH得到联烯芳基化/炔基化产物的机制,作者进行了进一步的研究。三元环取代的联烯的HAT开环实验、自由基的TEMPO捕获实验均表明反应历经联烯基自由基中间体;采用N自由基加成后的中间体无法消除NH等实验也进一步地排除了加成/消除机制。结合机理实验以及对铜配位的N自由基攫氢的自由基接力策略的研究,最终作者认为反应的可能机制如下图8所示:
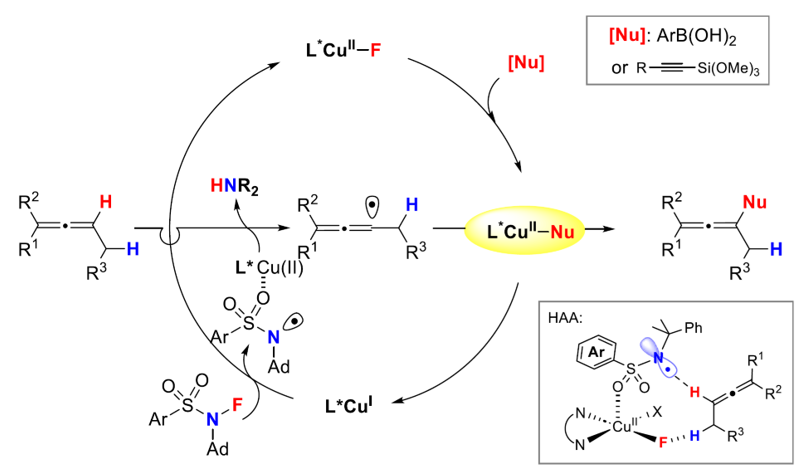
图8. 机理循环图
总结
本文基于N自由基与过渡金属Cu(II)-F物种以及联烯底物sp3 C-H键三组分间的配位/导向攫氢模式实现了高选择性攫取联烯sp2 C-H键,并发展了结构多样性更为丰富的芳基化、炔基化从而实现了联烯的发散式合成,便捷高效地拓展了联烯合成、应用的化学空间。
这一成果近期发表在J. Am. Chem. Soc.上,文章的第一作者是中国科学院上海有机化学研究所的成忠明博士和研究生张家骏,通讯作者为上海有机化学研究所刘国生研究员。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Copper-Catalyzed sp2 C–H Arylation and Alkynylation of Allenes via Hydrogen Atom Abstraction
Zhongming Cheng, Jiajun Zhang, Can Li, Xiang Li, Pinhong Chen, Guosheng Liu*
J. Am. Chem. Soc. 2024, DOI: 10.1021/jacs.4c09324
导师介绍
刘国生
https://www.x-mol.com/university/faculty/15593
麻生明
https://www.x-mol.com/university/faculty/15585
林振阳
https://www.x-mol.com/university/faculty/38301
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号