Nano Res.[生物]│四川大学华西药学院杜广盛团队:细菌和癌细胞膜融合脂质体与PD-L1抑制剂联合用于癌症免疫治疗
本篇文章版权为罗先金所有,未经授权禁止转载。

背景介绍 肿瘤疫苗作为一种肿瘤免疫疗法正在被广泛研究,其可以通过肿瘤相关抗原来激活肿瘤特异性的免疫反应,达到杀伤、清除肿瘤细胞的目的。肿瘤细胞膜含有一系列肿瘤相关抗原,相比于亚单位疫苗,可诱导更广谱的免疫应答。然而细胞膜抗原具有免疫原性较弱、淋巴结靶向性差等缺点,使用新型疫苗递送系统有望提高其免疫应答刺激能力。 成果简介 基于此,四川大学华西药学院杜广盛团队开发了一种细菌双层膜囊泡(DMV)-癌细胞膜融合脂质体,用于递送基于减毒沙门氏菌VNP20009细胞膜的疫苗佐剂和基于小鼠结肠癌MC38细胞膜的肿瘤抗原。研究者采用简单的超声破碎和离心方法,分离得到了VNP20009DMV和MC38肿瘤细胞的细胞膜,之后通过简单的物理挤出融合技术,将肿瘤细胞膜与细菌DMV佐剂重新组装,构建了一种新型的免疫调节融合脂质体。为了克服接种疫苗会显著上调肿瘤引流淋巴结TDLN和肿瘤组织中抗原提呈细胞(APC)表面PD-L1表达的难题,研究者在融合脂质体中引入PD-L1抑制剂JQ-1,以下调疫苗接种导致的PD-L1表达,从而改善肿瘤免疫微环境并提升抗肿瘤免疫反应。 该团队所开发的融合脂质体粒径在95 nm左右,可有效透过毛细淋巴管上皮细胞的间隙,有效回流至肿瘤引流淋巴结。研究发现,所制备的融合脂质体细胞摄取效率相比游离细胞膜抗原提升2倍以上,且能显著提升淋巴结内的APC成熟水平。在健康小鼠中,所开发的纳米疫苗将抗体水平提升了2倍以上,同时显著诱导了细胞免疫应答免疫记忆。在荷瘤小鼠中,疫苗接种后TDLN和肿瘤组织中APC的PD-L1的表达增加了1倍,而JQ-1的引入将PD-L1的表达水平下调至与Blank 组相当。在荷MC-38小鼠模型上,所开发制剂显著提升了荷瘤小鼠生存期,具有最强的抗肿瘤效果。同时,所开发制剂没有明显的血液和器官毒性,此研究为开发免疫原性强、治疗效果好的新型基于细胞膜的癌症疫苗提供了参考。 作者简介 杜广盛,四川大学华西药学院药剂系副研究员,硕士生导师。博士毕业于荷兰莱顿大学,2018年加入四川大学华西药学院孙逊教授团队,从事新型疫苗递送系统和微针药物递送系统的研究。迄今为止,在Accounts of Chemical Research、Journal of Controlled Release, Nano Research等学术期刊发表学术论文超过40篇,参编了2部教材,主持国家自然科学基金专项基金、青年基金等多项课题。课题组网站链接:https://pharmacy.scu.edu.cn/info/1059/6149.htm。 罗先金,2021级四川大学华西药学院硕士生,目前在德国慕尼黑大学化学与药学学院攻读博士学位,主要从事基因及亚单位疫苗递送系统的研究。 文章信息 Luo X, Li C, Guo Z, et al. Bacterial and cancerous cell membrane fused liposome coordinates with PD-L1 inhibitor for cancer immunotherapy. Nano Research, 2024, 17(9): 8389-8401. https://doi.org/10.1007/s12274-024-6861-5. 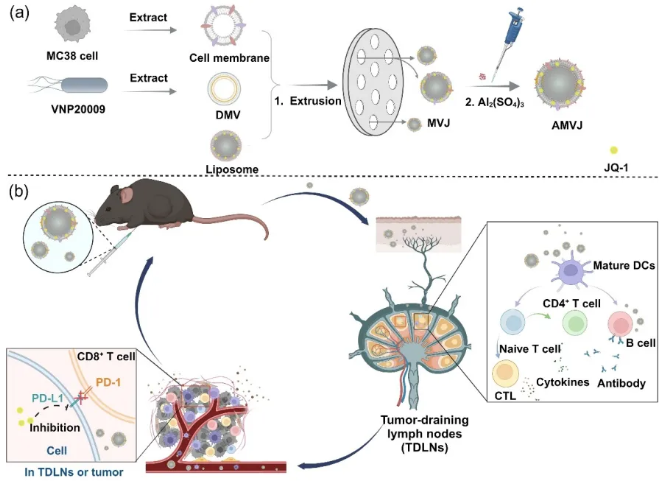



如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号