安徽中医药大学王琪/程志非/桂双英ACS Nano:基于工程化细胞外囊泡的纳米制剂协调神经炎症和免疫稳态增强帕金森病治疗
帕金森病 (PD) 是最常见的神经退行性疾病之一,以多巴胺能神经元进行性损伤和黑质 (SN) α-突触核蛋白 (α-syn) 异常积累为主要特征。过度激活的脑免疫微环境是PD快速进展的关键因素,由脑内常驻小胶质细胞的神经炎症和脑外周免疫细胞的持续浸润共同推动。为解决脑内过度激活的小胶质细胞中产生的神经炎症问题,目前已经提出了许多策略,包括激活下游的抗炎信号通路如NF-κB或利用纳米酶的生物催化。然而,值得注意的是,如果不能及时预防神经炎症产生的源头或脑外周免疫细胞浸润引起的免疫恶化,很难达到治疗PD的目的。因此,需要综合治疗的方法以桥接脑内部和外部以重塑PD过度激活的免疫微环境。
近日,安徽中医药大学王琪/程志非/桂双英研究团队提出一种创新的PD内外综合治疗策略:从“内”抑制小胶质细胞产生神经炎症的源头,从“外”阻断脑外周免疫细胞的持续浸润以恢复异常的免疫紊乱。该团队利用过表达趋化因子受体CCR2的小鼠骨髓间充质干细胞衍生的细胞外囊泡(MSCCCR2 EVs),通过将其涂覆在负载中药活性成分二氢丹参酮I的纳米载体 (MSeN-DT) 上,成功制备出工程化细胞外囊泡纳米制剂(EVN)。MSCCCR2 EVs (EVN的外壳)由于高表达CCR2在黑质中显示出对特定趋化因子CCL2的归巢,并有效阻断CCR2-CCL2信号轴,从而阻断脑外周免疫细胞的浸润。此外MSeN-DT (EVN的核心)可以通过促进Nrf2−GPX4通路阻断炎症源以抑制小胶质细胞的铁死亡。总的来说,这项研究结果表明,EVN提供了一种集趋化性和靶向性、减轻炎症和调节免疫稳态为一体的综合治疗PD方法。相关工作发表于ACS Nano 上。安徽中医药大学王琪研究员、程志非研究员和桂双英教授为共同通讯作者,硕士研究生张川为第一作者。
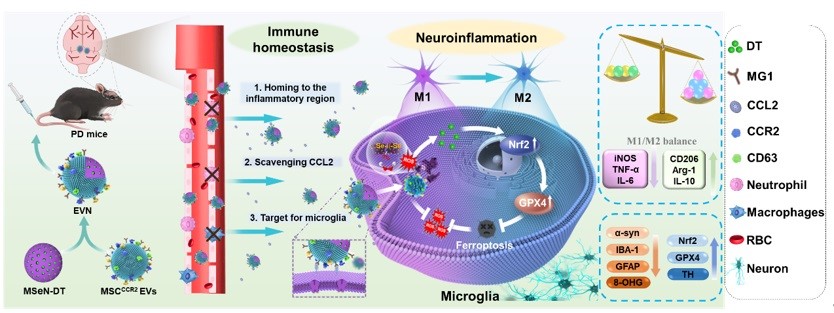
图1. 过表达CCR2的工程细胞外囊泡纳米制剂的制备及其对PD治疗的调控示意图
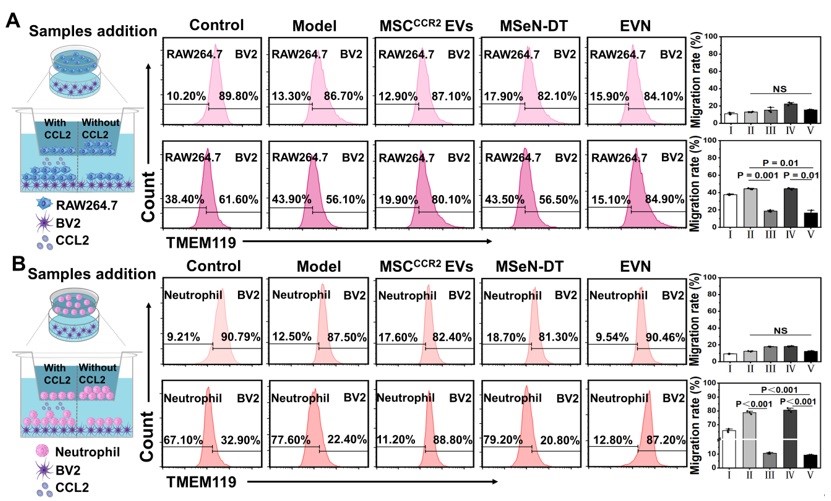
图2. EVN体外抑制脑外周免疫细胞浸润的能力评估。通过流式细胞仪分析 (A) RAW264.7和(B) 中性粒细胞与H2O2预处理的BV2细胞 (加或不加CCL2) 共培养条件下的迁移情况
在Transwell实验中,将RAW264.7或中性粒细胞 (主要外周免疫细胞) 置于上腔,将不同条件下的小胶质细胞系 (BV2细胞) 置于下腔进行Transwell实验。结果显示,与MSCCCR2 EVs和MSeN-DT组相比,EVN组RAW264.7细胞的迁移率明显受到抑制,迁移率为16.47% (图2A)。此外,中性粒细胞向下腔的迁移也呈现出类似的趋势,表明对浸润有抑制作用 (图2B)。
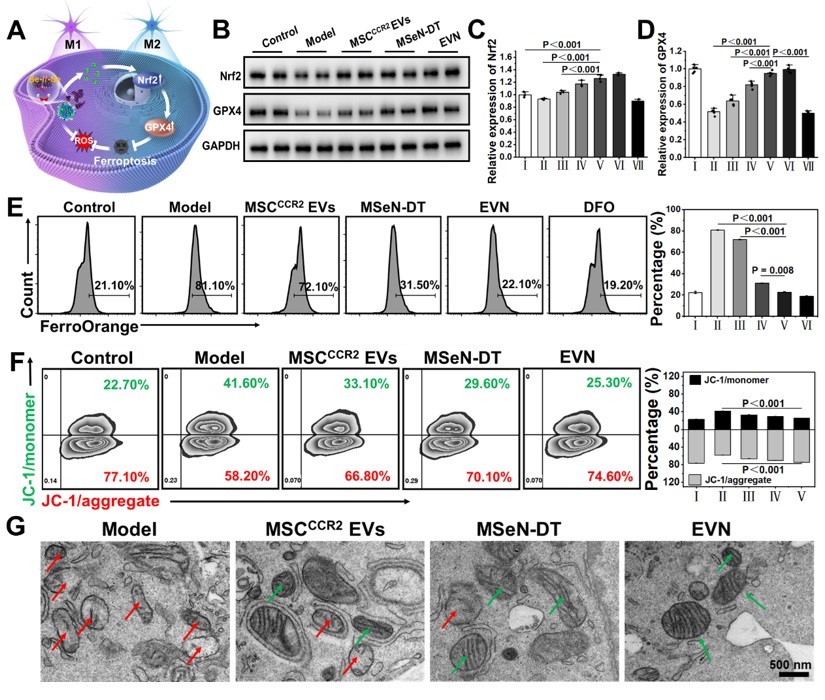
图3. EVN调节小胶质细胞表型变化的药理学机制。(A) Nrf2−GPX4信号通路示意图。(B) 不同处理后BV2细胞Nrf2和GPX4表达的WB分析。(C, D) 各组Nrf2和GPX4的相对表达量,其中对照组的表达量表示为1 (I:对照组,II:模型,III: MSCCCR2 EVs, IV: MSeN-DT, V: EVN, VI: tBHQ, VII: ML385, n = 5)。(E) 流式细胞术检测Fe2+荧光探针染色不同条件下BV2细胞内Fe2含量的研究(I:对照组,II:模型,III: MSCCCR2 EVs, IV: MSeN-DT, V: EVN, VI: (F) JC-1流式细胞术检测不同处理后BV2细胞线粒体膜电位(I:对照,II:模型,III: MSCCCR2 EVs, IV: MSeN-DT, V: EVN, n = 3)。(G) 不同处理后BV2线粒体代表性生物透射电镜图像(红箭头:线粒体脊减少,绿箭头:线粒体脊增加)
基于之前的说法,作者假设所递送的DT可以有效激活Nrf2,通过Nrf2−GPX4途径消除上游ROS的产生,抑制铁下沉(图3A)。抑制铁凋亡和阻断上游ROS生成的一个重要方面是通过EVN传递的DT完全激活Nrf2表达。本研究以Nrf2激动剂叔丁基对苯二酚(TBHQ)和Nrf2抑制剂ML385分别作为阳性和阴性对照。如图3B、C所示,EVN组通过抑制Keap1蛋白的表达,有效促进Nrf2的胞内释放。在PD患者的大脑中,细胞中GPX4的失活或减少导致脂质活性氧的产生,从而诱导小胶质细胞中的铁死亡如图3B、D所示,与对照组相比,MSeN-DT和EVN上调Nrf2和GPX4的表达。Fe2+水平升高是PD患者铁代谢异常的直接原因。
线粒体膜电位的波动是铁死亡的常见标志。使用流式细胞术通过JC-1染色检测线粒体膜电位的变化,这是一种反映线粒体膜电位的测定方法如图3F所示,对照组H2O2处理后,聚集/单体荧光比值从3.40下降到1.40,表明线粒体因PD相关炎症损伤。经MSCCCR2 EVs、MSeN-DT和EVN处理后,JC-1的聚合/单体荧光比分别恢复到2.02、2.37和2.95。提示EVN能有效恢复线粒体功能,抑制铁死亡。透射电镜进一步观察BV2细胞线粒体病理,如图3G所示,形态学变化反映了铁死亡程度。模型组大鼠线粒体膜肿胀破裂,线粒体嵴减少或消失。EVN治疗后,显著减少肿胀的线粒体,表明有效抑制与铁死亡相关的线粒体损伤。因此,这些结果共同表明,EVN通过调节Nrf2和GPX4的表达至正常水平,从而减轻神经炎症,从而阻止铁死亡的发生。
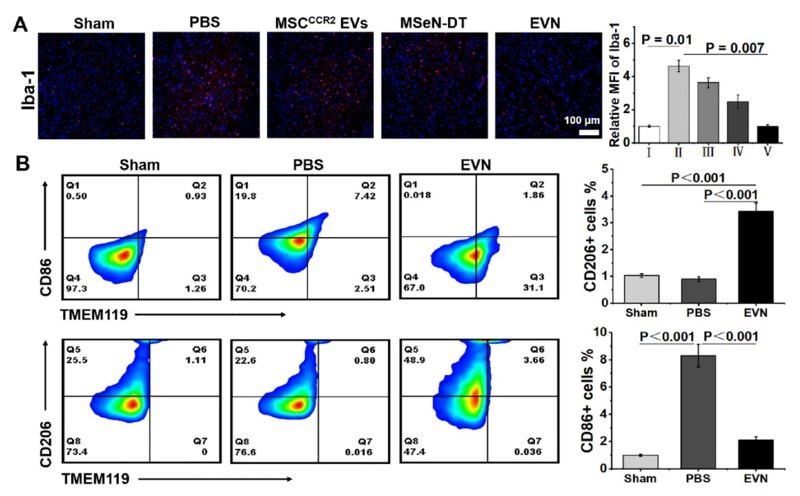
图4. EVN在体内抑制神经炎症的能力评估。(A) 不同处理小鼠SN中Iba-1 (红色) 的代表性免疫荧光图像及相应的定量分析,其中假手术组Iba-1的相对MFI为1 (n = 3)。(B) 流式细胞术研究不同处理小鼠中脑小胶质细胞表型及不同条件下小胶质细胞CD86和CD206的相应百分比(n = 3)。
为了证实PD患者受干扰的免疫系统的恢复,作者研究了EVN在体内调节炎症和免疫稳态的能力。PD神经炎症指标Iba-1在PBS组呈升高趋势,而在EVN治疗组呈下降趋势 (图4A)。定量分析还表明,EVN能显著抑制小胶质细胞的激活。本研究进一步检测了PD小鼠SN中小胶质细胞从M1表型向M2表型的转变。EVN处理组与PBS组相比,M1特异性CD86+小胶质细胞表达水平显著降低,M2特异性CD206+小胶质细胞表达水平上调 (图4B)。

图5. EVN阻止脑外周免疫细胞浸润的体内治疗机制。(A−F) 不同处理小鼠脑内MPO、DA、8-OHG、CCL2的相对定量 (其中假手术组的相对表达量记为1,n = 5)。(H) 各组脑内巨噬细胞 (CD45high、CD11b+) 的流式细胞术分析和 (I) 定量分析。
作者将8-羟基鸟苷 (8-OHG) 的表达水平作为氧化损伤的标志物来评估EVN减轻PD脑氧化损伤的能力 (图5A)。与模型组相比,MSCCCR2 EVs、MSeN-DT和EVN治疗组8-OHG表达水平显著降低,达到与假手术组相似的水平。这说明EVN具有较强的活性氧清除能力。多巴胺 (DA) 浓度是临床评价PD治疗效果的标准,如图5B所示,他们还对这些小鼠纹状体中DA的浓度进行了评估,以进一步证明EVN的治疗作用。与PBS组比较,MSCCCR2 EVs、MSeN-DT和EVN均使小鼠DA浓度升高。特别是,EVN处理小鼠的DA浓度恢复到与假手术组相似的水平。综上所述,EVN通过激活Nrf2−GPX4通路,有效抑制脑内小胶质细胞的神经炎症。进一步研究了EVN在体内抑制外周细胞浸润的能力。
炎症趋化因子CCL2是PD脑损伤中心炎症细胞归巢的主要介质之一 (图5C)。结果显示,EVN治疗显著降低PD脑中趋化因子CCL2的水平,从而可能减少炎症细胞的浸润。嗜中性粒细胞和巨噬细胞的过度募集和积累导致PD免疫微环境过度激活,增加小胶质细胞的神经炎症。髓过氧化物酶 (MPO) 是中性粒细胞浸润的生物标志物,被用来评估EVN对中性粒细胞浸润的潜在减少。EVN处理后,脑内MPO含量有效降低,与假手术组相当 (图5D)。作者还研究了不同小鼠尾注射后24 h巨噬细胞 (CD45high CD11b+) 的浸润情况 (图5E、5F)。EVN处理的PD小鼠大脑中发现的巨噬细胞较少 (与假手术组几乎相同)。这些数据表明,EVN处理可以显著减少外周巨噬细胞向大脑的浸润。综上所述,CCR2高表达的EVN外壳通过切断CCR2- CCL2轴抑制外周炎症细胞募集,从而促进PD脑内的免疫稳态。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Engineered Extracellular Vesicle-Based Nanoformulations That Coordinate Neuroinflammation and Immune Homeostasis, Enhancing Parkinson’s Disease Therapy
Chuan Zhang, Wei Shao, Hao Yuan, Ru Xiao, Yaru Zhang, Chaoqi Wei, Xinyi Ni, Ning He, Guangliang Chen, Shuangying Gui*, Zhifei Cheng*, Qi Wang*
ACS Nano, 2024, 18, 23014–23031, DOI: 10.1021/acsnano.4c04674
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号