HMGB3和SUB1结合并促进DNA中N²-alkyl-dG损伤的修复
内源性代谢过程和外源性环境污染物暴露都可以诱导N2-alkyl-2'-deoxyguanosine (N2-alkyl-dG) DNA加合物的形成。如果没有被及时修复的话,这些加合物会阻碍DNA复制和转录,并在这些过程中诱导突变。目前,N2-alkyl-dG 损伤的修复途径没有被完全阐明。通过结合光化学交联及基于质谱的定量蛋白质组学分析,本文鉴定了一系列潜在的N2-alkyl-dG 的结合蛋白。其中HMGB3和SUB1两种蛋白可以在体外直接与含有N2-alkyl-dG 加合物的双链DNA高效结合,并显著促进在人体细胞中对这类DNA加合物的修复。
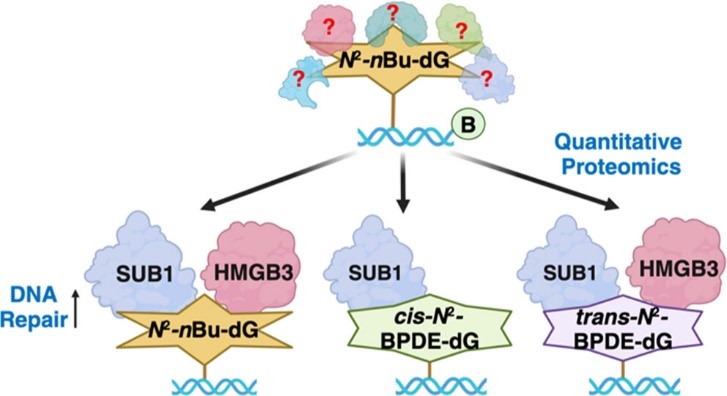
图1. HMGB3和SUB1可以识别并促进N2-alkyl-dG DNA损伤的修复。图片来源:J. Am. Chem. Soc.
HMGB3和SUB1可保护细胞抵抗benzo[a]pyrene-7,8-diol-9,10-epoxide (BPDE) 的暴露。体外结合实验结果显示,相比于未修饰的dG,SUB1与BPDE诱导产生的顺式 (cis-N2-BPDE-dG) 和反式 (trans-N2-BPDE-dG) 两种非对映体异构体有更强的结合力。而HMGB3会优先与trans-N2-BPDE-dG相互作用,但不能区分cis-N2-BPDE-dG和dG。细胞实验结果显示,敲除HMGB3基因会选择性地抑制trans-N2-BPDE-dG的修复,但对cis-N2-BPDE-dG的修复则没有影响。SUB1的缺失则同时抑制细胞对这两种非对映体DNA损伤的修复。
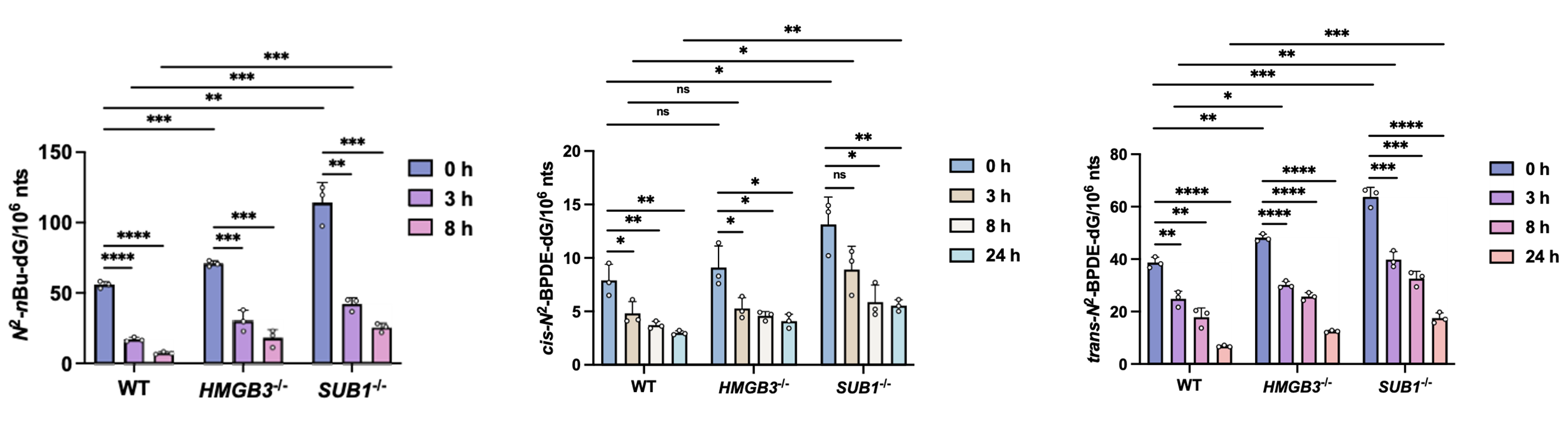
图2. 敲除HMGB3和SUB1基因对HEK293T细胞系中N2-alkyl-dG DNA损伤的修复的影响。图片来源:J. Am. Chem. Soc.
综上所述,研究人员们在这项工作中报道了两种新的参与细胞感知和修复N2-alkyl-dG DNA损伤的蛋白质(SUB1和HMGB3),并发现了HMGB3有对N2-BPDE-dG的立体特异性识别和修复的独特功能。
这一成果近期发表在J. Am. Chem. Soc.上。本工作共同一作为加州大学河滨分校环境毒理系博士生赵婷和博士后何小梅,通讯作者为加州大学河滨分校化学系教授汪寅生。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

HMGB3 and SUB1 Bind to and Facilitate the Repair of N2-Alkylguanine Lesions in DNA
Ting Zhao, Xiaomei He, Xiaochen Liang, Andrew H. Kellum Jr., Feng Tang, Jiekai Yin, Su Guo, Yinan Wang, Zi Gao, Yinsheng Wang*
J. Am. Chem. Soc., 2024, 146, 22553-22562, DOI: 10.1021/jacs.4c06680
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!









































 京公网安备 11010802027423号
京公网安备 11010802027423号