Angew:首个可稳定并激活cGAS的靶向去泛素化酶嵌合体(DUBTAC)
环鸟苷酸-腺苷酸合成酶(cGAS)-干扰素基因刺激因子(STING)信号通路在肿瘤免疫治疗中引起了广泛关注。这条信号通路不仅通过介导天然免疫应答抵抗多种含DNA的病原微生物感染,还能够感知肿瘤来源的DNA并产生抗肿瘤免疫应答。2022年,Nomura课题组基于去泛素化酶OTUB1的小分子共价配体EN523,发展了用于稳定囊性纤维化跨膜电导调节因子(CFTR)的去泛素化酶靶向嵌合体(DUBTAC)技术。然而,由于DUBTACs技术目前应用范围仍有限,适用于DUBTAC的去泛素化酶小分子配体稀缺,因此限制了技术的推广。近期,西奈山伊坎医学院的金坚教授(点击查看介绍)和哈佛大学医学院的魏文毅教授(点击查看介绍)团队对EN523进行了优化,成功开发了更有效的OTUB1配体,并首次报告了基于该配体的DUBTACs在稳定激活cGAS方面的应用,从而抑制相关肿瘤细胞生长。
研究团队通过对OTUB1共价配体EN523的结构优化,获得了更优的化合物MS5105。相比于EN523,MS5105显示了对OTUB1 更高更快的共价修饰(图1A-D)。同时,MS5105比EN523更稳定(图1E),并且其水溶性也明显优于EN523(图1F)。进一步的实验表明,MS5105结合OTUB1但是并不影响OTUB1的去泛素化活性(图1H),是一个理想DUBTACs前体。
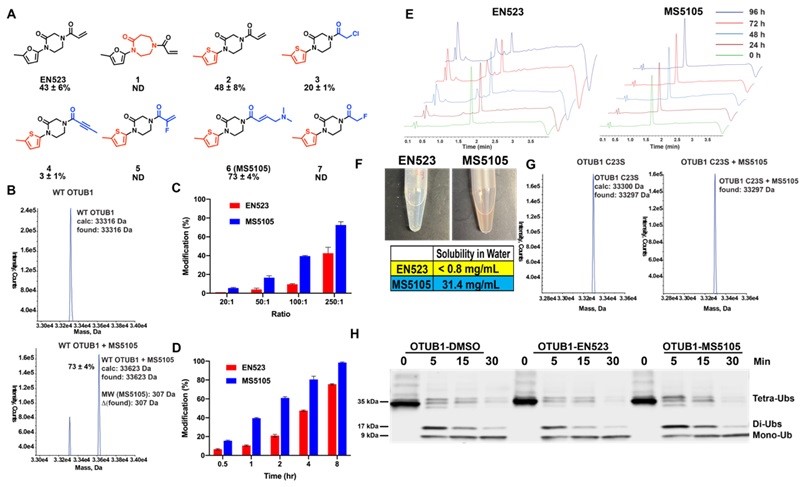
图1
随后,研究团队使用MS5105开发了CFTR DUBTACs(MS6178),并与基于EN523的CFTR DUBTAC(NJH-2-057)进行了比较(图2A)。实验结果表明,MS6178能够显著增加CFTR蛋白水平(约30倍),比NJH-2-057高出约10倍(图2B-D)。以上结果显示了基于MS5105发展相关DUBTACs的巨大潜力。
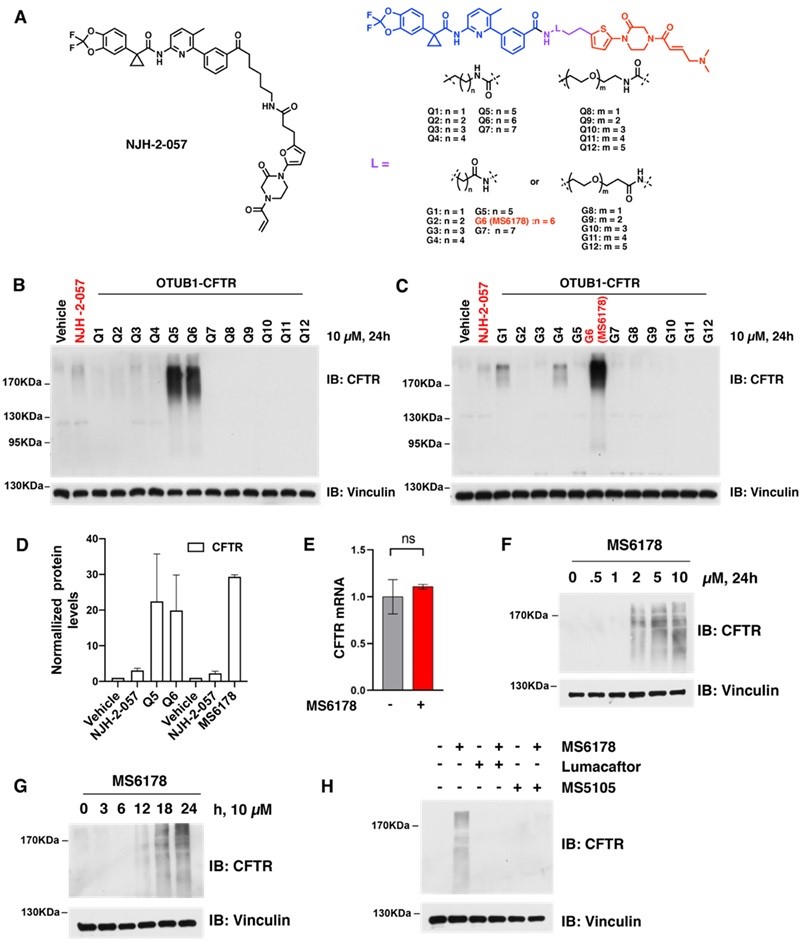
图2
由于稳定cGAS在肿瘤治疗领域的潜在应用,研究团队利用MS5105作为改进的OTUB1配与cGAS抑制剂G140通过不同长度的碳链或者聚乙二醇(PEG)链连接,生成了一系列的cGAS DUBTACs化合物(图3B)。在对HeLa细胞进行5 µM处理后,H8(MS7829)和Z8(MS8588)能显著提高cGAS的蛋白水平(约3-4倍),并增强了下游效应蛋白STING的水平(约2-3倍)(图3C-D)。
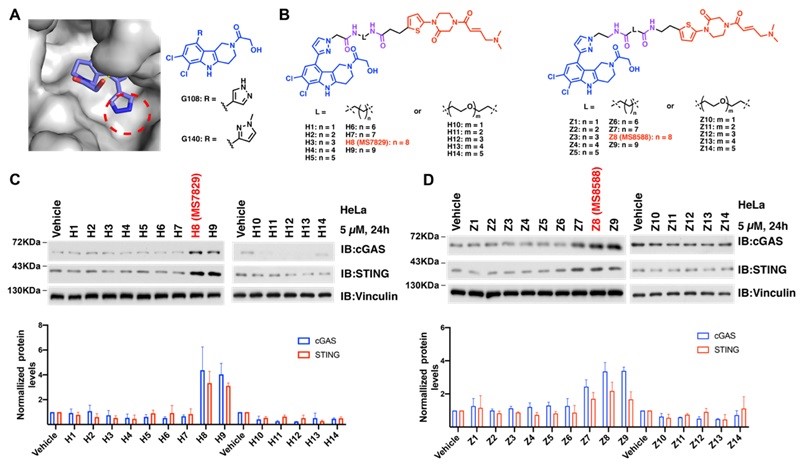
图3
进一步研究表明,MS7829和MS8588以浓度依赖的方式稳定cGAS,并在3小时内有效稳定cGAS(图4A-B)。这些化合物不影响cGAS的mRNA水平(图4C),排除了通过转录调节影响cGAS蛋白水平的可能性。竞争实验表明,MS7829/MS8588诱导的cGAS蛋白稳定依赖于cGAS和OTUB1的结合。同时体外下拉实验显示,MS7829和MS8588能够有效促进cGAS与OTUB1的相互作用(图4G)。

图4
最后,研究团队评估了MS7829和MS8588对cGAS-STING通路下游信号的影响(图5A)。经过化合物处理后,dsDNA刺激下p-IRF3和p-STING水平显著升高(图5B)。MS7829和MS8588显著提高了cGAMP水平,并增加了CXCL10和CCL5的mRNA水平(约6倍)(图5E、F、G)。此外,这些化合物有效抑制了HeLa细胞的增殖和克隆形成能力(图5H、I、J)。这些结果表明,cGAS DUBTACs(MS7829和MS8588)不仅能稳定cGAS,还能激活cGAS/STING下游信号通路,从而有效抑制癌细胞生长。
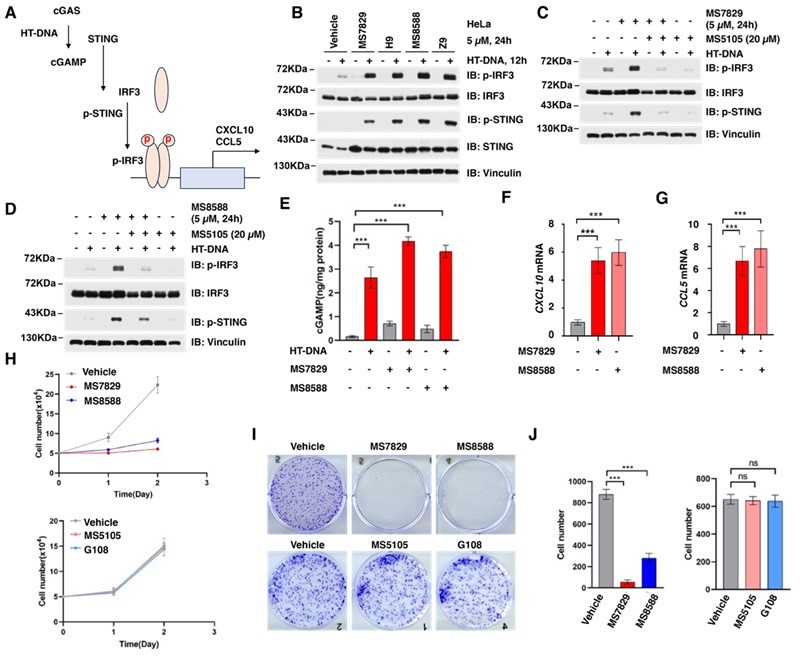
图5
综上所述,研究团队通过改进OTUB1配体,开发了新型cGAS DUBTACs,为抗癌免疫治疗提供了新的工具。这些发现提升了DUBTAC技术的有效性,扩展了其在蛋白质稳定性研究中的应用,为DUBTAC技术的发展提供了支持。相关研究成果已发表于Angewandte Chemie International Edition ,共同第一作者包括邓志杰博士、陈丽博士、钱超博士、刘静博士、吴琼博士、宋向阳博士和熊彦博士,通讯作者为金坚教授和魏文毅教授。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

The First-in-class Deubiquitinase-targeting Chimera Stabilizes and Activates cGAS
Zhijie Deng, Li Chen, Chao Qian, Jing Liu, Qiong Wu, Xiangyang Song, Yan Xiong, Zhen Wang, Xiaoping Hu, Hiroyuki Inuzuka, Yue Zhong, Yufei Xiang, Yindan Lin, Ngoc Dung Pham, Yi Shi, Wenyi Wei, Jian Jin
Angew. Chem. Int. Ed., 2024, DOI: 10.1002/anie.202415168
导师介绍
金坚,著名药物化学家, 美国国家发明家科学院院士,美国西奈山医学院冠名教授,西奈山医疗发展中心主任, 西奈山伊坎医学院药理学系、肿瘤和神经科学系终身教授,帝势癌症研究所癌症临床研究项目共同负责人之一;本科毕业于中国科学技术大学;博士毕业于宾夕法尼亚州立大学,师从著名有机化学家Steven M. Weinreb。金坚教授具有二十多年的小分子药物研发经验,是治疗慢性肾病的上市药物Daprodustat开发者之一,在国际药物化学界享有盛誉。曾任葛兰素史克(GlaxoSmithKline)公司药物化学部门总监、北卡罗来纳大学教堂山分校药物化学部副主任等职。
金坚教授课题组的研究方向主要为:(1)组蛋白甲基转移酶选择性抑制剂的发现;(2)G蛋白偶联受体偏向性配体的开发;(3)靶向肿瘤蛋白新型降解剂的研制。迄今为止已在相关领域发表200余篇SCI论文,包括Nature, Science, Cell, Nat. Med., Nat. Rev. Drug Discov., Nat. Biotechnology, Nat. Chem. Biol., Nat. Reviews Cancer, Cancer Cell, Nat. Cancer, J. Am. Chem. Soc., Angew. Chem. Int. Ed., Sci. Adv., Nat. Commun., J. Med. Chem.等;受邀进行100余次演讲;申请美国及国际专利70余项。
https://www.x-mol.com/university/faculty/311500
魏文毅,著名肿瘤生物学家,美国哈佛医学院终身教授,本科毕业于山东大学;博士毕业于美国布朗大学,师从John M. Sedivy教授;后于丹娜-法伯癌症肿瘤研究所诺贝尔获奖者William Kaelin教授实验室从事博士后研究助理工作。
魏文毅教授团队长期致力于肿瘤生物学的细胞周期调控机制及Akt/mTOR的翻译后修饰研究。现已在Science,Nature,Cell,Cancer Cell,Nature Cell Biology, Cancer Discovery,Molecular Cell,Nature Reviews Cancer等杂志发表上150余篇论文,引用超过14000次。
https://www.x-mol.com/university/faculty/311501
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号