湖南大学“抗-耐药性”抗菌药物实验室招生/招聘启事

湖南大学化学化工学院冯欣欣课题组诚招/聘药学、化学、生物等相关领域的硕士研究生、博士研究生、博士后研究员及科研助理若干名。我们是一个跨学科的科研团队,拥有有机化学、药物化学、化学生物学、微生物学、分析化学背景的导师及研究生,并与国内外微生物、药物化学领域的顶尖课题组保持紧密合作。目前,我们的研究方向主要为具有抵抗细菌耐药性特性(即“抗-耐药性”)的抗菌药物的化学生物学研究。
如果你具备化学、生物、药学、医学等相关专业背景,并希望在学术上更进一步,或者希望开展跨学科研究,欢迎加入我们的团队,一起向科研的更深层次、更高水平迈进。学院和课题组将提供完善的职业规划指导,全方位培养个人能力,全力帮助课题组成员取得学术界或工业界职位。
课题简介及近期成果
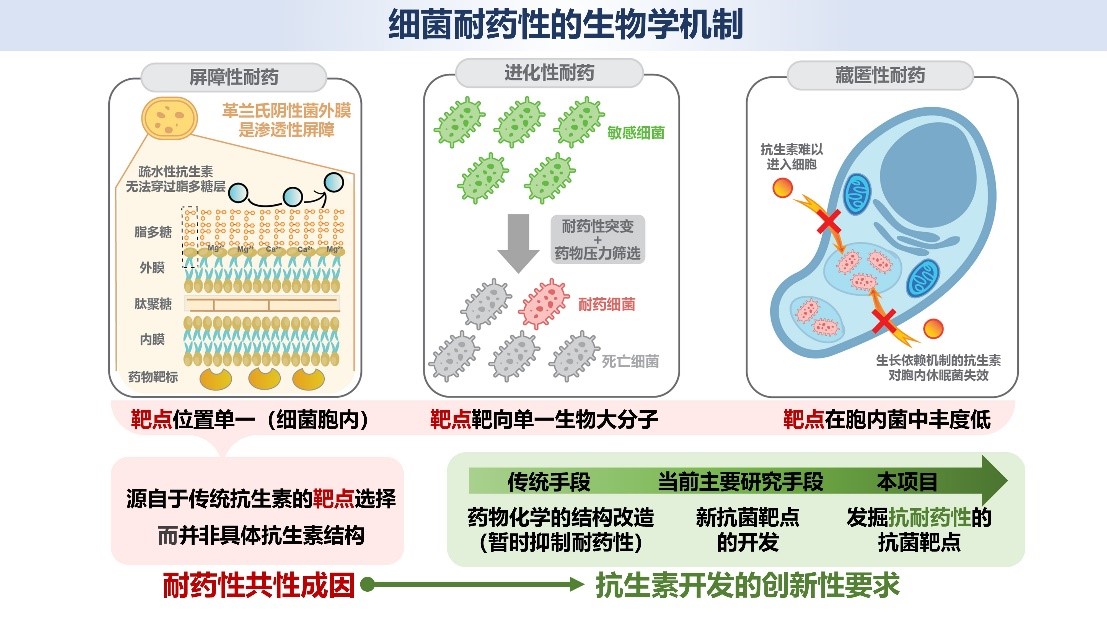
耐药性细菌感染是严重影响人类生命健康及社会经济发展的重大问题。世界抗菌药物开发的困境主要源于传统抗生素固有的靶向机制,即其单一性地靶向细菌外膜以内的生物大分子靶点(如关键蛋白)而带来生长抑制性机制。传统抗生素的靶点选择使得细菌易于产生三种常见的耐药性:外膜对抗生素的阻挡作用形成“屏障性耐药”;蛋白靶点的易突变性促使细菌在药物压力下进化产生“进化性耐药”;细菌入侵细胞、以生长静止的休眠菌形式逃逸抗生素攻击的“藏匿性耐药”。由此可见,新一代抗菌药物的开发并非简单的分子结构改造问题,而是从根源上寻找具有“抗-耐药性”的抗菌靶点的关键科学问题。
在过去的几年中,以 “多重生物分子靶向”策略为基础,课题组开发了一系列新型抗菌分子为克服上述耐药性问题提供思路。为了解决革兰氏阴性细菌的渗透性屏障问题,我们研究了外膜增敏佐剂与抗生素之间的协同作用,并提出了“衍生化增敏”策略,为抗生素增敏提供了一种通用方法(2022 ACSCB1,2023 JACS2,2024 Sci China-Chem3)。为了抑制进化性耐药,我们设计了多靶标抗菌药物并研究了它们的抗耐药机制。这些分子具有新颖的抗菌作用模式,例如膜-蛋白双重靶向(2014 JACS4,2014 JMC5,2015 PNAS6)、膜-DNA双重靶向(2021 Sci Adv7,2024 Sci Adv8,2021 Biomaterials9, 2022 Chem Mater10,2022 Adv Healthc Mater11)、破坏细菌亚细胞结构空间有序度(2024 JACS12,受邀主封面),以及细菌内源活性氧风暴(PNAS审稿中)。这些分子有效根除细菌并抑制细菌进化性耐药。最后,我们通过细胞内体融合的方式,实现了双靶向寡聚物与胞内病原菌的精准亚细胞共定位,有效清除了胞内的持留性细菌(2023 JACS13,2022 CCSChem14)。
导师介绍
冯欣欣博士,湖南大学化学化工学院副教授、化学生物学与分子医学系副主任、药学硕士点学科负责人。2009年,冯博士本科毕业于南京大学化学化工学院,导师为宋友教授,随后赴美国伊利诺伊大学香槟分校化学系攻读博士学位,师从国际著名固态核磁学家和生物化学家Eric Oldfield教授,于2014年获得化学博士学位。2017年,冯博士回国加入湖南大学独立成组,致力于抗菌药物化学生物学领域的研究,获湖南省优秀青年科学基金、湖南省“湖湘青年英才”等多项荣誉。
招生、招聘说明
1、岗位要求:
(1)博士后应聘者35周岁以下,已获得或即将取得博士学位,博士后应聘者博士期间在国际期刊发表优秀SCI论文;
(2)科研助理应聘者已获得或即将获得本科或硕士学位,科研助理可优先推荐攻读湖南大学或香港理工大学的硕士或者博士学位;
(3)博士生招生要求为硕士毕业于“双一流”高校,或所在高校本专业在第四次全国学科评估中获得B-以上(含)评分。
(4)具有有机合成经验、微生物基因编辑、未知靶标鉴定等相关研究背景者优先;
(5)具有较好的英文写作和协调沟通能力;
(6)应聘者具有高度工作责任心,积极主动、踏实肯干、富有团队合作精神并热心组内公共事务。
2、岗位待遇:
(1)博士后:课题组与川渝地区某医院招收联合培养师资博士后,年薪50-70万元(税前),可享受科研启动经费20万元/人附加科研成果奖励,另有每月住房补贴和地区拨发的博士人才生活资助等,综合资助可达80-100万元/年(税前)。医院-高校双导师制,研究工作在湖南大学进行,档案和人事关系在医院,按照医院在编同级同类人员标准缴纳社会保险和住房公积金,达到出站条件后安排医院编制工作岗位。请来信获取更详细信息。
(2)所录用科研助理的薪资待遇等面议(参考湖南大学科研助理标准或附属医院科研助理标准)。
3、申请程序:
请将申请材料发送至邮箱xinxin_feng@hnu.edu.cn,并注明“应聘岗位+本人姓名”。申请材料包括以下内容:
(1)详细的个人简历,含学习、工作和科研的经历等(请附上联系方式);
(2)反映本人学术水平的代表性成果清单(如论文论著、成果证书或奖励等);
(3)其他可以证明工作能力的相关材料。
个人信息将严格保密。
课题组论文
1. Zhou, Y. et al. Cooperative Membrane Damage as a Mechanism for Pentamidine-Antibiotic Mutual Sensitization. ACS Chem. Biol. 17, 3178-3190 (2022).
2. Lei, E. et al. Potentiation of Vancomycin: Creating Cooperative Membrane Lysis through a "Derivatization-for-Sensitization" Approach. J. Am. Chem. Soc. 144, 10622-10639 (2022).
3. Wang, M. et al. Chemical biology investigation of a triple-action, smart-decomposition antimicrobial booster based-combination therapy against “ESKAPE” pathogens. Science China Chemistry (2024).
4. Chan, H.-C. et al. Structure and Inhibition of Tuberculosinol Synthase and Decaprenyl Diphosphate Synthase from Mycobacterium tuberculosis. Journal of the American Chemical Society 136, 2892-2896 (2014).
5. Li, K. et al. Multitarget Drug Discovery for Tuberculosis and Other Infectious Diseases. Journal of Medicinal Chemistry 57, 3126-3139 (2014).
6. Feng, X.X. et al. Antiinfectives targeting enzymes and the proton motive force. Proc. Natl. Acad. Sci. U. S. A. 112, E7073-E7082 (2015).
7. Bai, S.L. et al. A polymeric approach toward resistance-resistant antimicrobial agent with dual-selective mechanisms of action. Sci. Adv. 7, 16 (2021).
8. Zhang, Y. et al. Pyrgos[<i>n</i>]cages: Redefining antibacterial strategy against drug resistance. Sci. Adv. 10, eadp4872 (2024).
9. Chen, Z.Y. et al. An alternatingly amphiphilic, resistance-resistant antimicrobial oligoguanidine with dual mechanisms of action. Biomaterials 275, 10 (2021).
10. Chen, Z.Y. et al. Alternatingly Amphiphilic Antimicrobial Oligoguanidines:Structure-Property Relationship and Usage as the Coating Materialwith Unprecedented Hemocompatibility. Chem. Mater. 34, 3670-3682 (2022).
11. Chen, X.H. et al. Improving the Hemocompatibility of Antimicrobial Peptidomimetics through Amphiphilicity Masking Using a Secondary Amphiphilic Polymer. Adv. Healthc. Mater. 11, 10 (2022).
12. Yang, A. et al. Ligand-Receptor Interaction-Induced Intracellular Phase Separation: A Global Disruption Strategy for Resistance-Free Lethality of Pathogenic Bacteria. Journal of the American Chemical Society (2024).
13. Bai, S.L. et al. Chemical Biology Approach to Reveal the Importance of Precise Subcellular Targeting for Intracellular <i>Staphylococcus aureus</i> Eradication. Journal of the American Chemical Society 145, 23372-23384 (2023).
14. Wang, J.X. et al. Multivalent Display of Lipophilic DNA Binders for Dual-Selective Anti-Mycobacterium Peptidomimetics with Binary Mechanism of Action. CCS Chem. 4, 3573-3586 (2022).
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号