NUS卢一新课题组Nat. Catal.:氮宾介导芳烃C-H键官能化
发展简便的芳烃C-H键官能化方法是有机合成领域的重大挑战之一。过渡金属催化的导向C-H键活化通过引入导向基和谨慎选择催化体系,可以实现选择性活化特定C-H键。芳香亲电取代(SEAr)是经典的芳烃官能化反应类型。近年来,一系列基于SEAr的芳烃C-H键官能化反应陆续被报道;但是利用亲核芳香取代(SNAr)实现芳烃C-H键官能化的例子较少,这主要囿于缺乏简便、高效且温和活化芳烃的方式。
最近,新加坡国立大学(NUS)卢一新(点击查看介绍)课题组在该领域取得了突破性进展,他们利用氮宾转移反应中的“金属-氮宾”基团激活芳烃,在温和条件下实现了叠氮芳烃与一系列亲核试剂的位点专一性反应;此外,通过开发新型手性铱催化剂,进一步实现了立体选择性的芳烃C-H键官能化。这为芳烃分子的高效合成提供了新的设计蓝图,具有重要的应用前景。相关成果以“铱-氮宾介导的芳烃C-H键官能化”(Iridium-nitrenoid enabled arene C-H functionalization)为题发表于Nature Catalysis。新加坡国立大学卢一新教授与美国加利福尼亚大学洛杉矶分校K. N. Houk教授为论文的共同通讯作者;实验部分由漆良文博士完成,理论计算部分由Torben Rogge博士完成。
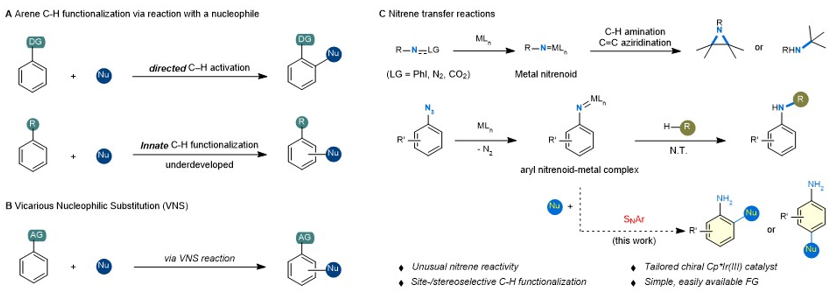
图1. 研究背景及氮宾介导的芳烃C-H键官能化
作者首先考察了吲哚作为亲核试剂与叠氮苯的反应来验证设想。通过筛选过渡金属催化剂发现:“芳烃-亚胺”络合的Ir1催化下,在HFIP中室温反应,能以88%收率获得对位取代的产物,且未观察到邻位取代的异构体生成。值得注意的是,该反应对水氧不敏感,无需特殊保护。普适性考察表明:该反应具有良好的官能团兼容性。邻位或间位烷基、卤素、醚、酯基、芳基取代的苯基叠氮化物均能顺利反应;2,5-双取代耐受性更好,得到更高收率;3,5-二取代时,观察到少量邻位异构体产物生成(对:邻 = 8 : 1)。当对位有取代基时,反应专一性的发生在邻位。此外,该方法还可用于复杂天然产物和活性分子的后期修饰。不同取代的吲哚底物均能使得反应有效发生;N-烷基基团被证实至关重要,吸电子基如酯基能完全抑制反应发生。其它亲核试剂,如1,3-二甲基吲哚、α-芳基-α-氰基乙酸酯、氧杂吲哚、β-萘胺和β-萘酚,也能高效生成相应产物。

图2. 氮宾介导的叠氮芳烃与不同亲核试剂的C-H键官能化
接下来,作者将该方法应用于重要手性分子——2-氨基-2'-羟基-1,1'-联萘(NOBIN)——的催化不对称合成。设想以简单易得的β-叠氮萘和β-萘酚为底物,通过开发新型手性Ir催化剂实现NOBIN的催化不对称合成。实现表明:手性茂基铱络合物Ir2反应活性好,但不能有效诱导立体控制;成功应用于酰基氮宾反应的手性N,N’-双齿络合的Ir3和Ir4不能催化该反应;以手性磷酸或其银盐作为添加剂亦不能实现有效的手性诱导。当使用Davies等人2011年首次报道的手性噁唑啉络合的Ir5时,结果开始变得有趣起来,获得了22% ee。作者接下来通过一系列配体修饰,最终发现3-Oi-Pr-7-Me取代的Ir16获得了最佳结果。值得注意的是,在配体结构中引入3-Oi-Pr取代基非常必要,它既能保证在α位顺利形成铱配合物,同时也能提高其在TFE中的溶解度。

图3. 手性Ir催化剂开发用于NOBIN的不对称合成
普适性考察表明:两分子底物芳环上不同位置、不同电性取代基,如烷基、卤素(溴或碘)、醚、酯、硼酸酯均能很好地耐受,反应均能够获得高收率和高对映选择性。使用C3位带有苯基的β-萘酚时,可以顺利获得C3-Ph的目标分子,其在不对称催化中可能具有重要的不对称诱导潜力。除β-萘酚外,其他酚类,如取代苯酚、β-蒽酚均能有效反应。值得注意的是,反应对于带有C3取代的叠氮萘无效。该方法的另一优势在于通过使用带有不同取代基样式的底物,可以方便快速制备结构多样的NOBINs。另外,克级规模放大实验表明产物和收率均未有明显降低,进一步彰显了本方法的实用性。
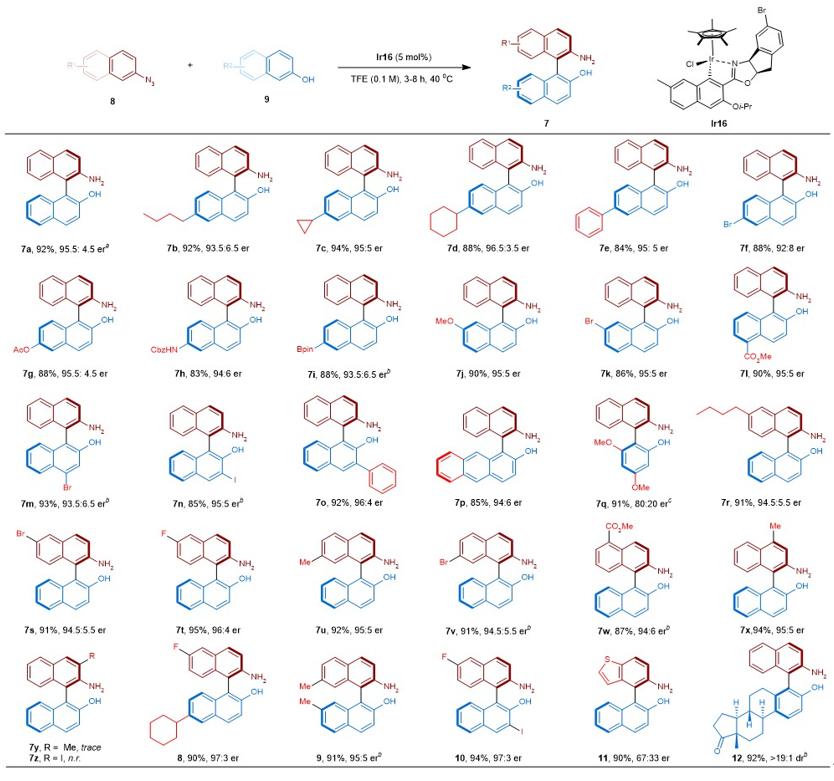
图4. 不对称合成NOBIN底物拓展
为了阐明反应机理,作者进行了详细的机理实验。体系中未观察到副产物7a-1,表明氮宾对萘酚活性C-H键的插入是不利途径。作者还考虑了多种途径生成N,O-二芳基羟胺中间体,然后经历3,3-重排生成NOBIN产物的可能。在标准对照实验中,使用α-甲基-β-萘酚9aa并未观察到NOBIN产物7a'或7a'',而是以86%的收率得到了β-萘酚O-进攻产物13,这否定了重排途径的可能性。自由基淬灭实验表明,自由基阻断剂TEMPO或BHT对反应无明显影响,表明该反应非自由基机理。另外,1H NMR实验观察到C6-Me取代β-叠氮萘在与催化剂反应生成活性中间体后,其C6-Me的化学位移(δ:2.50)向低场移动(δ:2.61),表明生成的铱-氮宾中间体使得叠氮芳烃电子密度降低,从而促进后续的SNAr反应。动力学研究表明,该反应是对催化剂是一级反应,对β-萘酚是零级反应,在低浓度范围内对β-叠氮萘呈正相关,在高浓度范围内呈零级反应;此外,产物ee与催化剂ee呈线性关系。

图5. 机理研究
在上述实验结果基础上,作者进一步通过密度泛函理论(DFT)计算研究了反应的可能途径,为氮宾促进的芳烃C-H键官能化提供了合理解释。值得注意的是,对C3取代的β-叠氮萘底物为何不能有效参与反应也做出了合理解释,可能是由于阻碍了中间体Int5的质子化过程,从而使重芳构化过程无法实现。计算结果表明生成铱-氮烯中间体是反应决速步,这与动力学研究和非线性效应的观察结果一致。
总结
新加坡国立大学卢一新团队打破了一个多世纪以来氮宾固有的插入反应性,并基于此发展了一种实现芳烃官能化的简便策略,实现了叠氮芳烃与一系列亲核试剂的高选择性官能化反应;通过手性茂基铱催化剂的开发,完成了联萘胺酚分子的高效不对称合成。该芳烃C-H键官能化方法为芳烃分子的合成提供了一种简便方法。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Iridium nitrenoid-enabled arene C−H functionalization
Liang-Wen Qi, Torben Rogge, K. N. Houk & Yixin Lu
Nat. Catal., 2024, DOI: 10.1038/s41929-024-01207-3
导师介绍
卢一新
https://www.x-mol.com/university/faculty/78603
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号