江南大学许菲团队Angew:同时设计高活性和热稳定性甲基对硫磷水解酶的双焦点工作流程
工业发酵生产需要在极端高温和pH值等恶劣条件下高效且稳定的酶,然而,由于天然酶受自然进化的限制,无法满足实际工业应用的条件,此外在设计天然酶来提高稳定性通常会导致催化活性的丧失,反之亦然,即所谓的活性-稳定性权衡,极大地限制了酶生物技术的发展。那么,如何克服酶活性稳定性的权衡,使其兼具高稳定性与高催化活性呢?近日,江南大学许菲教授(点击查看介绍)团队以中温有机磷降解酶——甲基对硫磷水解酶 (MPH) 为模式酶,开发了双重聚焦的计算机设计流程,将定向进化和靶向突变的优势进行结合加速兼具高活性和耐热酶的开发。
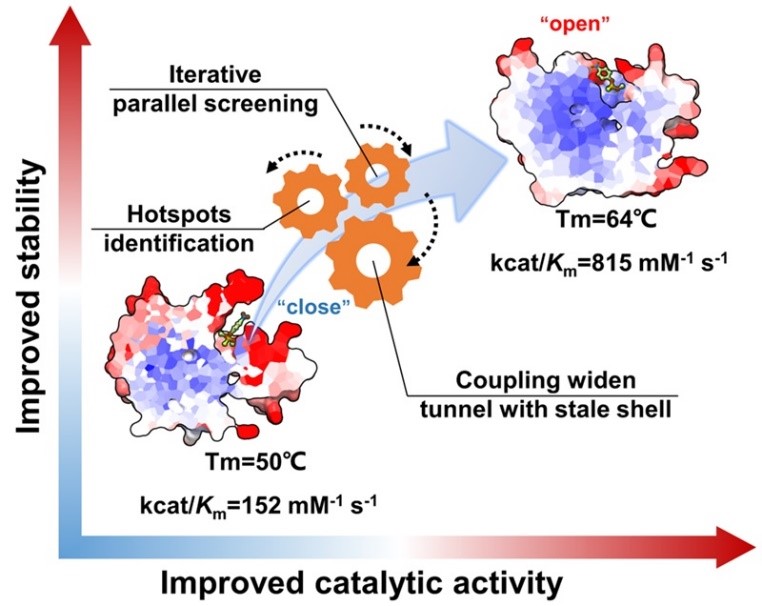
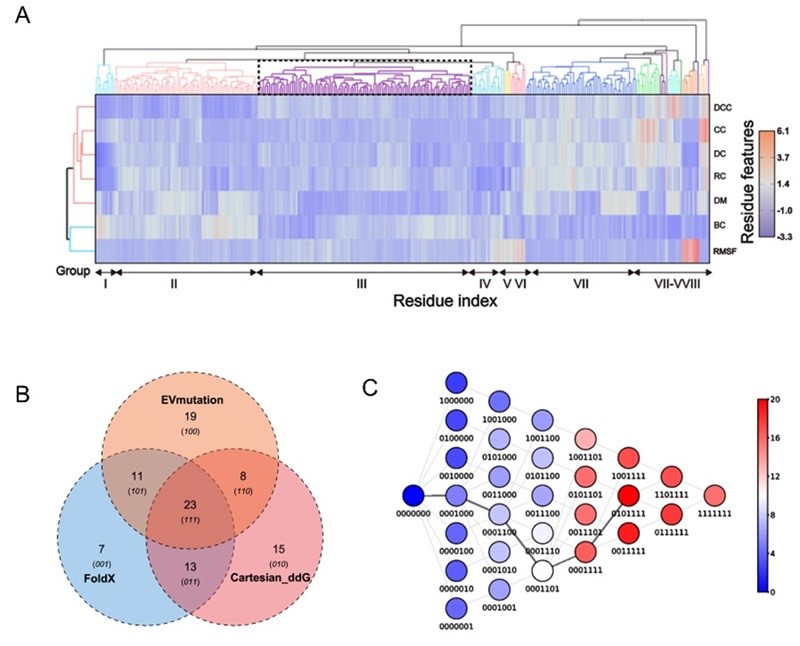
作者首先提出了一种三阶段的酶工程策略,通过酶序列位点氨基酸的物化特征提取,聚类分析筛选热点和计算机虚拟突变,经实验验证后选择了7个候选单点突变体。随后,通过多轮的平行迭代突变筛选成功地生成了具有更高稳定性和活性的甲基对硫磷水解酶复合突变体MPHase-m5b。该突变体与野生型MPH相比,表观熔融温度(Tm)提高13.3 °C,半衰期t1/2延长21.3分钟,热半失活温度T50提高4.0 °C。此外,增强的酶热稳定性并没有以牺牲催化效率为代价,其中MPHase-m5b的催化效率在20-70 ℃温度范围下全面高于野生型酶,且最高催化活力提高4.2倍。
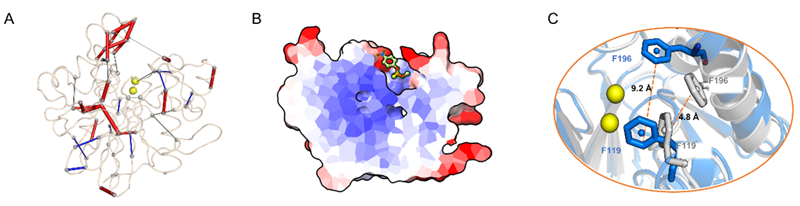
随后通过蛋白质晶体学、QM/MM 计算和分子动力学模拟的深入分析表明,关键的第三壳层突变共同赋予了突变体 MPHase-m5b独特结构和动力学特征。其中,在内部,这些突变重塑了底物输送路径形态,扩大了底物进入活性位点的入口,从而提高了酶催化活力。在外部,突变驱动了蛋白质外壳残基之间的非共价相互作用数量的增加,增强了在较高温度下催化所需的结构完整性。
总之,这种合理的工程流程通过同时聚焦多种酶特性提供了一种克服传统工程权衡的替代策略。因此,这项概念验证研究为开发更高效、更强大的商业生物催化剂提供了概念基础,以满足日益增长的工业和生物医学对高性能酶的需求。
相关论文发表于Angew. Chem. Int. Ed.,文章第一作者为江南大学博士研究生李英南和厦门大学博士生付玉状(现为中国药科大学博士后),通讯作者为江南大学许菲教授,厦门大学曹泽星教授和清华大学范仕龙博士。这项工作得到了国家重点研发计划,国家自然科学基金等项目的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A Dual-Focus Workflow for Simultaneously Engineering High Activity and Thermal Stability in Methyl Parathion Hydrolase
Yingnan Li, Yuzhuang Fu, Xiling Chen, Shilong Fan, Zexing Cao, Fei Xu
Angew. Chem. Int. Ed., 2024, DOI: 10.1002/anie.202410881
通讯作者简介
许菲博士,江南大学教授、博导,第十一批国家级青年人才计划、江苏省双创人才、江苏省特聘教授、六大高峰人才(B类)。主要从事蛋白质与多肽的计算设计、制备与性能研究。目前已在Nat. Commun. , JACS, Angew. Chem. ,PNAS,Nucleic Acids Res. 等杂志发表一作/通讯多篇原创性学术论文。
https://www.x-mol.com/university/faculty/81310
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号