胡萝卜催化的对映选择性还原,还有续集
副标题:利用基于配体的药物设计原理挖掘药用相关酮的生物还原
2023年,美国AbbVie Inc(艾伯维公司)的Wen-Ju Bai(白文举)等研究者使用简单的反应装置和紫色胡萝卜,成功地实现了氮杂芳香酮的对映选择性生物还原(图1a)(ACS Med. Chem. Lett. 2023, 14, 846–852,参见:“胡萝卜,催化对映选择性还原?”)。但是据统计,氮杂芳香结构只占美国FDA批准上市的小分子药物的24%,更多的是N,O,S-杂环结构(图1b-c)。于是,AbbVie团队继续探索胡萝卜催化领域,发展出了一条快速、有实践价值的普适性方法来拓展底物类型(图1d),相关成果近期发表在Journal of Medicinal Chemistry。
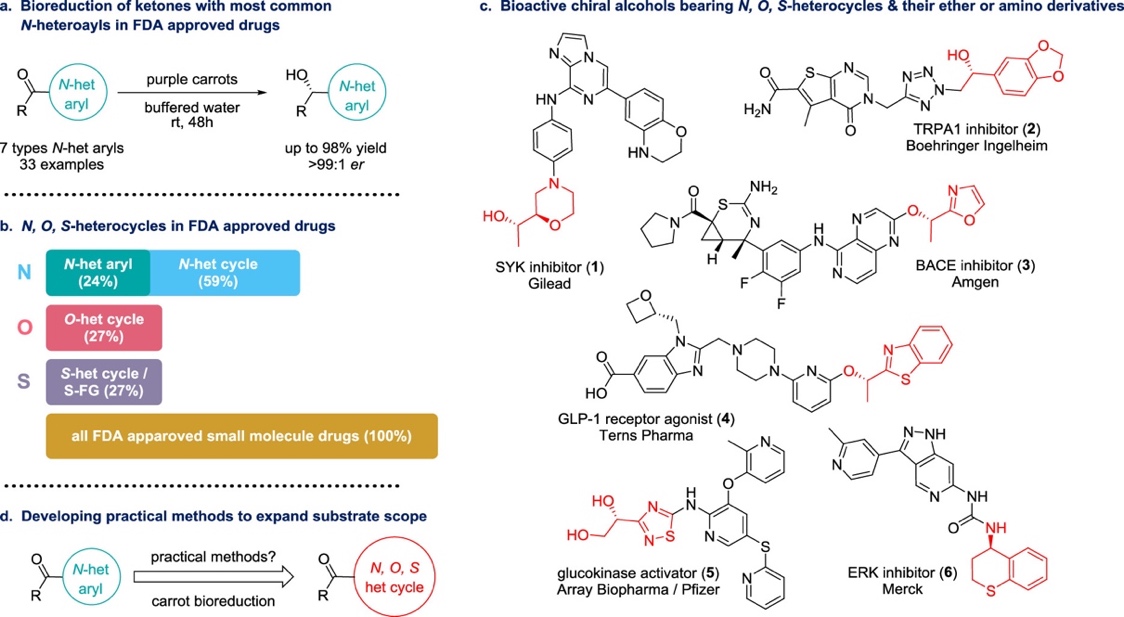
图1
高通量筛选是研究反应底物类型的常用方法,但其过程涉及大批量底物采购、高通量实验、手性产物的对映选择性分析等,耗资不菲;而分离和鉴定胡萝卜中的酮还原酶也耗时、费力。那么,在不知道该还原酶结构的情况下,如何不依赖繁琐的实验来拓展该反应的底物类型呢?
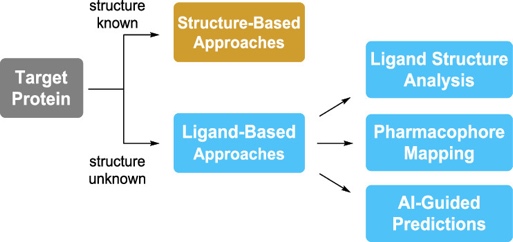
图2
研究团队发现,这个问题与药物研发中的一个情形类似:在不知道靶点蛋白结构的情况下,如何推进药化课题,从而发展出生物活性更好的药物分子呢(图2)?基于此,AbbVie团队探索是否可用“基于配体的药物设计”这一药物化学指导方针,来解决胡萝卜生物催化中遇到的底物类型问题。
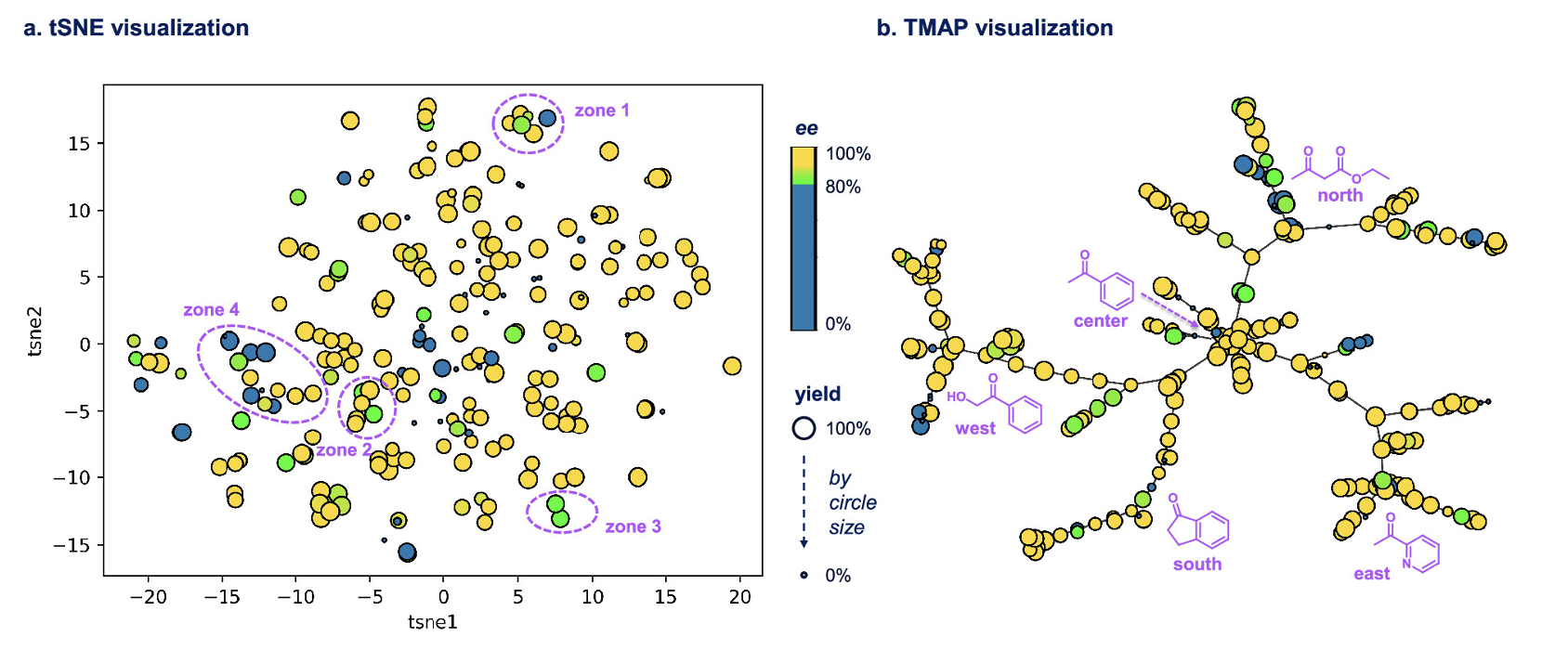
图3
首先,该团队搜集了文献报道的237个胡萝卜催化底物,并对它们进行了tSNE和TMAP在内的结构分析(图3a-b)。tSNE和TMAP把三维的小分子结构降为计算机可以理解的二维信息,是药物研发中小分子结构分析的常用手段。在tSNE分析中,两个点离得越远,代表这两个底物的化学结构越不相同;TMAP分析则展示了小分子之间的结构相关性。经tSNE和TMAP分析,该团队发现:1)文献报道的底物类型的化学结构比较局限,大部分为苯乙酮类型底物;虽包含部分氮杂芳香酮(大都来自于2023年AbbVie自身团队的报道),但仍缺乏药用相关的N,O,S-杂环酮结构。2)当该生物催化的反应活性足够好时,所得产物的对映选择性很高。在文献报道的反应收率≥50%的173个底物中,有163个的产物对映选择性在90:10以上(占比94%)。因此,AbbVie团队决定:对该胡萝卜催化反应,仅需预测反应收率,不必预测产物的对映选择性。
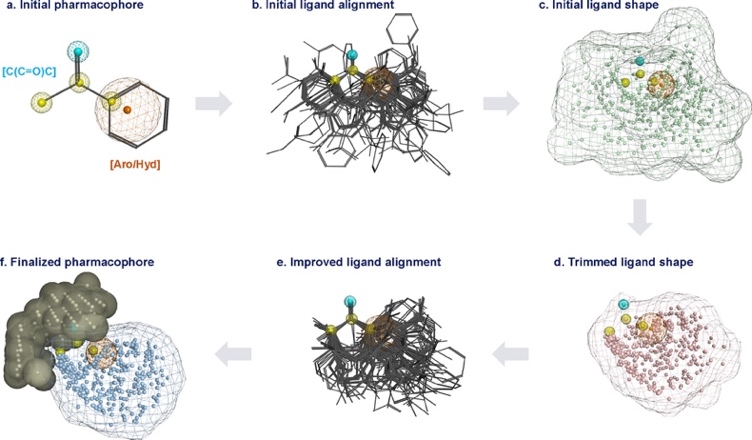
图4
然后,该团队利用现有的237个文献底物,通过6个步骤(图4a-f),构造了一个药效团,来模拟胡萝卜中酮还原酶的结合口袋。该药效团可用于定性筛选,有效去除位阻大的新底物。
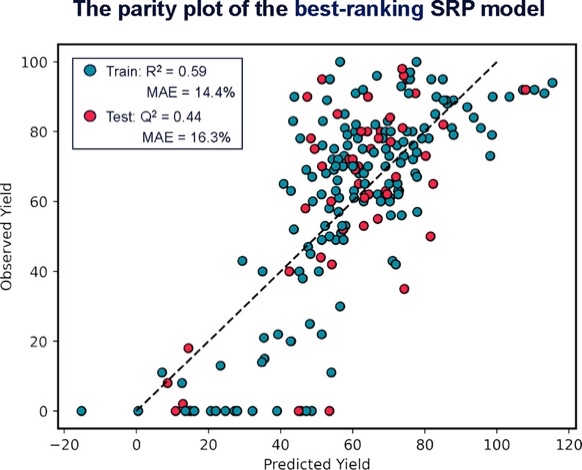
图5
接着,该团队利用机器学习程序构建了SRP(structure reactivity prediction,化学结构与反应活性预测)模型(图5)。根据新底物的化学结构,该模型可预测出这个底物在胡萝卜催化反应中的收率。故而,该SRP模型可用于定量筛选,去除反应活性低的底物。
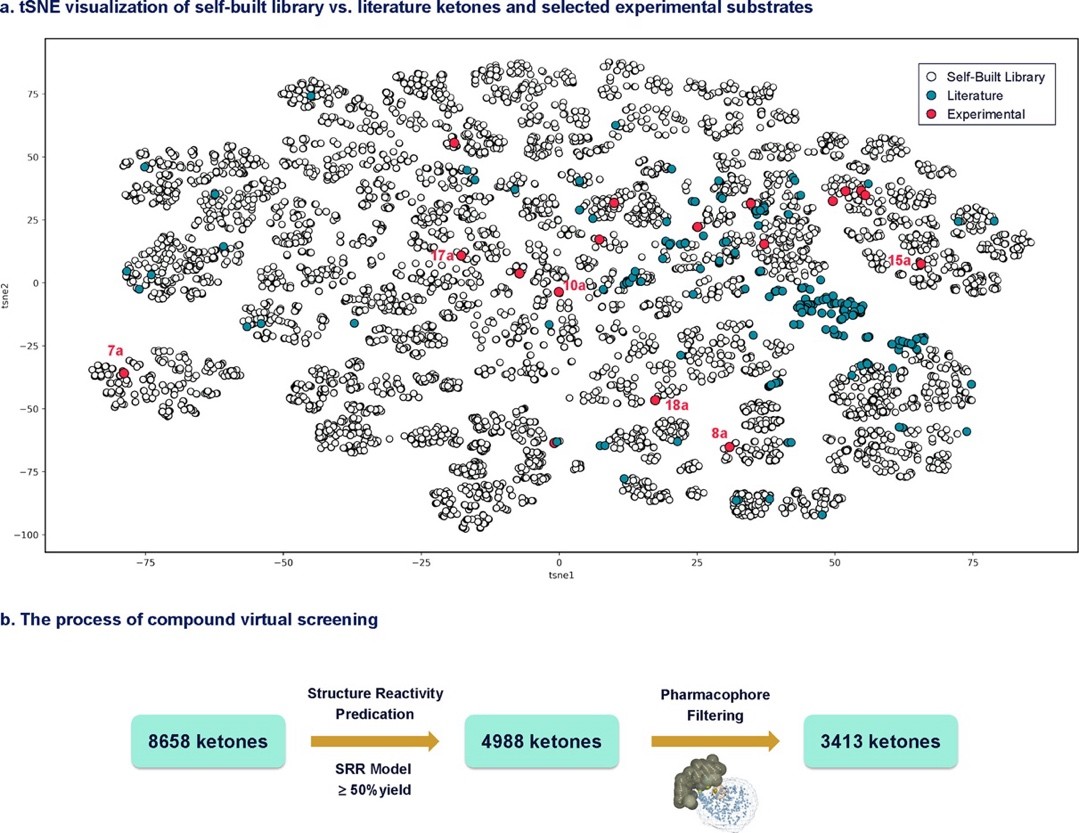
图6
随后,该团队以FDA批准的小分子药物中最常见的N,O,S-杂环结构和药物研发中最常用的官能团为蓝图,构建了药用相关酮的虚拟化合物库,包括高达8658个分子(图6a,灰色小点)。接着,作者用SRP模型和药效团对该化合物库进行定量和定性两层筛选,分别耗时3分钟和15分钟(图6b)。在获得的3413个酮底物结果中,团队通过tSNE结构分析,选取了与文献报道的底物(图6a,墨绿色小点)结构较远的14类、共18个新颖的酮底物(图6a,红色小点)进行实验验证。

图7
实验发现,与预测一致,包含morpholine、benzodioxole、oxazole、benzothiazole、thiochromane等在内的酮均可被胡萝卜催化还原(图7)。需要注意的是,α-酮酸酯类底物存在酯水解的副反应,oxadiazole类底物的紫外吸收较弱而导致产物难以柱层析纯化,isoxazole类底物在反应条件下不稳定而分解。因此,这几类底物的实验收率与预测收率有较大出入。
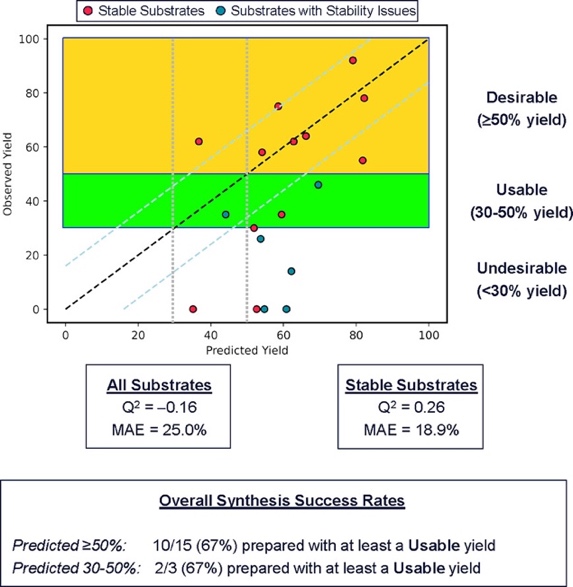
图8
总体来说,该SRP模型的预测与实验结果不尽如人意(图8)。但需要指出的是,反应收率的预测在化学界是个极具挑战性的难题。在本研究中,部分底物的不稳定性、低紫外吸收等因素很难被SRP模型事先捕捉到。另外,不同实验操作人员也可引起收率差异。在文献数据的收集中,反应装置、温度、缓冲液、胡萝卜品种等反应条件的不一致性被完全忽略。此外,文献数据也分布不均,缺乏负面的反应结果。这些因素共同造成了构建SRP模型和反应收率预测上的挑战。但是,从实际应用的角度出发,当底物通过了两层筛选(位阻不大且预测收率≥50%),那么该底物大概率(67%可能性)可以被胡萝卜催化还原,且以至少30%的收率制得相应的手性醇。这在药物化学上十分重要,尤其是当有一批结构多样的酮需要测试时(例如>100个底物),先花几分钟预测,再选择性实验,可节约企业人工时间,降低经济成本。
小结
受药物化学中“基于配体的药物设计”的启发,AbbVie公司以Wen-Ju Bai为首的研究团队发展了一种快速的方法来拓展胡萝卜催化反应的底物类型。通过构建药效团和SRP机器学习模型,该团队对超过8000个药用相关酮在内的自建虚拟化合物库进行定量和定性两层筛选和实验验证。该方法不仅在药物化学上有直接的应用价值,而且也具有普适性、可用于解决未知结构酶参与的化学反应的底物类型问题。AbbVie团队的研究思路结合了药物化学和生物催化两大领域,展现了利用药物化学原理来解决生物催化难题的新颖视角。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Mining Medicinally Relevant Bioreduction Substrates Inspired by Ligand-Based Drug Design
Alexander J. Rago, Ioanna Zoi, Jackson A. Gartman, Kelly A. McDaniel, Navendu Jana, Dachun Liu, and Wen-Ju Bai*
J. Med. Chem. 2024, 67, 13174–13186. DOI: 10.1021/acs.jmedchem.4c01129
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号