代明骥教授课题组JACS:利用可控的Cargill重排实现Crinipellins A和B简洁全合成
注:文末有本文科研思路分析
Crinipellins A和B属于二萜类天然产物,由Steglich等人从伞菌目毛皮伞属Crinipellis stipitaria 中分离得到,此后许多其他crinipellin家族的分子也被发现。这些化合物的结构特点是具有一个四环碳骨架,其中包含一个线性三奎烷环和一个角状三奎烷。这些分子中包含三个相邻的全碳季碳以及八个立体中心并且在已高度拥挤的四环结构中还嵌有多个含氧基团。此外,A环中的α-亚甲基酮和α,β-环氧化物以及C环中的α-羟基酮,使得crinipellins A和B对各种条件非常敏感。
由于共价抑制剂的研究方兴未艾,Crinipellins A和B中的α-亚甲基酮和α,β-环氧化物使它们成为潜在的蛋白质共价修饰剂。因此,通过更高效策略实现crinipellins A和B的全合成来支持后续的生物学评估,包括靶点鉴定,是十分有前景的研究课题。迄今为止,Edward Piers、Hee-Yoon Lee、杨震、丁寒峰教授的课题组报道了四种优雅的全合成方法,也为该家族分子的全合成设定了很高的标准。

图片来源:J. Am. Chem. Soc.
埃默里大学代明骥(点击查看介绍)课题组另辟蹊径,提出先以Cargill重排反应来构建四环碳骨架,再经后期氧化态安装实现crinipellins的全合成策略。以(S)-carvone为起始物,烯丙基烷基化及RCM反应构建双环片段;通过手性辅基诱导的共轭加成及DIBAL-H还原得到长链片段醛。运用Kozikowski形式β-烷基化方法连接两个片段,烯酮经[2+2]环加成反应有效地构建了三个相邻的全碳季碳。考察多种路易斯酸促进的Cargill重排反应,发现Et2AlCl为最好的条件。Cargill重排产物经过环氧化,选择性开环氧,氧化三步转化得到α-亚甲基酮。通过将两个羰基都转化为相应的TES烯醚,分别运用Saegusa-Ito氧化在位阻小的烯醇侧转变为烯酮,Rubottom氧化引入α-羟基, 最后通过张力控制的选择性环氧化实现Crinipellins A和B简洁全合成。
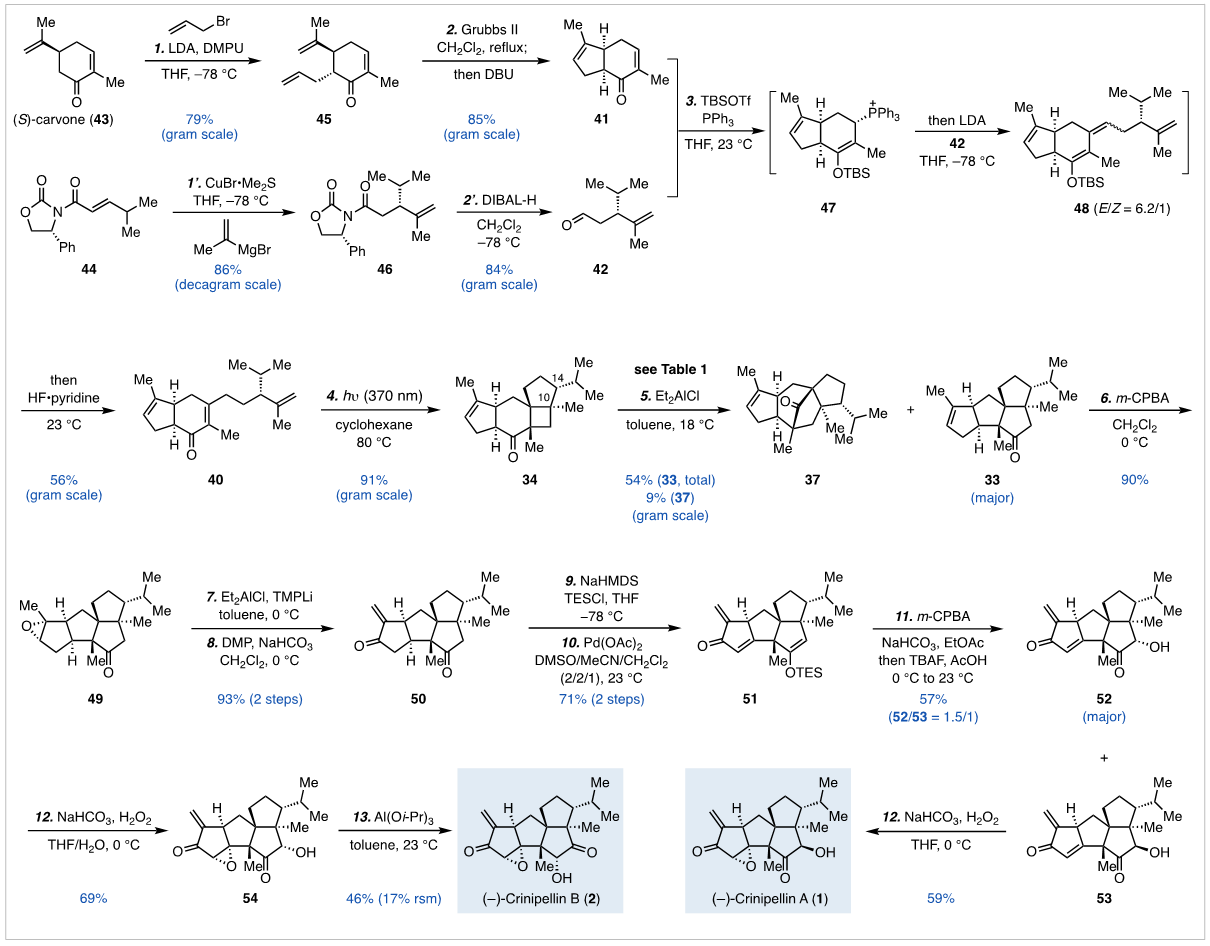
图片来源:J. Am. Chem. Soc.
小结
通过对Cargill重排的调控,作者实现了对crinipellin A的12步全合成和crinipellin B的13步全合成。此外他们通过与UC Davis的Tantillo教授合作,利用计算化学对所用的Cargill重排机理进行了进一步研究。该项工作最近发表于J. Am. Chem. Soc.,合成部分的研究由许波博士和张梓曜同学共同完成。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Concise Total Syntheses of (−)-Crinipellins A and B Enabled by a Controlled Cargill Rearrangement
Bo Xu, Ziyao Zhang, Dean J. Tantillo*, Mingji Dai*
J. Am. Chem. Soc., 2024, 146, 21250–21256, DOI: 10.1021/jacs.4c07900
导师介绍
代明骥
https://www.x-mol.com/university/faculty/353145
课题组主页
科研思路分析
Q:这项研究最初是什么目的?或者说想法是怎么产生的?
A:Pirrung教授对isocomene的全合成令人拍案叫绝,被多本全合成书籍列为经典(如K.C. Nicolaou, Classics in Total Synthesis 第14章; Tomas Hudlicky, The Way of Synthesis, 第3.7章节)。本工作最初的灵感来源于Pirrung教授的研究,但又不仅仅停留在模仿层面,某种意义上说即是对经典的致敬也是对经典的超越。
Q:研究过程中遇到哪些挑战?
A:本项研究中最大的挑战是如何控制Cargill重排的选择性,但最难实现的是最后怎样引入α-羟基,后期的中间体对各种条件非常敏感,不仅要避开前人的研究思路且要探索更高效方法,这导致最后氧化态引入探索花费了占该课题一半以上的时间。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!

















































 京公网安备 11010802027423号
京公网安备 11010802027423号