基于π配位活化吡啶环的钌催化氨基吡啶SNAr胺化
吡啶类化合物在医药、催化等领域应用广泛。由于sp2杂化氮原子的存在,吡啶通常与过渡金属生成η1配合物。在合成化学领域,该特性被广泛应用于配体的发展以及导向的C–H键和C–C键活化。西湖大学石航(点击查看介绍)课题组致力于开发π配位活化芳香环的反应体系,基于过渡金属与苯环形成η6配合物而建立了一系列催化反应。近日,该课题组通过研究过渡金属与吡啶环的π配位模式,实现了钌催化的氨基吡啶SNAr胺化反应,为杂芳香环催化转化提供了新的思路。相关研究论文发表于《美国化学会志》(J. Am. Chem. Soc.)。
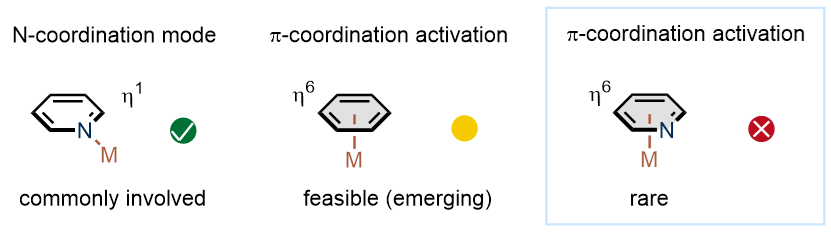
图1. 过渡金属与芳香环代表性配位模式。图片来源:J. Am. Chem. Soc.
首先,作者制备了4-甲基-2-氨基吡啶的η6配合物1a',并通过配合物实验成功实现了4-甲基-2-氨基吡啶的取代反应。进一步,以2-氨基吡啶和正己胺为模板底物,通过配体优化,发现大位阻的三叔丁基Cp钌催化剂(cat.10、cat.11)展示出高催化活性,反应收率达到97%−100%(图2)。当使用MgBr2、Mg(OTf)2、AlCl3、Sc(OTf)3等30多种路易斯酸代替钌催化剂时,最优仅有小于1%的痕量产物被检测到。该控制实现揭示π配位活化的独特性。
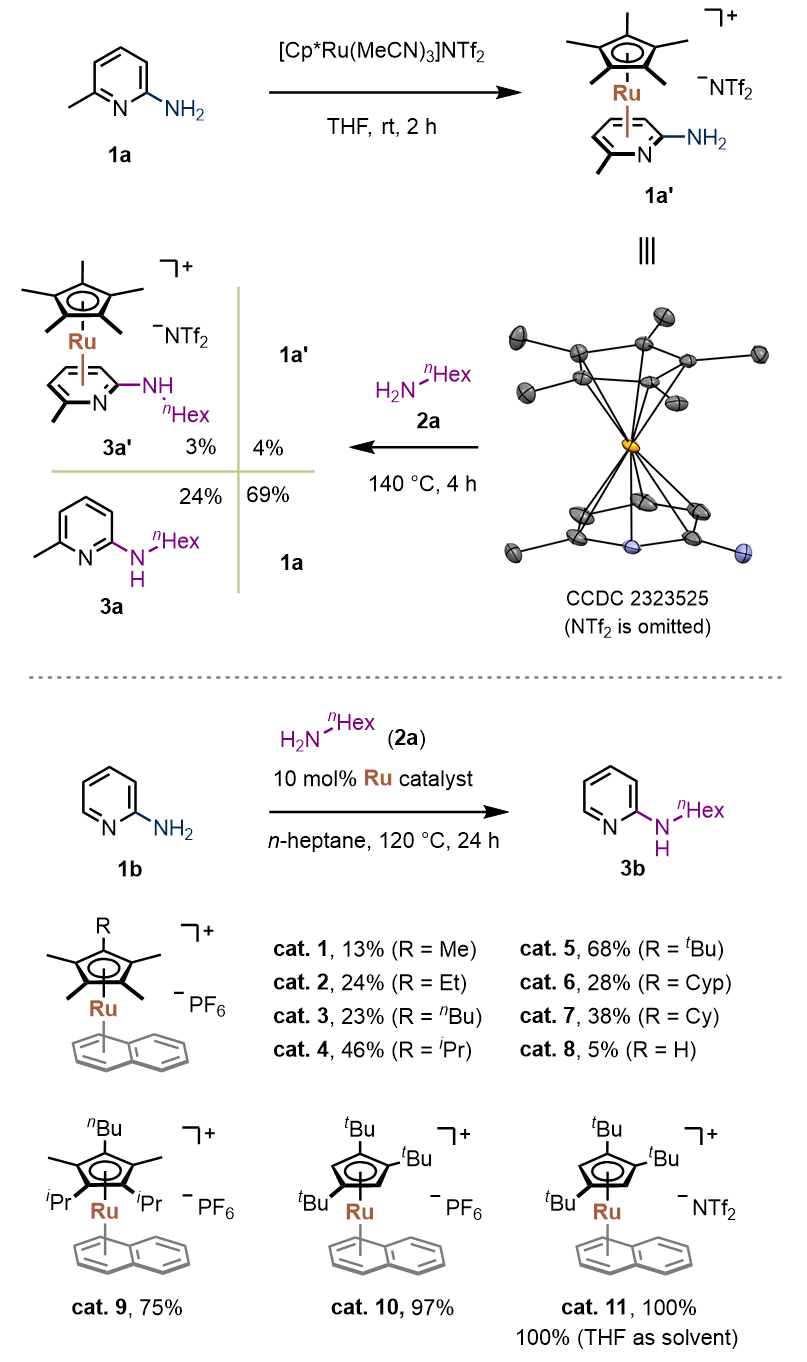
图2. 反应开发。图片来源:J. Am. Chem. Soc.
该催化反应兼容炔基、硅基、氨基、烯基、羟基、缩醛等各种官能团。另外,当采用含立体中心或者15N标记的烷基胺时,分别得到大于96%手性保持、大于20:1顺反保持以及大于93% 15N标记率的目标产物。然而,3-氨基吡啶反应收率较低(图3)。
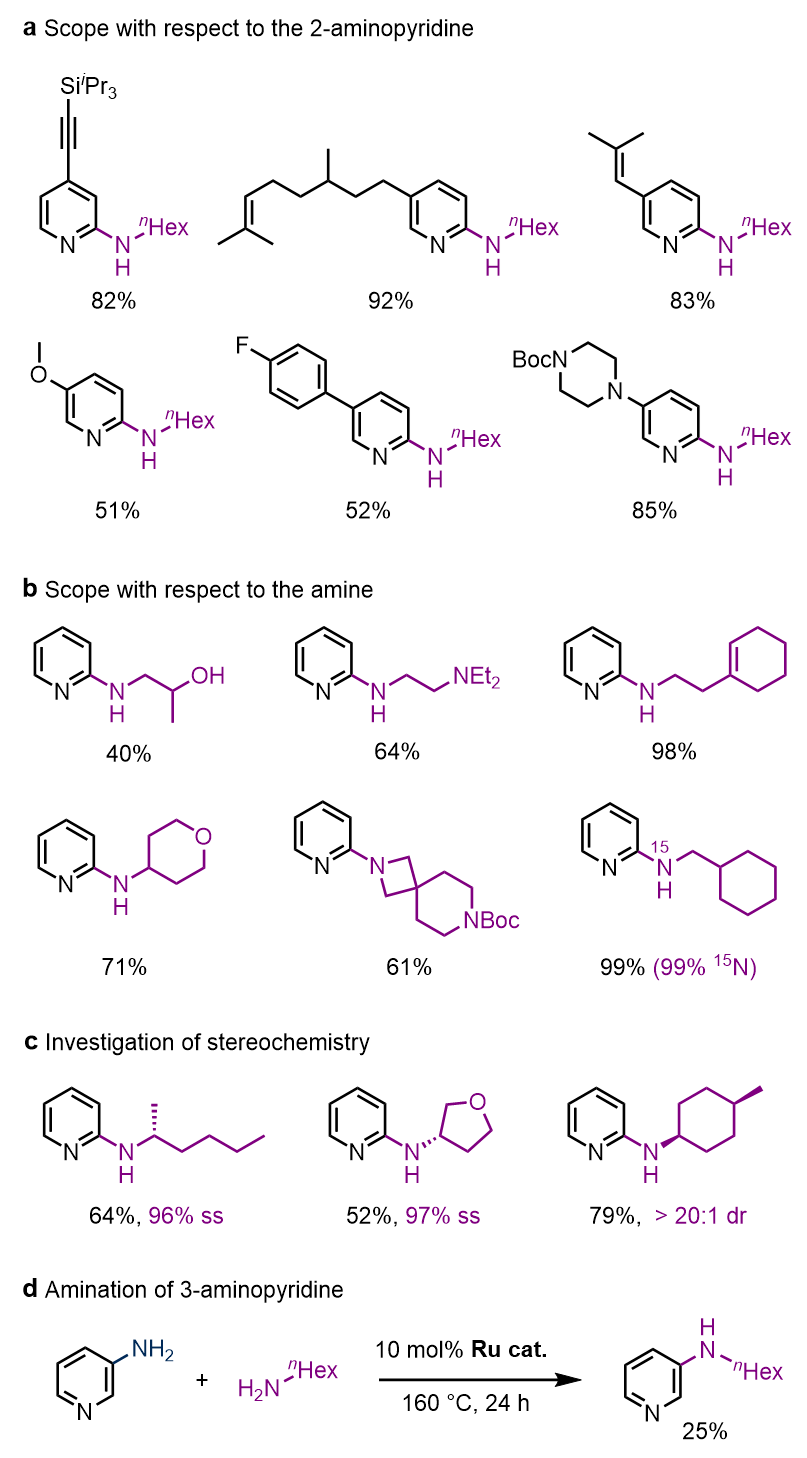
图3. 部分底物展示。图片来源:J. Am. Chem. Soc.
Ru催化剂与胺基吡啶配位监测实验支持η6-氨基吡啶是重要的反应活性中间体(图4)。此外,配合物反应实验揭示:相比于五甲基Cp,三叔丁基Cp配体可以显著提高钌配合物的取代反应效果(见原文)。

图4. π配位监测实验。图片来源:J. Am. Chem. Soc.
综上,石航课题组发展了吡啶环的η6配位活化策略,建立了钌催化的氨基吡啶与烷基胺的SNAr反应,为杂芳环的官能团转化提供了新策略。相关后续研究工作正在进行中。上述成果于近日发表在J. Am. Chem. Soc.上,西湖大学博士后陈佳佳为论文的第一作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Amination of Aminopyridines via η6-Coordination Catalysis
Jiajia Chen, Yunzhi Lin, Wen-Qiang Wu, Wei-Qiang Hu, Jingkai Xu, Hang Shi*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c07306
导师介绍
石航课题组网站地址:
https://hangshi.lab.westlake.edu.cn
https://www.x-mol.com/groups/shi_hang
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!

















































 京公网安备 11010802027423号
京公网安备 11010802027423号