Nat. Synth.:铁催化C(sp²)-H键活化构建全新共轭氮杂环
氮杂环化π拓展(aza-annulation π-extension, AAPE)反应能够在共轭分子上有效构建复杂的稠合氮杂芳烃结构。通过AAPE反应,可将亚胺部分作为受体单元整合到共轭体系中(图1a),从而产生具有独特材料性质的供体-受体体系。理想情况下,铁催化的AAPE反应可使用商业易得的羰基化合物并在氮源和炔烃的存在下直接活化C-H键。然而,过渡金属催化剂与拓展π体系通过键合和反向键合相互作用阻碍了有效接近C-H键,常会导致催化剂效率和选择性的降低(图1b)。相比之下,大位阻三膦配体络合的铁(III)催化剂或许是一个不错的选择,这是因为:1)大位阻铁(III)/三膦催化剂与拓展π-体系通过键合和反键合相互作用通常较弱;2)去质子化机制倾向于支持更酸性的拓展π-体系C-H键而非苯的C-H键。此外,苯并呋喃三膦配体(TP1)络合的铁配合物的单晶结构表明五个芳基取代基发挥了空间位阻作用(图1c),阻止了催化活性铁中心与拓展π-体系的相互作用,而π分子上的外围C-H键位点可以接近铁中心以诱导σ-相互作用特性。事实上,该方法在五并苯醌、喹吖啶酮和5,7,12,14-并五苯四酮(传统有机半导体和颜料的前体)的制备中具有重要应用价值,其能以经济高效的方式合成具有全新共轭骨架的新型分子并将其用于电子材料的开发(图1d)。然而,铁催化C-H键活化仍存在一些挑战,包括导向基类型有限、氧化C-H键偶联与碳亲核试剂的竞争等问题。
近日,日本东京大学的尚睿教授和Eiichi Nakamura教授课题组利用大位阻三膦配体来减弱Fe-π相互作用,通过肟导向的炔烃C-H键环化反应,成功地实现了铁催化共轭羰基化合物(如:喹吖啶酮、五并苯醌、并五苯四酮)与炔烃的AAPE反应(图1e),并以良好的产率获得一系列共轭氮杂芳烃,特别是并五苯四酮还能实现四重C-H键活化且每步平均产率高达95%。具体过程如下:首先,异丁基邻苯二酚铝(III)促进了烷基与Fe(III)的金属转移并使邻位C-H键去质子化,从而形成异丁烷和铁环中间体I。随后,炔烃插入中间体I的Fe-C键并形成七元铁环中间体II,经还原消除生成N-甲氧基吡啶鎓,其可作为氧化剂将Fe(I)氧化为Fe(III)。与此同时,亲氧性铝(III)捕获甲氧基阴离子以阻止其与Fe(III)配位。相关成果发表在Nature Synthesis 上。
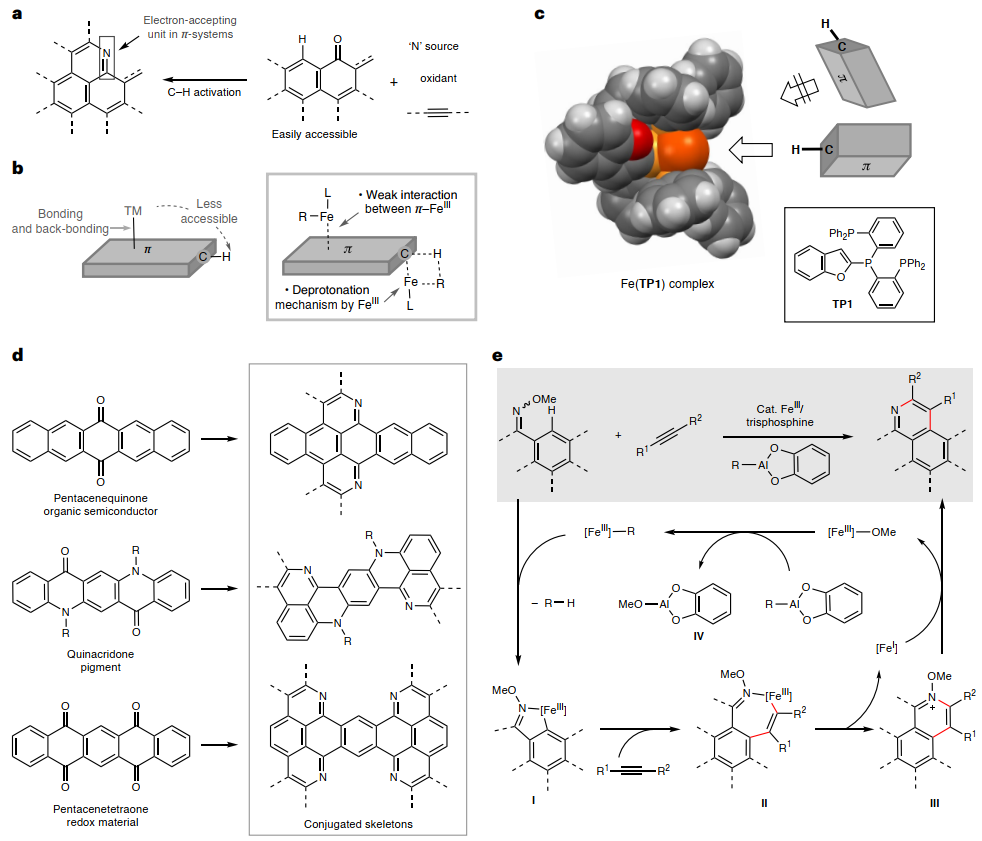
图1. 铁催化炔的AAPE反应。图片来源:Nat. Synth.
基于先前的研究,作者认为相对较大位阻的烷基可能会减慢Al-Fe转金属化,为此他们选择10-甲基-9(10H)-吖啶酮O-甲基肟(1)和二苯乙炔为模板底物、苯并呋喃三膦(TP1)为配体、Al(iBu)3/儿茶酚为碱对铁催化AAPE反应条件进行优化(图2a),结果显示向装有肟醚(1)、甲苯(1.5 equiv)、Fe(acac)3(10 mol%)、TP1和儿茶酚(2.0 equiv)的Schlenk管中加入二甲苯,然后在室温下缓慢加入Al(iBu)3的甲苯溶液并将反应混合物在室温搅拌5 min以原位生成iBuAl·儿茶酚酸盐(iBuAlC),接着在140℃加热24 h便可定量生成氮杂环化产物,同时未检测到C-H键烷基化副反应。另外,对照实验表明铁催化剂、儿茶酚和Al(iBu)3至关重要,缺一不可;同时TP2和triphos也能分别以88%和85%的产率生成产物2(图2b),而单齿膦配体(如:PPh3)和吡啶型配体(如:dtbpy、terpy)则无效。其次,作者考察了各种苯酚衍生物对反应的影响(图2c),结果显示1,8-萘二酚、苯酚(4.0 equiv)、2-羟基苯硫酚能以高产率形成所需产物,但是大位阻2,6-二苯基苯酚、2,6-二叔丁基对甲酚却效果较差,2-甲氧基苯酚、频哪醇、苯硫醇则完全抑制了反应。为了进一步证实儿茶酚的作用,作者尝试在甲苯/二甲苯溶液中混合Al(iBu)3和儿茶酚来制备iBuAlC,其固体形式易吸潮且在室温下迅速分解,而其甲苯溶液则能在惰性气氛下保存。在使用iBuAlC进行反应时获得了定量产率(图2d)。值得一提的是,当使用肟醚的1:1 E/Z混合物进行反应时以59%的产率获得环化产物(i+ii、i/ii=4/1),这说明肟醚的立体异构性并不决定C-H键活化的区域选择性,而观察到的中等产率可归因于强吸电子三氟甲基增强了C=N-OMe部分的亲电性,从而导致起始原料分解。
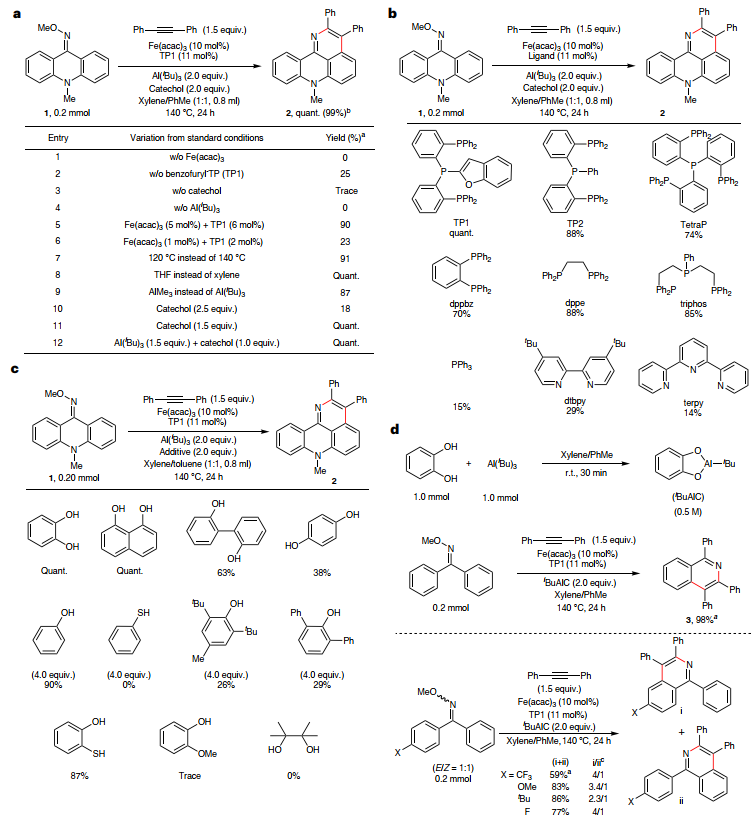
图2. 反应参数和机理研究。图片来源:Nat. Synth.
在最优条件下,作者考察了肟醚的底物范围(图3),结果显示吖啶酮(2、4)、氧杂蒽酮(5)、噻吨酮(6)、蒽酮(7)、螺环共轭碳环酮(8)、二苯并环庚烯酮(9)、萘嵌苯酮(11)、芳基烷基酮(12)、α-萘黄酮(18)和黄酮(17)衍生的肟醚均能兼容该反应,经硅胶过滤后以良好至定量产率获得唯一的氮杂环化产物,尽管五元环芴酮衍生的肟醚(10)未能进行该反应,这可能是由于铁环形成的 N=C–C键角差异所致。其次,一系列不同电性基团(如:甲氧基(13、21、22)、溴化物(14)、三氟甲基(15)、烷基(19、20))取代的二芳基乙炔、二烷基乙炔(23-26)甚至不对称炔烃(如:1-苯基-1-己炔(27)、苯基乙炔基三甲基硅烷(28))均能顺利地实现这一转化且不对称炔烃进行反应时具有高区域选择性,但是TIPS保护的苯乙炔(29)由于异丙基的较大空间位阻而无法参与反应。利用这种区域选择性,肟醚与1,4-双[(三甲基甲硅烷基)乙炔]苯进行双环化反应(图4),以61%的产率获得纯区域异构体——亚苯基连接的共轭结构(30)。类似地,作者还通过有效的双环化反应获得多种π-拓展结构(31和32、33、34和35),其中5,12-萘并萘醌衍生的肟醚在空间位阻较小的同一侧裂解C-H键而产生的双环化产物是主要产物(34),而35的低产率则是由于C-H键的空间位阻和Fe/三膦催化剂的空间敏感性所致,同时未观察到苯并[de]异喹啉[1,8-gh]喹啉骨架的形成(36)。
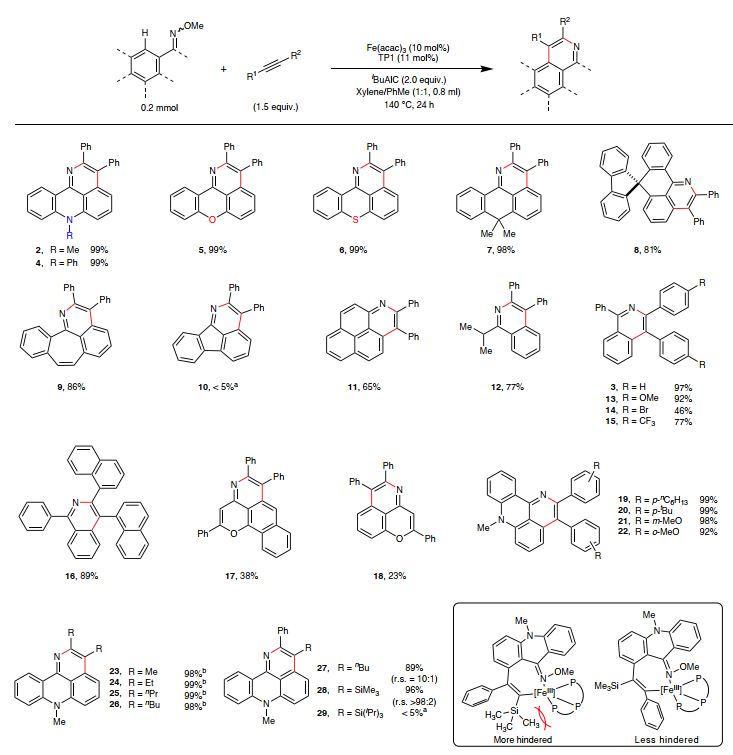
图3. 通过单重C-H键活化进行铁催化AAPE反应的底物范围。图片来源:Nat. Synth.
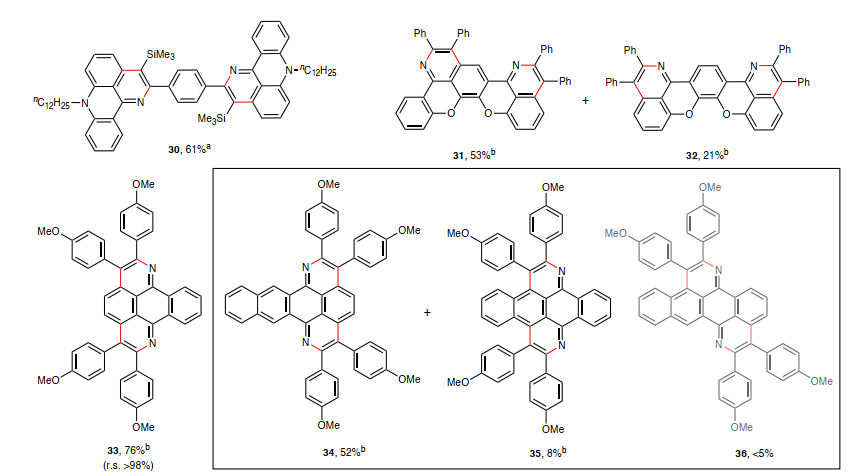
图4. 通过双重C-H键活化进行铁催化AAPE反应的底物范围。图片来源:Nat. Synth.
如图5a所示,色烯[3,2-a]氧杂蒽-13,14-二酮经铁催化双AAPE反应成功地构建了螺旋双色烯异喹啉(Heli-BCIQ,37),对37光电特性的初步检查显示其发射绿光,并通过单晶X-射线衍射分析证实了Heli-BCIQ的结构,结果显示(M)和(P)对映体的镜像图(图5b)。此外,Heli-BCIQ的堆砌结构显示出沿[1-10](图5c)和[100](图5d)方向的同手性堆叠以形成二维同手性组装,而附近的杂手性层形成特征性的拉链状π-堆叠,距离为3.27 Å。其次,6,13-五并苯醌衍生的肟醚经铁催化AAPE反应定量生成单一的产物——蒽并[1,2,3,4-lmn]苯并[f][2,9]菲咯啉(ABPhen,38,图6a),并且该过程能以克级规模进行制备,重结晶后以79%的产率获得产物38(1.23 g,图6b)。另外,计算显示38的前沿分子轨道明显分离。与传统的并五苯结构和衍生物不同,亚胺部分作为ABPhen中的电子受体单元,LUMOs所在的位置促进了电子密度的局域化。对38光电特性的初步研究表明其在437 nm处有窄带发射,半峰全宽(FWHM)为37 nm(图6c),这种窄带发射可归因于刚性共轭骨架的高度对称性导致基态(S0)和激发态(S1)之间的分子几何形状相似,从而抑制了振动耦合。类似地,喹吖啶酮经铁催化AAPE策略可以80%的产率获得前所未有的共轭骨架DNPA(39,图6d),在溶液和固态中均发光。如图6e所示,39在577 nm波长处表现出窄峰发射,FWHM非常窄(25 nm),并且在甲苯中的光致发光量子产率为87.3%。
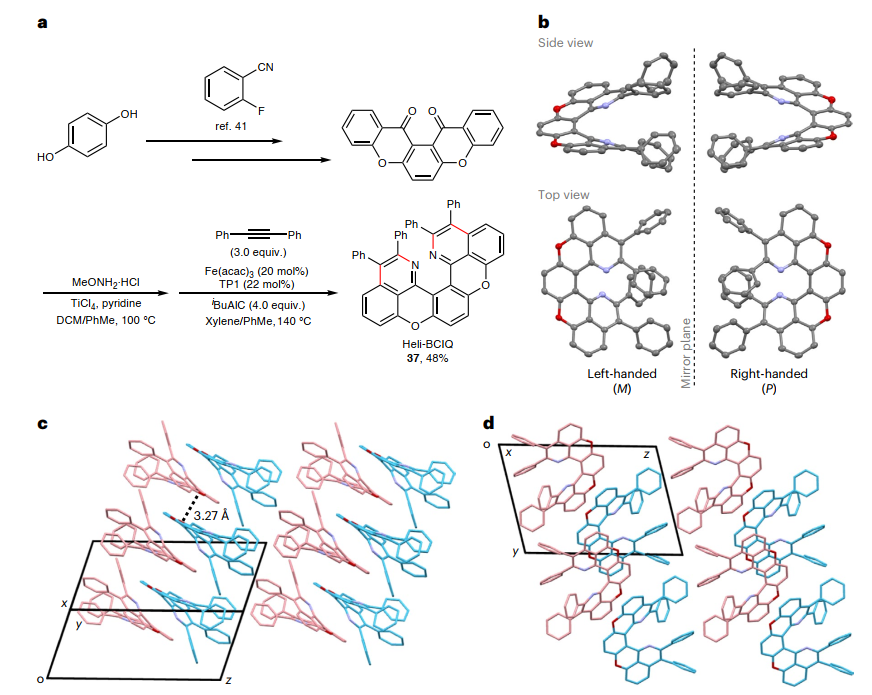
图5. 双重AAPE可得到Heli-BCIQ (37)。图片来源:Nat. Synth.

图6. 对五苯醌和喹吖啶酮进行高效和区域选择性双重AAPE。图片来源:Nat. Synth.
接下来,作者应用铁催化AAPE策略实现了5,7,12,14-并五苯四酮的四重C-H键活化(图7a),并且仅需简单分离(无需柱层析)便可以80%的产率得到高纯度四环化产物ABPA(40),该产物在水、酸和空气中仍保持高度稳定;而先前报道的铑催化反应却无法实现四环化过程。值得一提的是,在DNPA和ABPA的合成过程中未观察到中间苯环上空间位阻C-H键位点的环化副产物,这可归因于体积庞大的Fe/三膦催化剂对空间效应的高灵敏度。另外,化合物40的光致发光光谱在450 nm处显示出一个尖峰且FWHM极窄(13 nm,图7b),Stokes位移仅为3 nm(图7c)。最后,作者还通过铁催化5,7,12,14-并五苯四酮与1,2-二(9,9'-螺双[芴]-2-基)乙炔的反应成功地构建了八-9,9'-螺-芴共轭的ABPA(八-螺-ABPA,41,分离产率:84%),一步法安装了八个9,9'-螺双芴单元,进一步凸显出铁催化C-H键反应对π-拓展分子的合成能力;而使用钴催化方法时,化合物38、39、40和41都是无法获得的。
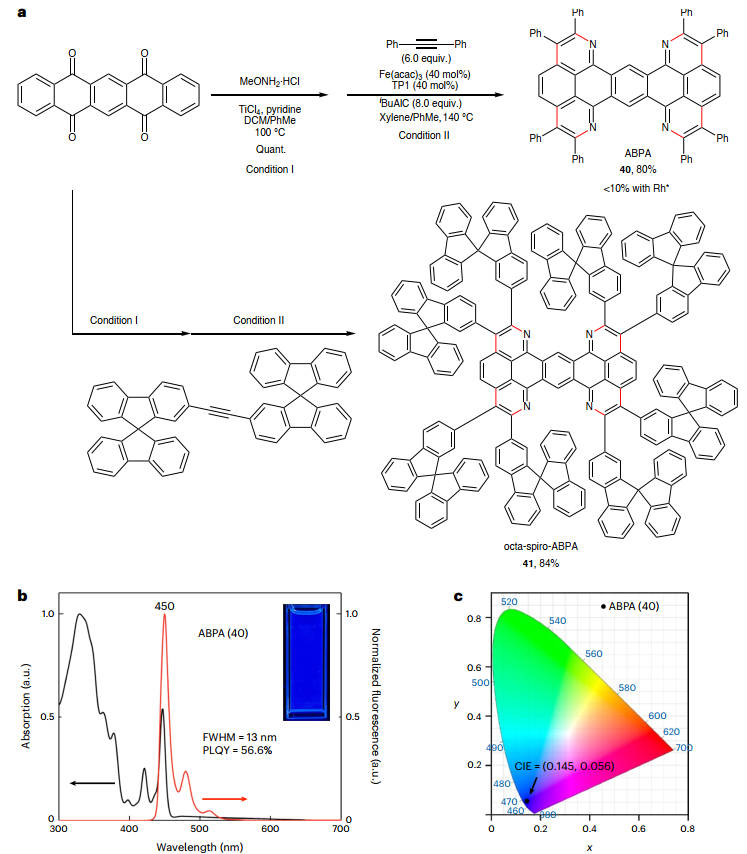
图7. 高效、区域选择性四重AAPE。图片来源:Nat. Synth.
总结
本文作者团队利用大位阻三膦配体来减弱Fe-π相互作用,通过肟导向的炔烃C-H键环化反应,成功地实现了铁催化共轭羰基化合物(如:喹吖啶酮、五并苯醌、并五苯四酮)与炔烃的AAPE反应,并以良好的产率获得一系列共轭氮杂芳烃,特别是并五苯四酮还能实现四重C-H键活化且每步平均产率高达95%,进一步凸显出铁催化AAPE反应在拓展π-体系上选择性活化C-H键方面的能力。此外,拓展π体系氮杂芳烃的快速合成促进了具有卓越电学和光学性质的先进材料发现,为材料科学和铁催化C-H键活化方法的未来发展开辟了新的道路。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Iron-catalysed C(sp²)–H activation for aza-annulation with alkynes on extended π-conjugated systems
Yan Zhang, Shota Fukuma, Rui Shang, Eiichi Nakamura
Nat. Synth., 2024, DOI:10.1038/s44160-024-00605-6
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!

















































 京公网安备 11010802027423号
京公网安备 11010802027423号