荧光标记的血管紧张素转换酶2衍生肽基传感器阵列用于SARS-CoV-2变异株区分
针对由严重急性呼吸综合征冠状病毒2(SARS-CoV-2)引起的2019冠状病毒病(COVID-19)大流行,SARS-CoV-2变异体表现出明显的遗传特征和可能改变的表型特征,检测和区分不同的病毒变异体(VOCs)对有效调整公共卫生措施和治疗策略至关重要。目前,SARS-CoV-2病毒的检测金标准是基于聚合酶链反应(PCR),通过对病毒核心RNA序列进行多次扩增从而实现对病毒的定量分析。还可通过酶联免疫吸附法(ELISA)或胶体金免疫层析通过抗体-抗原间的特异性识别实现病毒表面的特定蛋白的定性检测。然而PCR和抗原检测都侧重于目标病毒物种遗传特征,而无法提供有关表型突变的详细信息。鉴于SARS-CoV-2病毒快速突变对公众安全的严重威胁,对不同的VOCs进行快速有效的表型分析可能有助于我们对病毒进化过程的理解,为治疗和疫苗接种提供指导。
尽管新一代测序(NGS)等先进技术被广泛应用于全面分析病毒物种的基因组,使研究人员能够监测VOCs及其在不同人群中的流行情况。然而,直接测量病毒结构或表型特征的技术相对较少。因此,直接检测SARS-CoV-2全病毒颗粒的特征蛋白(S-,N-蛋白)是当前的研究热点。多种用于病毒直接检测传感技术被开发了出来,如电化学、比色、荧光、场晶体管等。虽然这些技术在样品处理方面更简单(无需裂解和无需核酸分离)、成本更低,但目前开发的分析方法仍然不能满足对完整病毒突变体进行区分的需求。
近日,华东理工大学的贺晓鹏(点击查看介绍)团队通过截取与SARS-CoV-2特异性结合的人血管紧张素转换酶2 (hACE2) 结合域上的关键肽链,构建荧光标记的多肽基传感器阵列,实现了SARS-CoV-2的变异株的区分。首先,通过解析新冠病毒S蛋白RBD结构域与人细胞受体ACE2的相互作用界面,从hACE2中截取关键的结合多肽,并利用AlphaFold2模拟证明截取的长链肽序列仍保持固有的α螺旋二级结构。随后,对多肽进行荧光标记,并与多种低维材料进行超分子复合,构建了病毒识别激活的多肽阵列。最后,通过酶标仪高通量正交筛选及主成分分析,验证了该阵列可在一株原始株存在下,有效区分包括Omicron在内WHO关切的5个新冠变异株(VOCs),分析结果与病毒的系统进化树一致,且与病毒感染力高度关联。此外,还通过对不同VOCs的重组表达的RBD蛋白进行测试,验证了阵列的可靠性。这项研究为开发从人类受体上合理截取肽配体构建有效的传感工具,用于检测传染性病毒及其突变体提供了可行的思路。
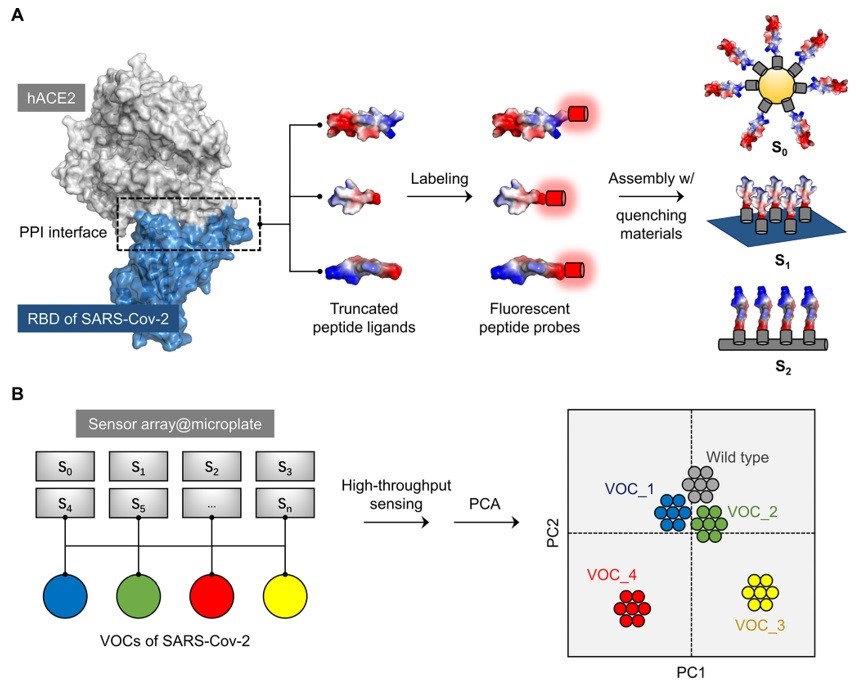
图1. 荧光染料标记肽的传感器阵列构建。(A)从hACE2与SARS-CoV-2 RBD的结合域截取的多肽示意图(该复合物的PDB代码为6M0J),以及基于荧光标记的hACE2多肽探针和多种淬灭材料组合的荧光传感器阵列的构建;(B) 传感器阵列对SARS-CoV-2 VOCs进行分类的示意图。
相比其他流行性病毒,SARS-CoV-2假病毒的加入引发肽阵列更强的荧光恢复,这意味着传感器中的多肽结构与SARS-CoV-2的RBD区域发生了选择性结合。通过对SARS-CoV-2 VOCs识别后的PCA进行更详细分析表明,Beta和Delta变体的指纹图谱与WT、Alpha、Gamma和Omicron的指纹图谱分离良好,该结果与SARS-CoV-2毒株的遗传信息相匹配。
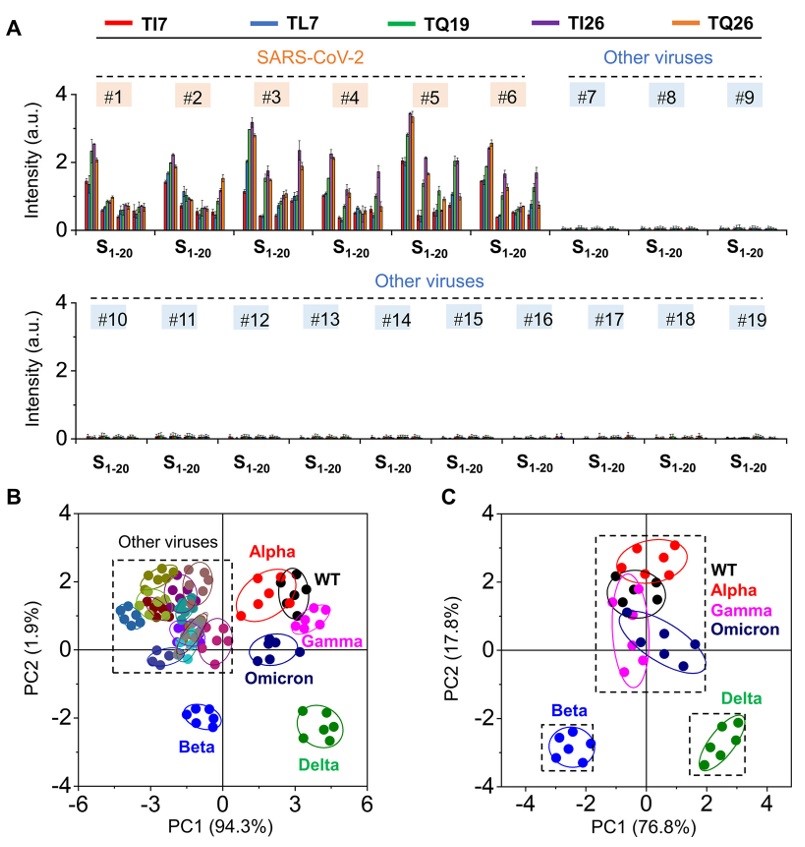
图2.(a)在SARS-CoV-2和其他病毒存在下S1-S20的荧光强度变化;(b)S1-S20传感器阵列对SARS-CoV-2和其他病毒的PCA分析;(c)S1-S20传感器阵列检测SARS-CoV-2 VOC的PCA分析;使用的病毒是#1:WT,#2: Alpha,#3: Beta,#4: Gamma,#5: Delta,#6: Omicron,#7: SARS-CoV,#8: H1N1,#9: H3N2,#10: H7N9,#11: H5N1,#12: H10N8,#13: MERS,#14: MARV,#15: AdC68,#16: Ad7,#17: EBOV,#18: VSV,#19: CVC-11。
这一成果近期发表在Journal of the American Chemical Society上。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Fluorogenic Peptide Sensor Array Derived from Angiotensin-Converting Enzyme 2 Classifies Severe Acute Respiratory Syndrome Coronavirus 2 Variants of Concern
Wei-Tao Dou#, Pei-Hong Tong#, Man Xing#, Jiao-Jiao Liu, Xi-Le Hu, Tony D James*, Dong-Ming Zhou*, Xiao-Peng He*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c06172
贺晓鹏教授简介

贺晓鹏,华东理工大学,化学与分子工程学院,费林加诺贝尔奖科学家联合研究中心,教授,博士生导师,化学生物学专业博士点负责人;海军军医大学国家肝癌科学中心青年科技英才(王红阳院士团队兼职引进),国家自然科学基金委优秀青年科学基金获得者,上海市青年科技启明星。主持国家自然科学基金“生物大分子动态修饰与化学干预”重大研究计划重点支持项目,并作为学术骨干获集成项目资助。2021年入选英国皇家化学会会士,2020–2023年连续4年入选爱思唯尔中国高被引学者,2023年入选美国斯坦福大学和爱思唯尔数据库联合发布的“World’s Top 2% Scientists”(Single year 2022);曾获Thieme Chemistry Journals Award(2020),中国化学会青年化学奖(2018),中国化学会化学生物学突出贡献奖(35周岁以下)(2018)。研究方向聚焦糖组学解码新技术与糖靶向疾病诊治新策略,迄今共发表SCI论文200余篇,其中以(共同)通讯/第一作者发表的代表性论文包括2篇Chem (Cell Press),10篇J. Am. Chem. Soc.,3篇Angew. Chem. Int. Ed.,1篇Nat. Commun.,2篇Sci. Bull.,3篇Adv. Mater.,3篇Adv. Funct. Mater.,11篇Chem. Sci.,1篇Chem. Rev.,10篇Chem. Soc. Rev.,所有论文获引用10500余次(h因子52),ESI高被引/热点论文20篇,申请国家发明专利10余项。
https://www.x-mol.com/university/faculty/10521
周东明教授简介

周东明,天津医科大学教授,博士生导师,中科院“百人计划”引进人才,863项目负责人。主要研究方向为新型病毒载体的设计、筛选与鉴定;基于病毒载体,研究新型抗感染性疾病疫苗和肿瘤治疗策略,并探讨相关机制。至今,已完成多种新型黑猩猩腺病毒载体的构建,研发了多种新型疫苗,包括新型流感疫苗、HPV疫苗、兽用狂犬病疫苗、抗肿瘤疫苗等。其中狂犬病疫苗、埃博拉疫苗等新型疫苗在国内相关疫苗研发公司的合作与支持下正向临床推进。至今,已经在Angew. Chem. Int. Edit., Mater. Horiz., Nat. Protoc., Mol. Ther., J. Virol.等期刊发表SCI论文40余篇,获得包括科技部863项目、自然科学基金委面上项目、中科院STS项目在内的研究课题10余项。与国内多家著名疫苗研发企业建立了合作关系,共同研发多种新型抗感染性疾病疫苗及肿瘤治疗性疫苗。
https://www.x-mol.com/university/faculty/83625
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号