北京大学郑家新/许贤祺团队/宁德时代21C实验室JACS:O3型NMFNO层状正极材料的空气敏感性起源及改善策略
“双碳”是我国在新发展阶段的重大战略目标。绿色储能作为新能源技术革命的核心环节,受到社会广泛关注。其中,锂离子电池由于其高能量密度和长寿命等特点已经被大量应用于便携式电子设备和电动汽车,是目前最具商业潜力的可充电电池。然而,锂矿资源具有稀缺性且分布极为不均,造成其市场波动较大,这不利于推动能源设备的改革。因此,人们开始考虑将钠离子电池作为锂离子电池在大规模储能领域的重要补充。它相对于锂电池的成本优势是:(1)钠元素的丰度大,分布广,成本低廉;(2)可选用廉价过渡金属作为正极材料的主要成分;(3)使用便宜且轻质的铝取代铜作为集流器。如果能够充分发挥其成本优势,钠离子电池有望加速全球储能基建项目落地。
钠离子层状氧化物(包括O3型和P2型)是目前最受瞩目的钠离子正极材料。从产业化的角度来看,由于锂离子层状氧化物的生产制造技术已经相对成熟,因此具有类似结构的钠离子层状氧化物可能更适配现有的产业链。然而,高空气敏感性问题限制了钠离子层状氧化物正极材料将成本优势发挥到极致。当与空气接触时,钠离子层状氧化物表面会迅速反应形成杂质,导致部分钠失去电化学活性。更糟糕的是,这些杂质在电池工作过程中可能会分解产气从而引发安全危机。为了克服这个难题,一些可行的实验技术例如:改变组分、掺杂和表面修饰已经被广泛研究和报道,但似乎并没有在大规模生产中得到推广。这暗示从微观尺度上观察杂质形成过程和正确理解杂质形成机理是非常迫切和必要的。目前,产业界正在积极探索层状钠电正极材料空气敏感性问题的解决方案。
近日,北京大学郑家新/许贤祺课题组联合宁德时代21C实验室欧阳楚英教授在国际顶级期刊Journal of the American Chemical Society 上发表文章,该工作利用密度泛函理论计算和ab-initio 分子动力学模拟(AIMD)系统地研究了空气分子与NaMn1/3Fe1/3Ni1/3O2(NMFNO)层状正极材料表面的化学反应过程,并解释了为什么钠离子层状氧化物的空气稳定性普遍比锂离子层状氧化物差。该工作揭示NMFNO空气稳定性差的原因是:(1)非活性(003)表面的占比低;(2)强表面吸附性和高表面反应活性;(3)表面钠离子的不稳定性。其中,高表面反应性源自于表面氧活性位点的电子损失和未配对电子增加,以及强金属共活化作用。虽然表面氧活性位点和金属活化作用对杂质的形成都是必不可少的,但作者发现水解反应和碳酸盐的形成对反应环境的要求并不完全相同。水解反应需要表面氧活性位点具有较高的活性,而碳酸盐形成更依赖于金属活化作用。基于计算结果和新的杂质形成物理图像,作者讨论了表面形貌调制、阳离子/阴离子取代和表面构型设计等改善策略的可行性。
1. 表面形貌预测
作者计算了六种NMFNO表面模型的表面能包括:(104)、(100)、(110)、(003)、(012)和(101)表面,并与一系列锂层状氧化物LiTMO2的表面能进行对比。如图1(b)所示,除(003)表面外,NMFNO的表面能皆位于LiTMO2的偏差范围附近,其相对趋势与LiTMO2的平均表面能基本一致,这似乎暗示晶体的表面能更依赖于晶体结构而不是金属组分。作者先前的研究表明,LiTMO2表面能的偏差足以引起巨大的形貌变化。显然,NMFNO的(003)表面能几乎是LiTMO2的两倍,是NMFNO和LiTMO2形貌差异的最大影响因素。高表面能意味着低表面占比,考虑到(003)表面通常为非化学活性面,因此NMFNO将可能暴露更多活性表面从而削弱其空气稳定性。进一步研究发现,该表面能差异的主要来源于表面重构能(LiTMO2的平均表面重构能为-5.16 eV,NMFNO的表面重构能为-1.57 eV),而表面重构能与键长重构程度紧密相关。以镍酸锂(LNO)为例,(003)表面上的Li-O键键长相对于体相的缩短了约13.4%,而NMFNO-(003)表面上的Na-O键仅缩短3.7%。根据键价理论和Morse势函数形式,键长变化与能量之间具有指数关系,也就是说表面键长重构程度是导致(003)表面能巨大差异的主要原因。
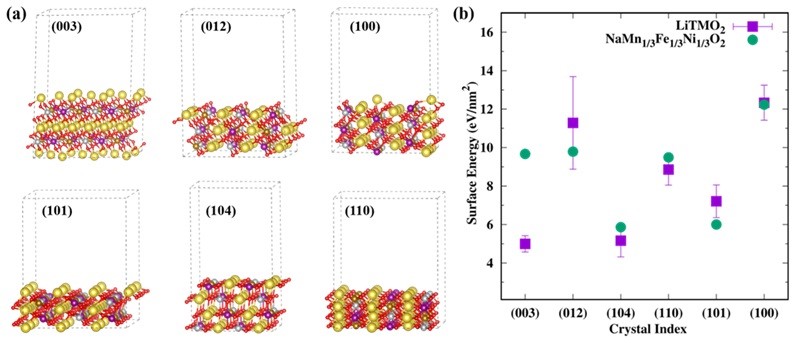
图1. (a) 六种NMFNO表面模型示意图。(b) NMFNO与LiTMO2的表面能对比图。
2. 表面吸附能力
作者对比了NMFNO和镍酸锂(LNO)表面的吸附位点及吸附能力。图2给出了NMFNO和LNO表面上过渡金属离子的价态和晶格氧的磁矩。可以观察到LNO表面Ni离子为单一价态,例如,在(110)表面上只有Ni2+,在(012)、(101)和(104)表面上只有Ni3+。而NMFNO表面的过渡金属价态比体相更丰富,例如,Fe3+、Fe4+、Mn3+和Mn4+同时存在于(101)表面。这种复杂的过渡金属价态导致表面氧活性位点的多样化。表面氧活性位点的形成主要考虑两个方面:(1)表面氧的电子损失程度。例如,在(101)表面上,连接到Ni2+和Mn3+的表面氧(Ni2+-O-Mn3+)会比Ni2+-O-Mn4+遭受更重的电子损失,这意味着前者在费米能级附近有更多的空轨道,即前者的活性更高;(2)表面氧的磁矩(未配对电子数)。例如,Ni2+-O-Fe3+通常表现出相对较高的磁矩,这意味着这些氧位点更活跃,而与Mn4+离子连接的表面氧(Mn4+-O-TM)通常具有较低的磁矩。这是因为具有半满eg轨道的Ni2+和Fe3+阻碍TM-O键键合,而具有空轨道的Mn4+则不会。表面氧的电子损失和高磁矩分别对应于费米能级附近的空轨道和高能占据轨道,这些轨道已被证明优先参与化学反应。
作者进一步对比NMFNO和LNO各表面对空气分子的吸附能。如图3所示,除了水在(110)表面的吸附能外,NMFNO表面对空气分子的吸附能力强于LNO表面。这意味着NMFNO表面的初始化学吸附过程将会更快,更多的空气分子将被带入电池系统。然而,在作者研究的所有NMFNO表面中,(104)表面的吸附能力和化学反应性相对较弱,因此它可能更适合作为主要暴露表面以减轻空气敏感性问题。
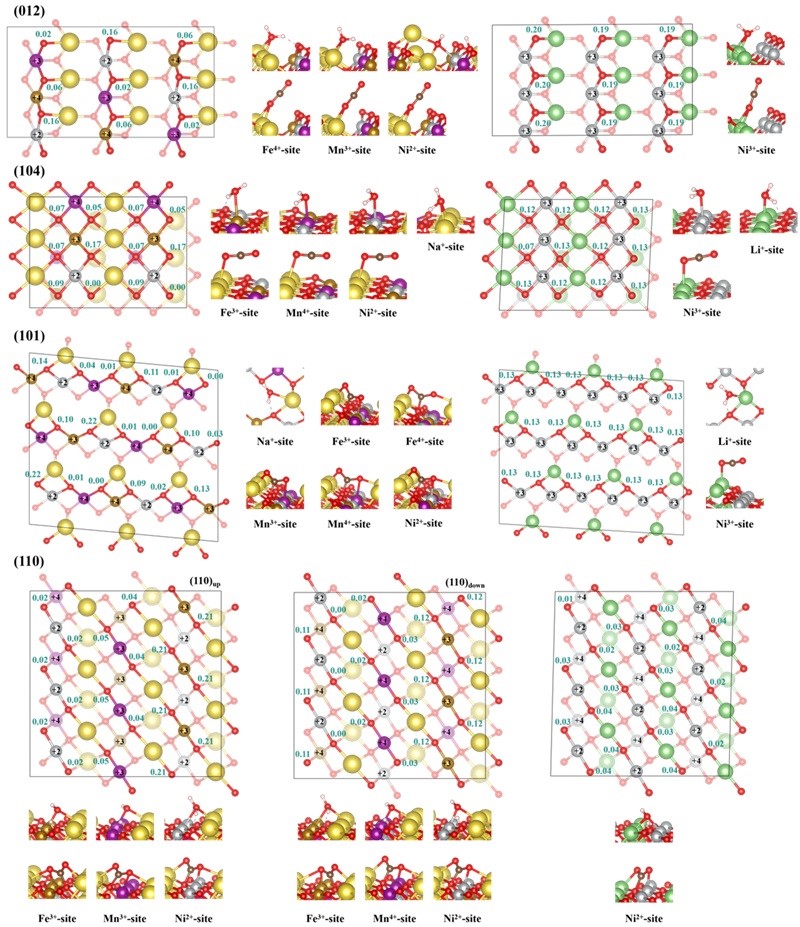
图2. NMFNO和LNO的(012)、(104)、(101)和(110)表面上的过渡金属价态(黑色数值)和晶格氧磁矩(青色数值),以及相应的表面吸附结构。半透明离子表明这些离子位于表面的第二层。
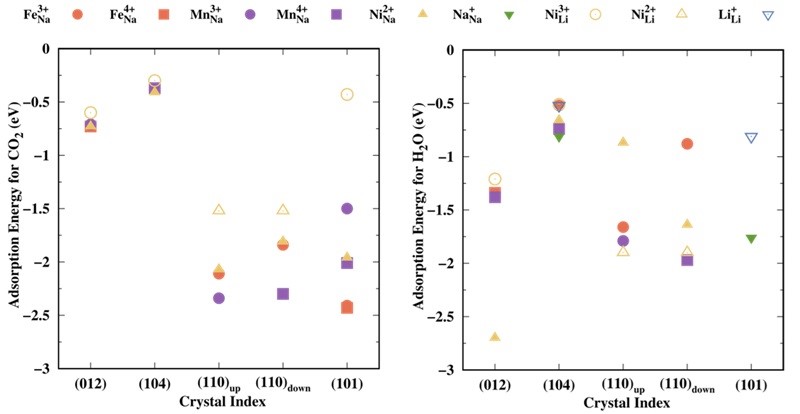
图3. 水和二氧化碳在NMFNO(实心)和LNO(空心)的(012)、(104)、(101)和(110)表面上的电子吸附能。例如,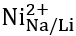 代表空气分子被吸附在NMFNO/LNO表面的Ni2+位点。
代表空气分子被吸附在NMFNO/LNO表面的Ni2+位点。
3. 表面反应活性和杂质形成机理
如图2所示,NMFNO的(012)、(110)和(101)表面可以直接与空气分子反应形成杂质,而仅仅LNO的(110)表面可以形成杂质。也就是说,NMFNO表面比LNO表面具有更多的化学反应位点。造成这种差异的原因可能有两方面:(1)电子损失和未配对电子的增加使得表面氧活性位点更具活性;(2)由于钠离子的接触面积较大,空气分子倾向于与多个钠离子结合从而形成共活化效应。先前的工作表明,表面氧活性位点和金属活化作用是表面化学反应的关键,但作者注意到水和二氧化碳对反应环境的要求并不完全相同。例如,NMFNO-(012)表面的Ni2+位点可以直接水解,但不能形成碳酸盐;NMFNO-(110)up表面可以直接形成碳酸盐,但不能水解。基于这些差异,作者更新了杂质形成机理的物理图像(见图4)。作者认为,库仑相互作用使水内的氧原子会倾向于吸附在金属离子位点上,而水内的氢原子通常与表面氧活性位点形成氢键。当水接近表面时,分子内的O-H键会被金属活化而减弱键合。此时,如果表面氧活性位点具有反应活性,H+就会沿着氢键的方向转移到表面氧活性位点上。Bader电荷分析显示水解过程可能不存在电荷转移。受水解的物理图像启发,作者认为可以通过削弱表面氧活性位点的反应活性来抑制水解反应。然而,这种处理策略并不适用于碳酸盐的形成过程。比较NMFNO-(110)up和NMFNO-(110)down表面上Ni2+位点(也见Fe3+位点)的吸附构型发现,仅削弱表面氧活性位点的反应活性并不能抑制碳酸盐的形成。这意味着碳的杂化模式转变(sp到sp2)在金属活化作用下就已经发生,甚至可能不需要表面氧活性位点参与。为了证明这一点,作者对NMFNO-(003)/CO2界面模型进行了结构弛豫计算。如图5(b)所示,O-C-O角在金属活化作用下从180°变为133.7°。图5(c)显示NMFNO的(110)和(003)表面上CO2反应过程的DOS图。可以清楚地看到,当CO2接触到表面后,π键对应的峰逐渐向高能区域移动且峰的强度减弱,这可以反映出CO2被金属离子激活。因此,对于碳酸盐的形成,采用阴离子取代或减弱金属活化作用可能是更有效的改善策略。
为了进一步观察杂质形成的动力学过程,作者运用AIMD模拟技术模拟了NMFNO的(012)、(101)、(110)表面在纯水和纯二氧化碳气氛中的化学反应过程。如图5所示,钠离子具有较大的离子半径,能够吸引更多的空气分子,并且在水和二氧化碳的拖拽下很容易迁移到其他位置。迁移的钠离子具有较强的金属活化能力,且表面氧活性位点由于缺乏Na-O键而更具化学活性,这意味着NMFNO表面的化学反应性将进一步增强。根据先前的工作,LNO的AIMD模拟中没有看到锂离子的剧烈迁移,这就可以解释为什么钠离子层状氧化物的空气稳定性普遍比锂层状氧化物差。
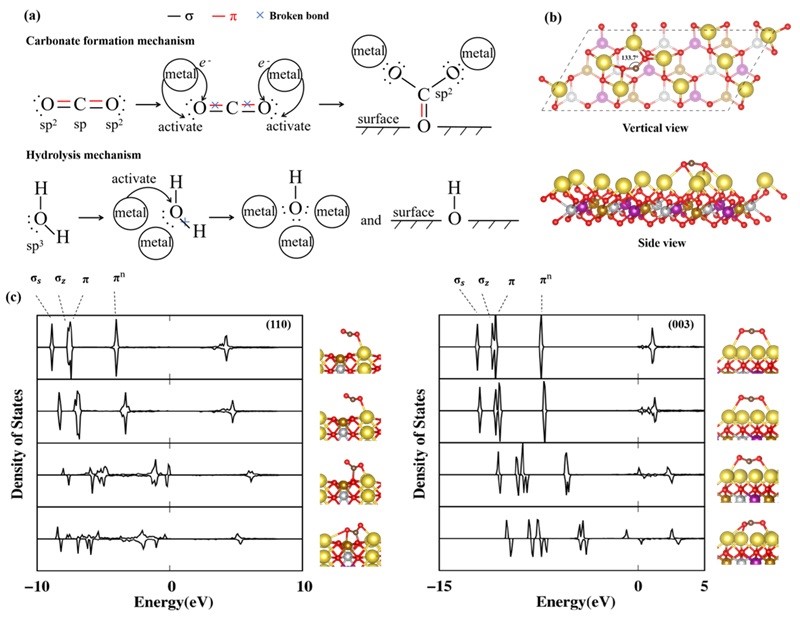
图4. (a) 碳酸盐形成和水解反应的机理图。(b) CO2在(003)表面上的吸附构型图。(c) CO2在(003)和(110)表面上不同反应阶段的DOS图。
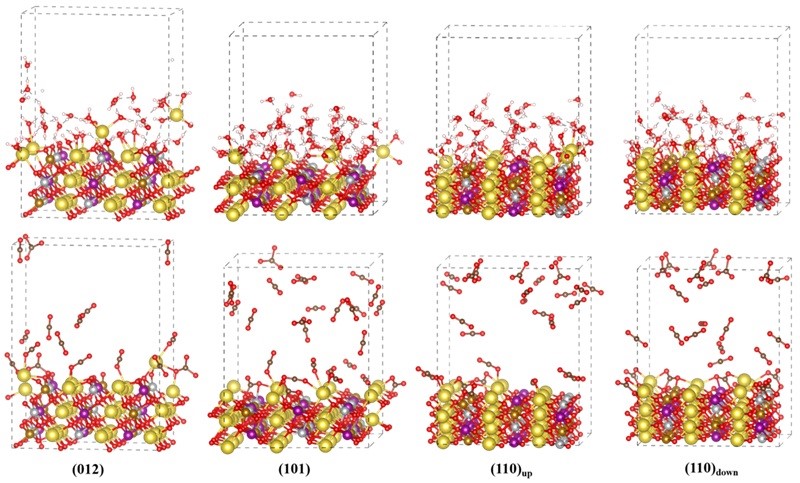
图5. NMFNO的(012)、(101)和(110)表面在纯水和二氧化碳中的AIMD快照。
4. 碱金属的热和动力学稳定性
杂质的形成过程与碱金属离子的扩散动力学过程直接相关,因此作者执行缺陷形成能和扩散活化能垒计算来分别反映表面碱金属离子的热稳定性和动力学稳定性。图6(a)显示(012)、(101)和(110)表面上钠离子的缺陷形成能都远低于锂离子的,说明钠离子比锂离子更容易脱离表面。这是因为Na-O键键强比Li-O键的弱得多,因此钠离子更容易断开化学键并留下空位。图6(c) 给出了碱金属离子从第二层扩散到最外层表面的活化能垒。其中,钠离子在(012)表面上的迁移能垒远高于锂离子的,在(101)表面上的迁移能垒低于锂离子的,在(110)表面上的迁移能垒约等于锂离子的。这一结果令人惊讶,因为通常认为钠离子的离子半径大不利于在层状阴极材料的体相中扩散。结合表面碱金属的热和动力学稳定性,作者认为,与锂离子相比,表面钠离子的扩散速度更快,也是导致NMFNO比LNO的空气稳定性差的主要原因之一。
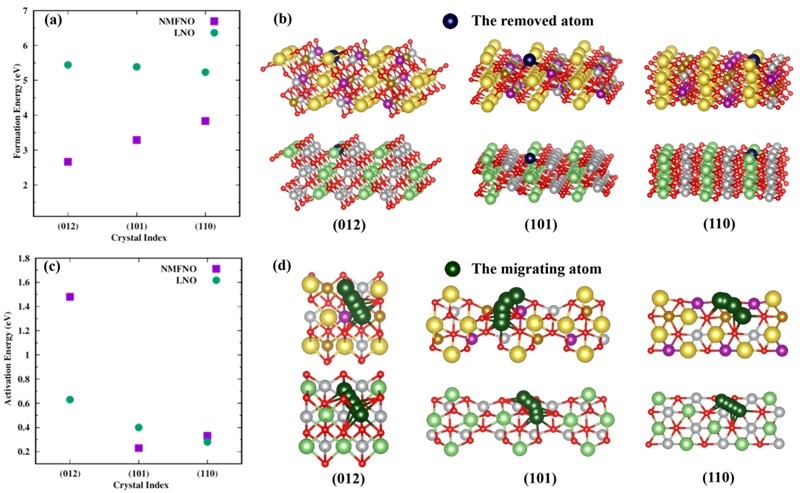
图6. (a) 钠和锂离子在(012)、(101)和(110)表面上的缺陷形成能。(b) 缺陷形成能计算的表面模型图。(c) 钠和锂离子在(012)、(101)和(110)表面上的扩散活化能。(d) 碱离子迁移路径图。
4. 空气敏感性改善策略
图2和3证明各个晶体学表面对空气分子的吸附能力和化学反应活性是不同的。例如,(104)表面的吸附能力和反应活性较低,而(110)和(101)表面的吸附能力和反应活性较高。这启发作者采用表面形貌调控技术来处理NMFNO的空气敏感性。根据计算结果和(003)表面不受空气侵蚀的实验事实,作者建议通过增大晶粒尺寸来减小比表面积以及更多地暴露(003)、(104)和(012)表面来缓解空气敏感性。虽然(012)表面是反应性的,但该表面的钠离子扩散活化能垒很高,这意味着(012)表面的杂质形成速率会较慢。
降低表面反应性也是抑制空气敏感性的一种可行方案。先前的理论研究已经证明,表面氧活性部位和金属活化是影响表面反应性的关键因素。在本节中,以(110)表面为例,尝试通过调节表面氧活性位点的活性和金属活化作用来调控表面反应性。在图7(a)中,低磁矩的Ni2+-O-Mn4+的反应活性较低,不能参与水解反应,而高磁矩的Ni2+-O-Fe4+具有较高的反应活性。最糟糕的是,Ni2+-O-Fe3+不仅因电子缺失而表现出电子不饱和,而且由于成键电子和eg轨道电子之间的排斥力而具有高磁矩,因此该活性位点的化学反应最为加剧。为了削弱表面氧活性,作者提出掺杂具有空eg轨道的高价过渡金属以降低表面氧离子的电子损失和磁矩。具有空eg轨道的Ti4+和Co4+代替Fe4+进一步证明,降低表面氧活性位点的活性可以抑制水解,但作者发现这种策略无法有效阻止碳酸盐形成。为了同时抑制水解和碳酸盐形成,作者建议在NMFNO表面上采用弗(F)离子掺杂并从计算上证明其有效性。然而,键强计算结果表明,Na-F键(0.37 eV)弱于Na-O键(0.60 eV),这可能会减弱表面钠离子的热稳定性从而影响实际效果。因此,F离子掺杂策略仍有待实验验证。减弱金属活化作用是减弱表面反应活性的另一种方法。实验表明,采用Mg2+和Cu2+取代过渡金属组分有助于提高空气稳定性。然而,计算结果表明,这两种元素不能阻止水解反应和碳酸盐形成,说明这两种元素对削弱金属活化没有贡献。我们推测这两种元素的取代可能是通过改变表面形貌来降低空气敏感性。考虑到钠离子具有一定的金属活化作用及其在表面上的不稳定性,作者尝试去除表面最外层的钠离子来削弱表面反应活性。为了观察该策略的改善效果,作者在纯水和二氧化碳气氛中构建了一个理想的缺钠表面构型并执行AIMD模拟。图7(b)显示,该策略可以有效抑制碳酸盐形成和水解反应。这一策略也解释了为什么在实验条件下引入钠空位可以降低空气敏感性。最后,作者强调上述策略可以在实验中组合使用,例如,形貌调控与阴离子/阳离子共掺杂组合或者形貌调控与缺钠的表面构型组合。这些改善策略的叠加可能会增加制备过程的复杂性,因此迫切需要开发完善的实验方案。
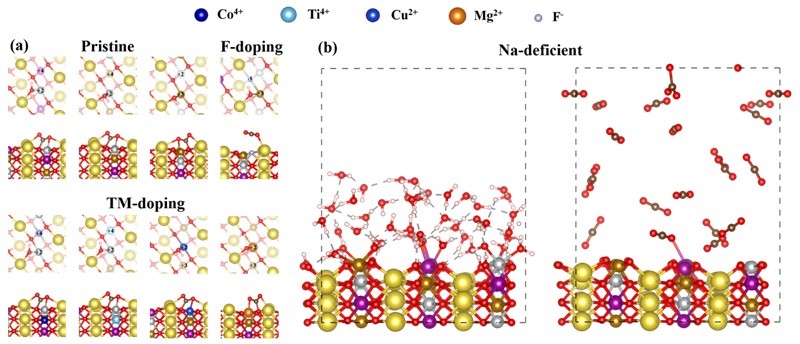
图7. (a) 原始、f掺杂和过渡金属(TM)掺杂(110)表面的吸附构型。(b) 纯水和二氧化碳中缺钠(110)表面的AIMD模拟快照。
结论
以LNO为参考,钠离子层状阴极材料NMFNO的空气稳定性差可能有三个原因:(1) 非反应活性(003)表面占比低;(2) 强表面吸附力和高表面反应性;(3) 表面钠离子的不稳定性。NMFNO表面的高反应活性起源于表面氧活性位点的电子损失和未配对电子(磁矩)增加,以及钠离子半径大导致的金属共活化作用增强。计算结果还表明,表面钠离子的热稳定性较差,导致其易被空气分子吸引从而脱离表面。令人意外的是,钠离子在表面区域的扩散并不像在体相中那么困难,甚至可以与锂离子的扩散能垒相当,这为杂质持续不断形成提供了条件。
杂质形成的完整物理图像是,由于NMFNO表面的强吸附能力,空气分子(水和二氧化碳)迅速在表面聚集并在表面氧活性位点和金属活化作用的协同影响下反应形成杂质。在化学反应过程中,表面钠离子并不稳定,极易受到空气分子的吸引从而脱离表面晶格位点,这个过程进一步增加了表面氧活性位点的反应活性和金属活化作用,形成恶性循环。当表面钠离子被消耗后,体相中的钠离子通过热扩散到达表面,使杂质形成过程得以持续。当钠离子含量降低到一定水平时,晶格氧逐渐不稳定并开始形成O-O二聚体,随后过渡金属迁移、结构坍塌和相变开始发生。
虽然表面氧活性位点和金属活化对杂质的形成都是必不可少的,但作者发现水解反应和碳酸盐的形成对反应环境的要求并不完全相同。水解反应需要表面氧活性位点具有较高反应活性,这启发作者采用具有空eg轨道的高价过渡金属(如Ti4+和Co4+)或者阴离子取代以降低其反应活性。在碳酸盐形成过程中,碳杂化模式的转变主要依赖于金属活化作用,甚至不需要表面氧活性位点的参与,这启发作者构建缺钠的表面构型以削弱金属活化作用。此外,晶粒形貌调控以减少暴露反应活性表面也是抑制空气敏感性的一种可行策略。作者强调,这些策略可以组合使用以提高改善效果。
本文发表于J. Am. Chem. Soc.,第一作者为许贤祺、陈隽彦和蒋耀。通讯作者为李新禄、欧阳楚英、郑家新。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Origins of high air sensitivity and treatment strategies in O3-type NaMn1/3Fe1/3Ni1/3O2
Xian-Qi Xu, Jun-Yan Chen, Yao Jiang, Bo Xu, Xin-Lu Li*, Chu-Ying Ouyang*, Jia-Xin Zheng*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c05255
导师介绍
郑家新
https://www.x-mol.com/university/faculty/22382
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号