JACS:催化二氧化碳与非活化烯烃的高对映选择性远程氢羧化反应
二氧化碳(CO2)由于其丰富、廉价且可再生的优势,是理想的C1合成子,一直受到研究者们的青睐,它的高效利用对于推动可持续发展具有重要意义。过去的几十年间,研究者们已经发展出一系列方法成功将CO2转化为一系列高附加值的羧酸类化合物,实现了CO2的高效资源化利用。但是由于CO2热力学稳定性和动力学惰性,通常在需要较苛刻的条件进行反应,因而其参与的不对称催化碳-碳键反应构建手性羧酸的报道很少,其中CO2与烯烃的不对称反应构建手性羧酸的例子仅限于活化的苯乙烯底物。如何实现高区域选择性、对映选择性催化CO2与非活化烯烃的反应仍旧是一个重要挑战。
近日,中国科学院上海有机化学研究所与南方科技大学化学系唐勇教授和周友运副教授团队在二氧化碳的不对称催化转化领域取得最新进展,研究成果发表在J. Am. Chem. Soc.上。在该研究中,作者团队基于边臂噁唑啉SaBOX/Ni催化体系,成功同时实现了反应过程中的链行走以及不对称羧基化反应,以优秀的产率、非对映选择性和对映选择性合成了一类重要的带有各种长链烷基取代的或者苯并环状的手性α-羧酸化合物。值得一提的是,该方法还成功应用于高效构建抗血小板聚集药物 (R)-indobufen,体现出该方法具有很好的实际应用潜力。
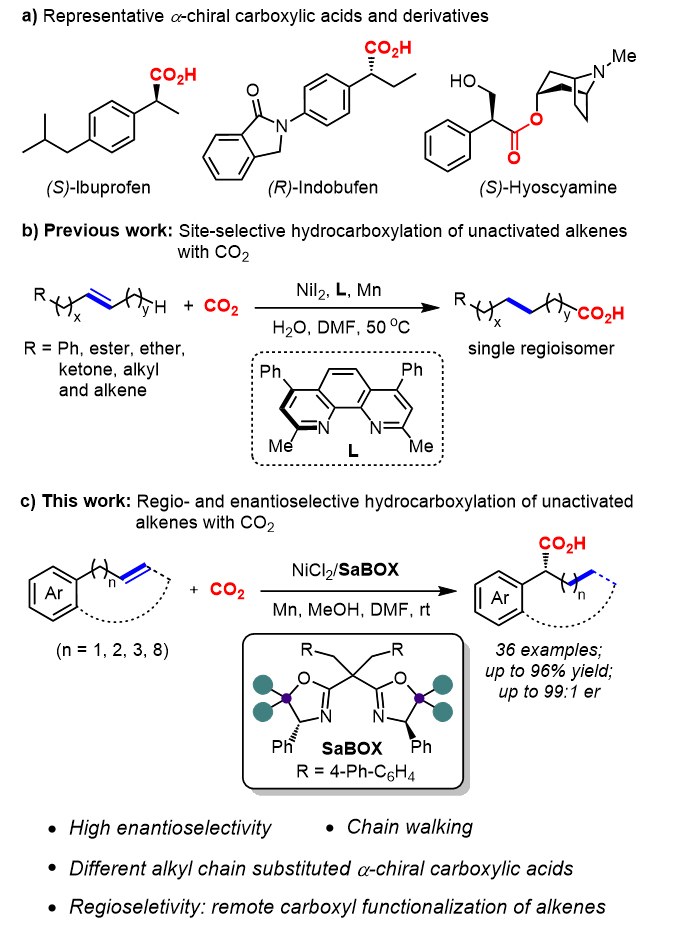
图1. 二氧化碳与非活化烯烃的高对映选择性远程氢羧化反应。图片来源:J. Am. Chem. Soc.
唐勇教授课题组长期致力于“边臂策略”设计合成一系列新型的噁唑啉类催化剂,并成功运用于不对称催化(Acc. Chem. Res. 2014, 47, 2260-2272; Chin. J. Chem. 2018, 36, 1123-1129)。南科大化学系周友运课题组主要研究方向是新型配体和过渡金属催化剂的设计、合成及其应用,基于新型手性配体、双(多)核催化策略和惰性小分子活化发展新反应和不对称催化,旨在解决有机合成和高分子材料合成中的科学难题,实现从廉价易得原料到高附加值功能化分子和聚合物的绿色、高效和高选择性创制。近期,唐勇教授与周友运副教授团队已经成功报道了第一例CO2参与的高对映选择性的苯乙烯硼羧化反应(J. Am. Chem. Soc. 2024, 146, 2888-2894)。在此工作之上,考虑到非活化烯烃的低反应活性和区域选择性较难控制,而且目前仅有一例关于非活化烯烃与CO2的反应构建非手性端位羧酸报道(图1b),作者设想利用边臂噁唑啉SaBOX/Ni (II)催化非活化烯烃与CO2反应,并成功获得了以不同的区域选择性和优秀的对映选择性获得CO2插入在苄位的手性羧酸。其中,边臂噁唑啉SaBOX/Ni不仅催化了链行走过程,控制了反应的区域选择性;而且同时控制了反应的手性决定步骤,最终以高对映选择性获得了手性的苄位羧酸化合物(图1c)。
首先,作者以4-苯基-1-丁烯为模型底物,利用氯化镍和手性配体,锰作为还原剂,甲醇作为氢源,在常压CO2条件下进行了不对称氢羧化反应。通过一系列手性配体的筛选,发现手性双噁唑啉配体L3能有效催化反应,生成单一区域选择性的手性α-苯基戊酸,产率为12%,对映选择性为72:28。进一步优化配体结构,最终使用Ph-SaBOX配体L9实现了83%的产率和95:5的对映选择性。在最优条件下,研究团队对非活化α-烯烃的底物范围进行了探索。结果显示,不同烷基链长度的末端烯烃(2a-2d)均表现良好,产率为46-94%,对映选择性为94:6至95:5,说明烷基链长度对对映选择性的影响较小。同时,1,1-二取代烯烃,4-苯基-2-甲基-1-丁烯(1e)也生成了相应的手性羧酸,对映选择性为95:5。随后也研究了不同苯环取代基对反应的影响(2f-2n),发现给电子和吸电子基团取代的底物,在标准条件下均能以很好的结果生成手性α-芳基戊酸,产率为58-95%,对映选择性为94:6到96:4。而带有氟取代的底物(2m)、带有对位-1,3-杂芳环和杂环取代基(2q-u)也表现良好。并且敏感官能团如酯和羟基的底物(2v-w)也能很好地进行该类反应。非甾体抗炎药类似物(2x-y)的反应顺利,产率为72-82%,对映选择性极佳。复杂天然产物衍生物(2z)产率为75%,对映选择性为95:5。同时,内烯烃的研究(1aa,Z/E混合物)表明,1,2-二取代烯烃不会阻碍Ni-H物种的链行走过程,可以中等收率生成α-苯基羧酸2aa,对映选择性为96:4。其他内烯烃环化合物也表现良好,生成的α-手性苯并羧酸的对映选择性为94:6到99:1 。

图2. 底物拓展。图片来源:J. Am. Chem. Soc.
为了验证方法的实用性,反应规模扩大到1 mmol,催化剂用量减少到4 mol%,同样以优秀的对映选择性和产率合成2a。该方法还成功运用于两步合成抗血小板聚集药物(R)-Indobufen,目标产物2al的绝对构型通过X射线衍射分析确定。
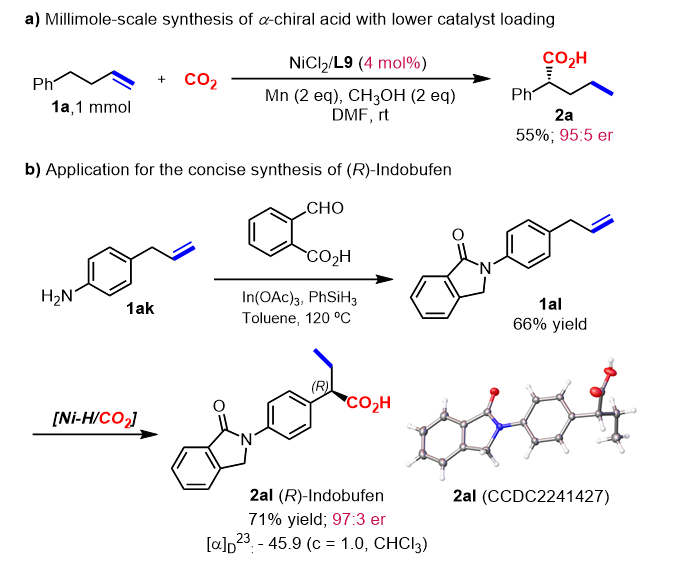
图3. 放大量合成及药物分子应用。图片来源:J. Am. Chem. Soc.
作者进行了一系列机理实验对研究反应历程进行了研究(图4)。实验表明,由于空间位阻,末端烯烃与内烯烃的反应速率差异很大(66% vs 17%,图4a),末端烯烃显示出更高的反应性。当使用CH3OD与1a反应,最终观察到氘代羧酸产物(图4b,反应1),而使用CD3OH时未观察到产物被氘代,此实验可以表明氢源来自甲醇的O-H基团(图4b,反应2)。同样使用氘代DMF进行反应,产物2a并未观察被氘代(图4b,反应3)。而在标准条件下加入等量的H2O与CD3OD时,2a末端CH3的氘代率降低到0.22,表明反应体系中残存的少量H2O也可以提供氢源(图4b,反应4)。同时,将2a在CD3OD的标准条件下再反应,未观察到产物被氘代,表明没有羧酸导向的C-H键活化过程(图4b,反应5)。最后的交叉反应实验生成了H/D混杂的交叉产物,支持Ni-H可以从烯烃Ni-H中间体中解离(图4c)。
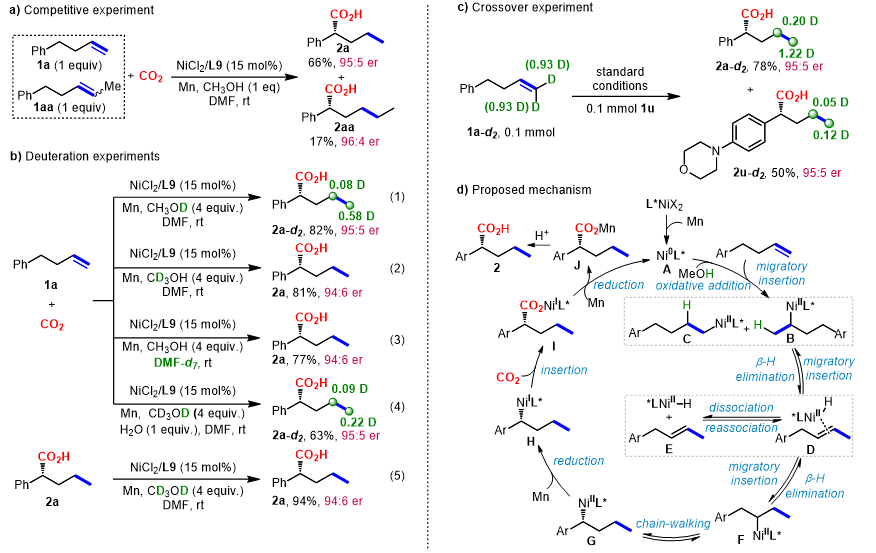
图4. 机理研究。图片来源:J. Am. Chem. Soc.
基于以上机理实验,作者提出了该反应的可能机理(图4d)。通过Mn还原二价Ni,原位生成的活性零价Ni催化剂A与甲醇的O-H发生氧化加成形Ni(II)-H物种,随后通过2,1-和1,2-迁移插入到烯烃中形成烷基Ni(II)-B和C中间体。这些中间体通过β-氢消除/迁移插入过程(链行走)快速可逆迭代,最终以高区域和对映选择性生成了热力学上更有利的苄基中间体G。随后,通过Mn还原中间体G,生成了α-手性苄基Ni(I)中间体H,继续进行CO2插入反应,生成了手性α-羧酸盐I。最终,I通过Mn进一步还原再生零价Ni物种A,同时生成羧酸锰盐J,在后续的淬灭反应过程中转化为羧酸2。
综上所述,这是首次在温和条件下开发了通过链行走反应,在常压CO2下实现非活化烯烃高区域和对映选择性的远程氢羧化反应。边臂噁唑啉配体SaBOX在调节区域和对映选择性方面起到了关键作用。最终可以从廉价易得的非活化烯烃和CO2合成各种手性α-羧酸,产率高达96%,对映选择性高达99:1。并且通过两步简洁合成光学活性的抗血小板聚集药物 (R)-Indobufen的实例,展示了该方法的合成实用性。
相关工作最近发表于J. Am. Chem. Soc.。上述研究工作得到了南方科技大学启动资金,广东省催化重点实验室的大力支持。本工作的通讯作者是唐勇教授和周友运副教授,周立博士和南方科技大学2021届博士李丽萍为共同第一作者。
上海有机化学研究所唐勇教授和南科大化学系周友运副教授团队由于课题研究需要,诚聘有机合成和烯烃配位聚合方向的研究助理教授、博士后等研究人员(点击阅读详细)
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Catalytic Regio- and Enantioselective Remote Hydrocarboxylation of Unactivated Alkenes with CO2
Li Zhou, Liping Li, Sudong Zhang, Xiao-kang Kuang, You-Yun Zhou*, and Yong Tang*
J. Am. Chem. Soc., 2024, 146, 18823–18830, DOI: 10.1021/jacs.4c05217
导师介绍
唐勇
https://www.x-mol.com/university/faculty/15597
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!













































 京公网安备 11010802027423号
京公网安备 11010802027423号