钴(III)-超氧化物复合物揭示硫醇双加氧酶催化机制
注:文末有研究团队简介及本文作者科研思路分析
硫,是生命活动中不可或缺的重要基本元素。含硫醇小分子的代谢平衡对人类健康至关重要,一旦失衡会导致诸如阿尔兹海默症和亨廷顿病等神经退行性疾病。氧气浓度感知对于生命活动及其重要,对于高等生物的氧化应激和缺氧适应的生命过程尤为重要。硫醇双加氧酶(Thiol dioxygenases)是一类非血红素铁依赖蛋白酶,能够催化硫醇分子氧化成亚磺酸盐(图1A),这一酶家族对生物的硫代谢起到极为重要的作用。ADO(cysteamine dioxygenase),作为硫醇双加氧酶家族的重要一员,既可以催化的小分子Cysteamine来维持硫的代谢平衡,又可以修饰关键信号蛋白的N-末端Cys残基来促成其有序降解(图1B)。因此,ADO在代谢平衡和体内氧化还原平衡中起扮演极为重要的角色。

图1. ADO催化的化学反应及其生物学功能。A)ADO能够以含硫醇的小分子和多肽为底物;B)ADO能够感应细胞内氧气浓度并调控相关信号蛋白的降解。RGS4/5和IL32是AOD介导的氧气依赖N末端蛋白降解的通路中的目标蛋白。
近年来,尽管不断有关于硫醇双加氧酶的催化机制提出,计算化学领域的工作也积极跟进,目前仍缺乏足够实验证据佐证关键中间体的存在,所以其催化机制在金属蛋白酶领域是一个由来已久却又悬而未决的重要科学问题(图2)。近日,德克萨斯大学圣安东尼奥分校(UTSA)刘爱民教授(点击查看介绍)团队从生物无机化学的角度对ADO的催化机制进行了深入的研究,其中使用的专业技术方法包括酶学活性测定、分子生物物理光谱和电子顺磁共振谱、生物大分子晶体结构解析(Methods Enzymol. 2024, DOI: 10.1016/bs.mie.2024.05.018)。当用Co(II)离子替换ADO中自然存在的Fe(II)离子后,使用HPLC-MS方法检测到了CoADO具有显著酶活性(图3A)。由于Co离子在生物体系中几乎不处于四价态,这一实验结果支持了无需四价金属离子参与的两氧原子同步转移机理。同时,作者解析了CoADO的晶体结构(图3B),其与FeADO的结构基本吻合。这说明CoADO蛋白基本保持了FeADO的原有结构,因而其反应活性的区别源自金属中心离子的不同。他们进一步使用谱学工具捕捉到了重要的催化中间体—钴(III)-超氧复合物(图3C和3D),其具有316 nm的紫外吸收特征峰,并展现出清晰八裂分的EPR信号峰。EPR裂分的耦合常数(A value)为67 MHz,与报道的小分子钴(III)-超氧复合物的特征基本吻合。
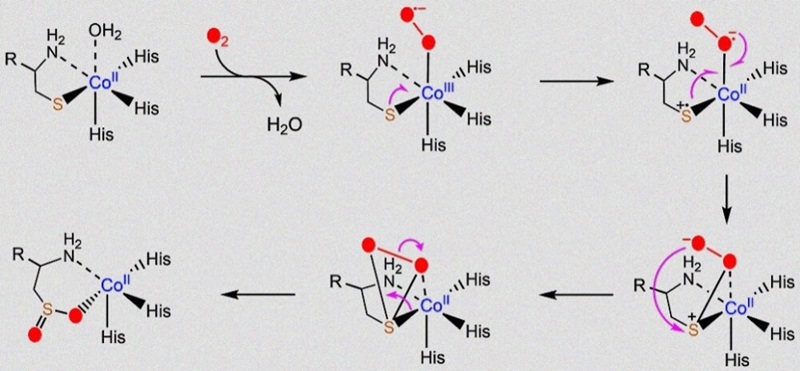
图2. 通过钴(III)-超氧化物复合物进行的钴(II)取代的CoADO氧化反应。
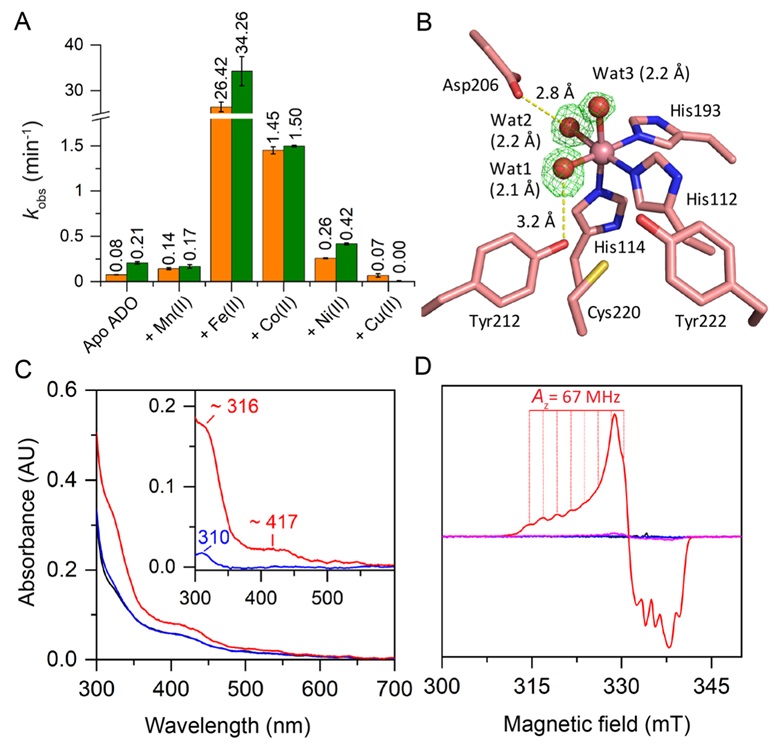
图3. CoADO活性测定、晶体结构和谱学分析。A)二价金属离子置换的ADO的活性测定;B)CoADO活性中心附近氨基酸残基和水分子;C)Co(II)ADO(黑),底物结合Co(II)ADO(蓝),和氧气和底物结合Co(II)ADO(红)的UV-vis吸收光谱;D)Co(II)ADO(黑),底物结合Co(II)ADO(蓝),和氧气和底物结合Co(II)ADO(红)的EPR谱(0.2 mW,50 K)。
该项研究使用生物无机化学的研究方法系统探究了ADO的催化机制。研究结果不仅为金属蛋白酶学和氧气依赖N-末端蛋白降解领域引入新的知识,也对人工蛋白酶的设计有所启示。同时,该项研究的多种生物化学和生物物理研究手段可以适用于其他金属蛋白酶的研究。
这一成果近期发表在Journal of the American Chemical Society 上,文章的通讯作者是UTSA李家松教授和刘爱民教授,共同作者是UTSA博士研究生段然。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Cobalt(II)-Substituted Cysteamine Dioxygenase Oxygenation Proceeds through a Cobalt(III)-Superoxo Complex
Jiasong Li*, Ran Duan, and Aimin Liu*
J. Am. Chem. Soc., 2024, 146, 18292–18297, DOI: 10.1021/jacs.4c01871
研究团队简介

刘爱民 教授,美国德州大学圣安东尼奥分校化学系教授,Lutcher Brown讲席教授,美国AAAS科学协会会员。
课题组长期致力于研究多种氨基酸在重要生命过程中的作用,采用代谢酶学、化学生物学、生物无机化学和生物物理学等方法。研究方向包括氨基酸的代谢、交联、氧化,金属酶的催化机理,C-H/C-F键的活化,蛋白辅酶的生物合成,自由基酶学,酶介导的信号传导以及基因调控等,涉及抗生素天然产物、抗衰老、癌症和免疫等领域。
研究成果发表在PNAS、JACS、Nature Chem Biol、Nature Commun.、Angew. Chem.、Chem. Sci.、JBC、ACS Catalysis和Biochemistry等期刊上,总计100余篇。详见课题组网站:https://Feradical.utsa.edu/
https://www.x-mol.com/university/faculty/5229

李家松 博士, Asst. Prof. for Research(博士毕业于中国科学技术大学)

段然 博士研究生(本科毕业于大连理工大学)
科研思路分析
Q:这项研究最初是什么目的?或者说想法是怎么产生的?
A:目前提出的硫醇双加氧酶的催化机制包括:1)无Fe(IV)参与,双氧原子同步转移机理。这一机理获得了反应中间体晶体结构的支持;2)有Fe(IV)参与,两氧原子分步转移机理。这一机理获得了理论计算结果的支持。二者之间的区别在于是否有Fe(IV)参与反应。由此,我们设想,如果将ADO中原有的Fe(II)替换为其他不支持高价态的Co(II)且CoADO依然保留活性,则可验证无Fe(IV)参与的两氧原子同步转移机理。
Q:研究过程中遇到哪些挑战?
A:1)如何制备不含金属离子的ADO蛋白以及金属蛋白酶的无氧操作技术。本实验室的严格系统训练是解决这个问题的关键;2)如何对捕获关键中间体进行谱学分析。扎实的理论基础和敏锐的数据分析是鉴定其电子结构的关键。
Q:该研究成果可能有哪些重要的应用?哪些领域的企业或研究机构可能从该成果中获得帮助?
A:ADO是人体内潜在药物靶点,所以相关研究有助于药物设计;ADO在植物缺氧环境适应调控过程中起到重要作用,相关研究有助于农业领域的发展;具有催化活性的Co金属酶对人工金属蛋白酶的理性设计有所启示。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号