Adv. Funct. Mater.:基于膜仿生高活性NIR-II发射纳米药物的胰腺癌多重光诊疗
利用荧光材料在近红外二区窗口 (NIR-II, 1000-1700 nm) 进行荧光生物成像具有高分辨率、低组织自吸收和深的穿透深度等诸多优势,在生物医学领域具有巨大的应用潜力。在NIR-II荧光材料中,有机小分子因其低毒性、光学性质可调等特点显示出非凡的优势。同时,NIR-II荧光团在近红外区的吸收使其可作为有效的光敏剂,在光动力治疗(PDT)和光热治疗(PTT)等过程中发挥作用。然而,由于受到能隙定律的限制,尤其是在波长超过1200 nm时,NIR-II发射材料通常具有较低的量子产率(QY)。到目前为止,只有少数有机材料被用于NIR-II窗口的高亮度生物成像和治疗。因此,仍然迫切需要开发高效的有机光诊疗材料,用于肿瘤生物成像和治疗。
近日,苏州大学李盛亮教授联合上海交通大学附属第六人民医院王洪成主治医师等人设计合成了一种A-D-A结构的有机共轭小分子TPC,其纳米粒子(TPC NPs)具有高量子产率(QY, 9.8%)、高活性氧(ROS, type I和type II型)产生能力和高光热转换效率(PCE, 57%),进一步通过同源肿瘤细胞膜仿生制备获得有机纳米药物(TPC CNPs)实现了高分辨率的动物全身血管和肿瘤靶向成像、PDT联合PTT高效清除胰腺癌功能。相关工作发表在Advanced Functional Materials。
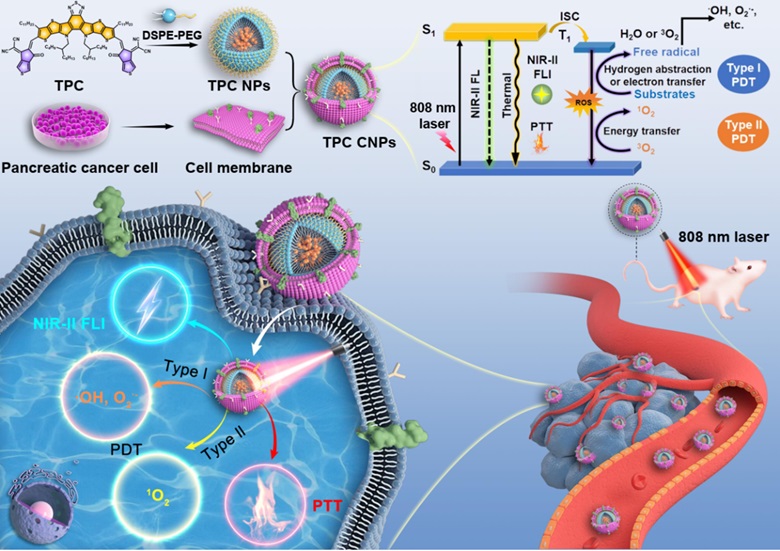
论文研究内容示意图
光诊疗剂TPC NPs的制备与表征
如图1所示,通过经典的Knoevenagel缩合反应合成了A-D-A构型的共轭小分子TPC,并通过理论计算TPC的最高已占据分子轨道(HOMO)和最低未占据分子轨道(LUMO)证明其具有良好的D-A结构,较强的分子内电荷转移(ICT)特性使TPC分子在710 nm处的吸收峰发生红移至TPC NPs的773 nm。在808 nm激光的激发下,一方面,TPC NPs表现出明显的NIR-II荧光发射信号和较高的QY;另一方面,TPC NPs优异的ROS产生能力,包括type I的•OH、O2•-和type II型的1O2,表明其是一种高效NIR光敏剂。同时,TPC分子较高的摩尔消光系数(1.4 × 105 L mol-1 cm-1)使得TPC NPs具有高的PCE(~57%),有助于进一步实现体内PTT。
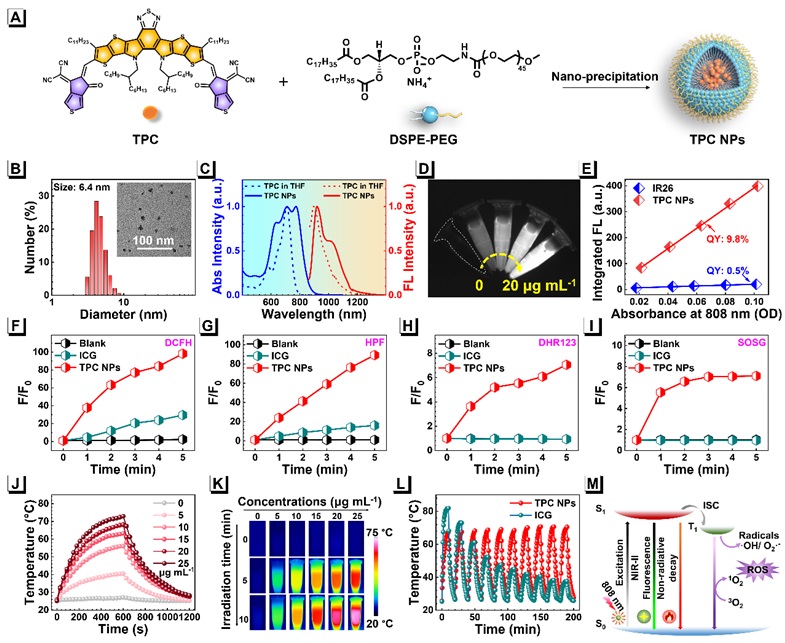
图1. TPC NPs物理、光学性质表征
体外肿瘤细胞消融作用
通过体外模型测试了肿瘤细胞膜仿生制备的纳米药物TPC CNPs对肿瘤细胞的消融作用。结果表明,TPC CNPs对小鼠胰腺癌细胞(Panc-02)、人类非小细胞肺癌细胞(A549)和正常组织细胞小鼠成骨前(MC3T3-E1)具有较好的细胞相容性;而在0.75 W cm-2的808 nm激光照射下,TPC CNPs对Panc-02和A549细胞有明显的杀伤作用,证明其良好的抗肿瘤潜力。值得注意的是,在0.33 W cm-2的808 nm激光照射下,此时PTT功能可忽略不计,TPC CNPs对Panc-02和A549细胞依然具有较明显的杀伤作用,证明了其高效的PDT作用。
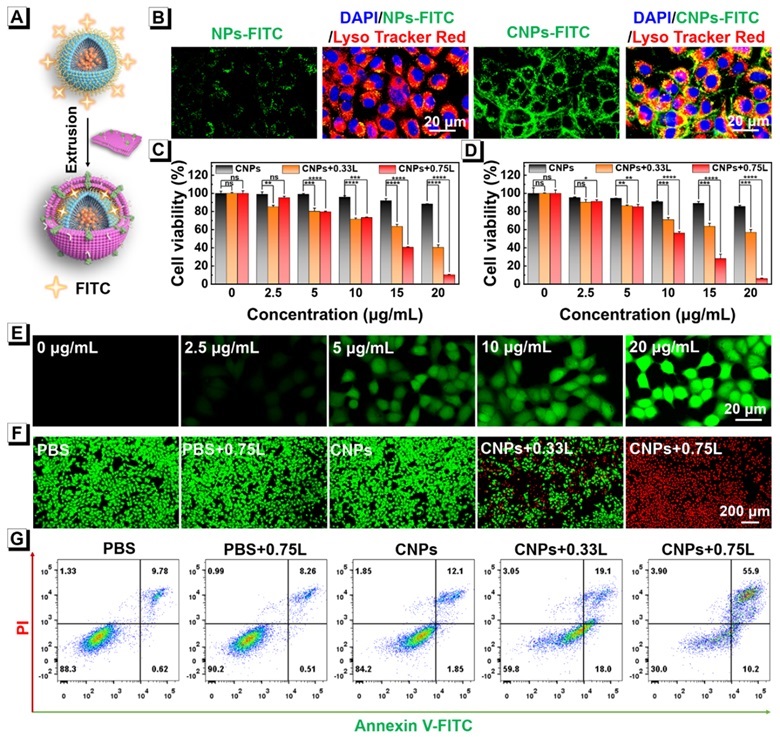
图2. 体外细胞实验
生物体内NIR-II成像引导的胰腺癌治疗
在1000-1400 nm范围通过不同的长通滤光片,观察小鼠全身血管成像效果,如图3所示,在所有NIR-II发射的图像中都能看到小鼠血管,且随着波长的增加,图像信噪比显著提高,背景干扰明显减少,表明TPC CNPs具有高亮度和高分辨率的NIR-II成像潜力。如图4所示,在NIR-II窗口中的生物成像进一步用于动态可视化TPC CNPs的体内靶向递送,结果表明,纳米药物TPC CNPs尾静脉注射后6 h在肿瘤部位达到有效蓄积。同时,与TPC NPs相比,仿生的TPC CNPs具有增强的肿瘤靶向积累。在21天的治疗期间,经过TPC CNPs和0.75 W cm-2的808 nm激光照射处理的实验组表现出有效的肿瘤消除作用,没有观察到明显的复发。此外,通过组织切片和血液分析进一步证明了TPC CNPs具有良好的生物安全性。
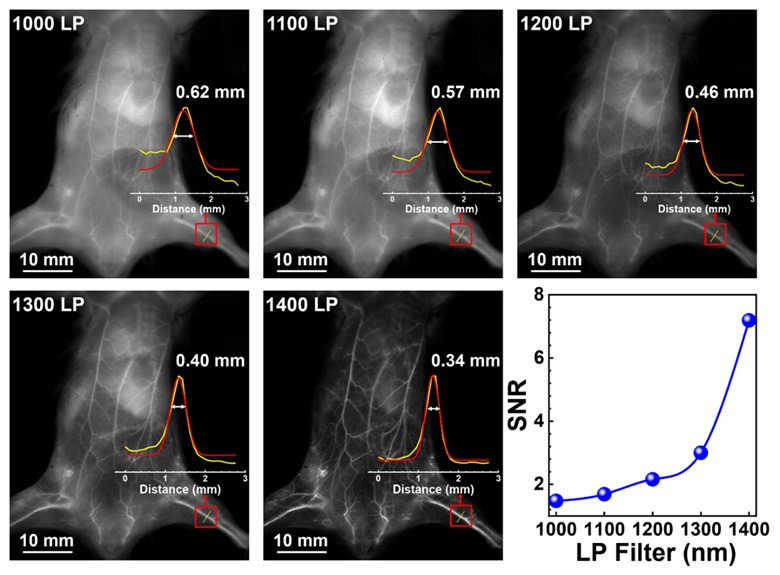
图3. 小鼠全身血管NIR-II荧光成像
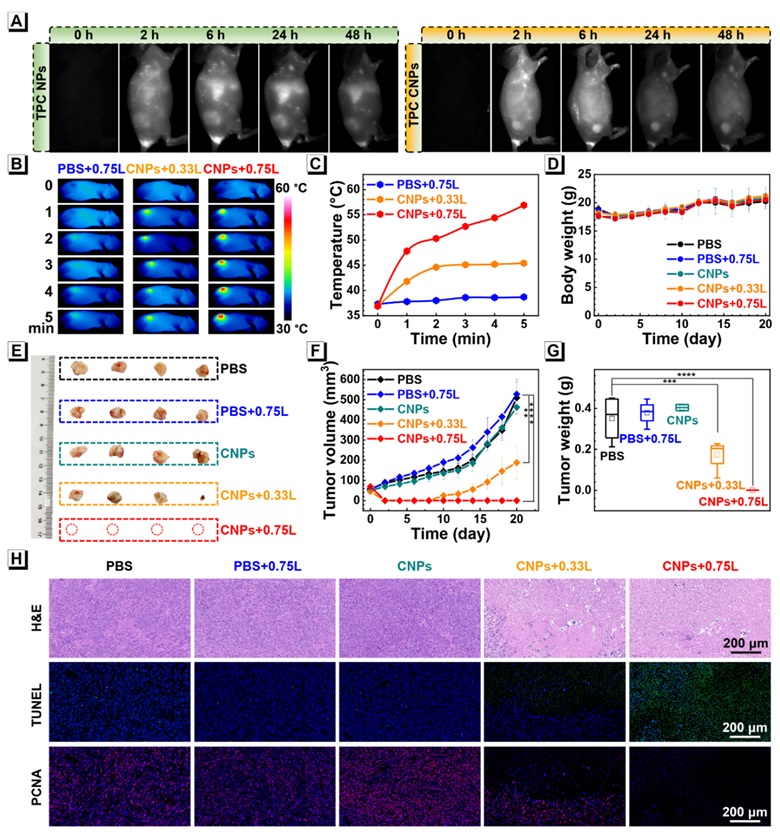
图4. NIR-II荧光成像引导下的小鼠胰腺癌消除作用
该工作为高性能的肿瘤靶向光诊疗的发展提供了可行的思路。上海交通大学王益威博士和苏州大学硕士研究生张洁为本文共同第一作者,苏州大学李盛亮教授、王玉博士以及上海交通大学附属第六人民医院王洪成主治医师为本文通讯作者。本研究得到了国家自然科学基金等项目的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A NIR-II-Emissive Organic Nanomedicine with Biomimetic Engineering for High-Contrast Targeted Bioimaging and Multiple Phototherapies of Pancreatic Tumors
Yiwei Wang#, Jie Zhang#, Yu Wang*, Jie Yu, Yijian Gao, Yuliang Yang, Xiliang Li, Hongcheng Wang*, Shengliang Li*
Adv. Funct. Mater., 2024, DOI: 10.1002/adfm.202406483
李盛亮教授简介
李盛亮,苏州大学特聘教授,博士生导师。研究兴趣主要聚焦于生物光子学与纳米医学范畴,发展光热磁技术实现精准与高效低毒的重大疾病治疗、生物成像和生物活性调控。入选国家级青年人才、江苏省杰出青年基金、江苏特聘教授(重点资助)、姑苏创新青年领军人才等国家及省市项目。近年来发表高水平SCI论文90余篇,其中包括以第一或通讯作者在Adv. Mater., Angew. Chem. In. Ed., ACS Nano等国际权威刊物上发表的论文60余篇,其中ESI高被引论文5篇。申请 PCT 国际专利 4项,获授权中国专利 4 项,参与撰写2本纳米材料领域书籍。同时长期担任Angew. Chem. In. Ed., Adv. Mater., ACS Nano, Adv. Funt. Mater.等30余个国际期刊的独立审稿人。主要研究方向:光学药物、探针以及药物递送。
课题组网站:
https://www.x-mol.com/groups/photon-med
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


















































 京公网安备 11010802027423号
京公网安备 11010802027423号