芝加哥大学林文斌团队Angew:纳米级金属-有机单层重新编程细胞代谢以增强光动力疗法和肿瘤免疫治疗
光动力疗法(PDT)是一种利用光敏剂在特定波长光照射下产生细胞毒性的活性氧(ROS)来杀伤肿瘤细胞并激活抗肿瘤免疫反应的治疗方法。然而,肿瘤组织的乏氧微环境对ROS的生成形成了阻碍。此外,由PDT引发的免疫反应也容易受到肿瘤为环境中免疫抑制因素的影响而削弱。肿瘤微环境的乏氧及免疫抑制性通常源于异常的细胞代谢活动。例如,肿瘤细胞过度活跃的线粒体代谢会大量消耗氧气,导致局部组织乏氧。同时,癌细胞异常的糖酵解过程会产生大量的免疫抑制代谢物(如乳酸),这些代谢产物能够损害T细胞功能,抑制机体的抗肿瘤免疫效应。因此,针对癌细胞代谢途径的重编程成为当今癌症治疗领域的重要研究方向和靶点。
糖酵解抑制剂,例如3-溴丙酮酸(BrP),作为肿瘤代谢重编程的有效策略,具有显著的优点。首先,通过抑制糖酵解途径,它有效阻断了癌细胞的增殖和生长,对肿瘤的生长具有抑制作用。此外,减少乳酸等代谢产物的积聚有助于改善肿瘤微环境,增加局部氧供,进而促进其他治疗方法的实施和效果。然而,包括BrP在内的大多数糖酵解抑制剂在递送到肿瘤组织和维持长期治疗方面面临挑战。因此,如何高效递送糖酵解抑制剂至肿瘤,并通过干预癌细胞代谢活动改善肿瘤微环境,增强光动力疗法的效果,并提升抗肿瘤免疫反应的强度,成为当前重要的科学研究问题。
纳米级金属有机单层(nanoscale metal-organic layer, nMOL)是一种新兴的无机-有机混合型纳米材料。它由金属簇构成的二级结构单元(secondary building unit, SBU)和有机配体有序配位排列组成。光敏剂可以周期性地作为配体嵌入这些晶体框架中,这不仅提升了光敏剂的负载能力,还通过SBU在空间上隔离光敏剂,有效防止其激发态的自猝灭现象。在光动力疗法治疗癌症方面,nMOL展现出极为优异的性能。
近期,芝加哥大学林文斌教授(点击查看介绍)团队报道了一种新型二维纳米光敏剂BrP@MOL,该纳米材料通过代谢重编程有效地逆转了肿瘤微环境中的乏氧和免疫抑制状态。BrP@MOL利用BrP上羧酸与SBU与二维MOL中Hf12-SBUs配位结合,实现了光敏剂与BrP在MOL上的高效负载,并能有效地递送至肿瘤细胞内。经过体外及体内实验验证,BrP@MOL作用于肿瘤细胞,抑制其线粒体和糖酵解代谢途径,增加肿瘤组织内的氧气供应,同时减少乳酸的生成,从而显著增强了光动力疗法的效果和免疫激活作用。这种光/代谢疗法显著不仅有效阻断了肿瘤的复发,还预防了原位乳腺癌向肺部的转移。与抗PD-L1免疫检查点联合治疗时,BrP@MOL进一步增强了其抗肿瘤效果,治愈率可达80%。这项研究将金属-有机框架纳米递送平台与光动力疗法、代谢重编程以及肿瘤免疫学融合,展现了一种前景广阔的基于纳米材料的光/代谢策略。该策略旨在提升光动力疗法的治疗效果,并强化抗肿瘤免疫反应,通过有效逆转乏氧和免疫抑制的肿瘤微环境,为肿瘤治疗开辟了新的可能性。
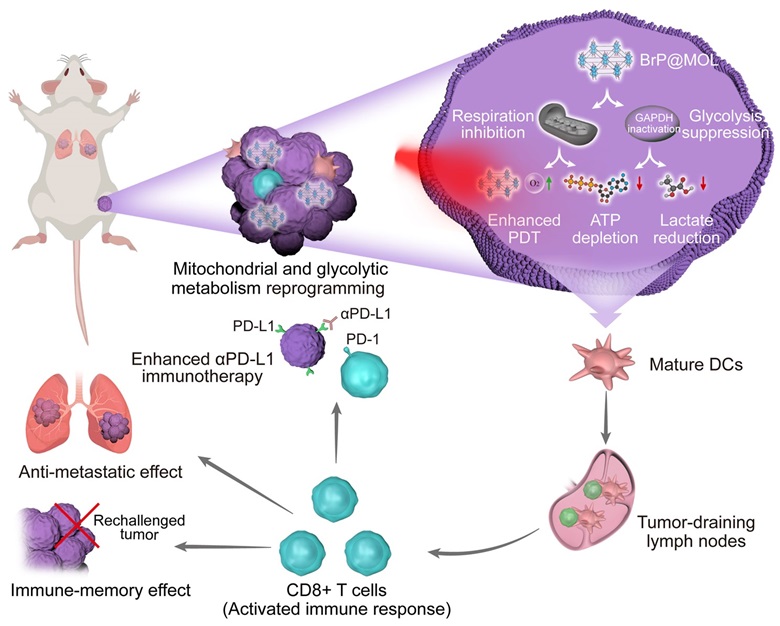
图1. BrP@MOL通过对线粒体和糖酵解代谢重编程从而增强光动力疗法和肿瘤免疫治疗。
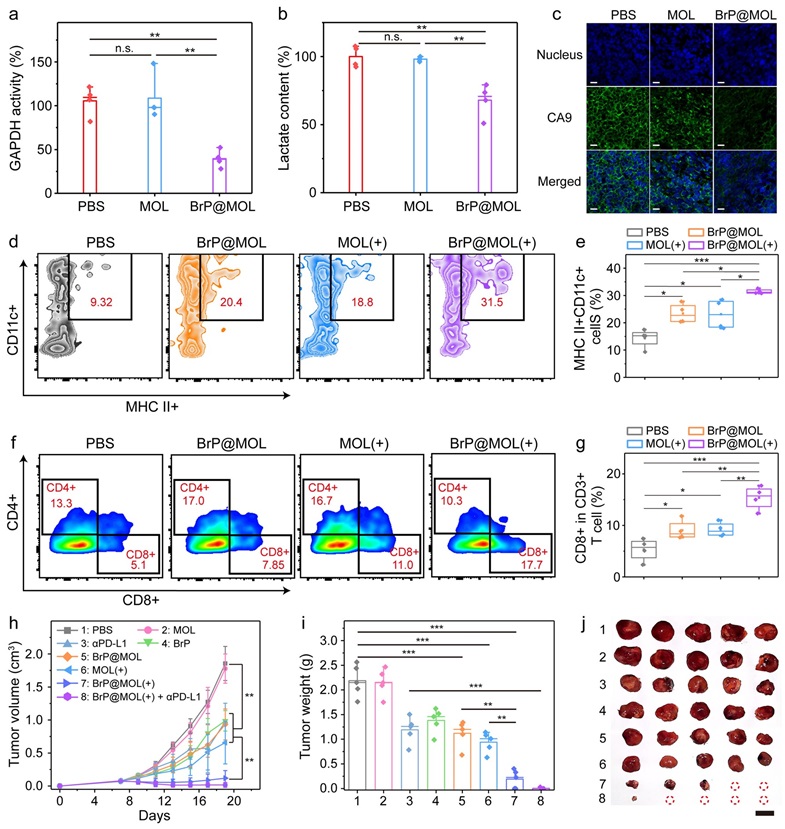
图2. BrP@MOL在小鼠模型上通过重新编程细胞代谢,增强了免疫激活及抗肿瘤效果。图片来源:Angew. Chem. Int. Ed.
这一成果近期发表在Angew. Chem. Int. Ed.上,文章的第一作者是芝加哥大学博士后林凎和博士生田瀚(Langston Tillman)。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Nanoscale Metal-Organic Layer Reprograms Cellular Metabolism to Enhance Photodynamic Therapy and Antitumor Immunity
Gan Lin†, Langston Tillman†, Taokun Luo, Xiaomin Jiang, Yingjie Fan, Gang Liu, Wenbin Lin*
Angew. Chem. Int. Ed., 2024, DOI: 10.1002/anie.202410241
团队(通讯作者)介绍

林文斌教授(芝加哥大学)
林文斌教授于1994年在美国伊利诺伊大学厄巴纳-香槟分校化学系获博士学位;1994至1997年在美国西北大学从事博士后研究工作;1997年至2001年在美国布兰迪斯大学化学系任助理教授;2001年至2013年任职于美国北卡罗来纳大学教堂山分校,并于2011年被聘为Kenan 杰出教授;2013年起担任美国芝加哥大学化学系James Frank讲席教授;系中国科学院海外顾问组成员,香港研究资助委员会自然科学部委员(2012-2013年度兼任主席),美国国立卫生研究院NANO Study Section常务会员;2011年当选为美国科学促进会会士(AAAS fellow);2023年当选为欧洲科学院院士。
林文斌教授所领导的研究团队是国际上最早进行理性设计合成金属有机框架材料的团队之一,主要研究方向为功能材料、手性催化、光催化、纳米医学及化学药物设计等。林文斌教授带领团队于2005年开发了全球首个具有高手性选择性的金属有机框架化合物不对称催化剂,同时在利用金属有机框架化合物发展非线性光学材料及人工光合作用等方面的研究位居国际前列,所发展的具有二阶非线性光学性质的金属有机材料是最早进行晶体工程方法控制金属有机化合物的尝试之一。近年来,林文斌教授团队创造性地开发了多种基于金属有机框架纳米颗粒的分子可调控、生物可降解及高载药量的新型纳米抗癌药物,并率先报导了利用局部递送纳米药物激活局部免疫和系统性免疫的癌症治疗新思路。为了推动相关研究成果的临床转化,林文斌教授创立了名为Coordination Pharmaceuticals的生物医药公司,目前已有五种药物进入临床研究。
林文斌教授目前已在包括Nat. Chem., Nat. Biomed. Eng., Nat. Catal., Nat. Nanotech., Nat. Mater., Nat. Commun., J. Am. Chem. Soc., Angew. Chem. Int. Ed.等顶级国际学术期刊发表论文450余篇,研究成果被引用超7.9万次(h-index >139)。林文斌教授还担任多本著名学术期刊的顾问,如Chem. Sci., Chem. Mater., ACS Catal., Inorg. Chem. Front., Asian J. Org. Chem.等。林文斌教授在科研工作中取得的卓越成就,使其自2014年起一直被列为全球高被引化学家,并入选1999-2009年度全球十大化学家和2000-2010年度全球顶尖百名化学家(第54位)。
林文斌
http://www.x-mol.com/university/faculty/1445
课题组链接
http://linlab.uchicago.edu/index.html
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号