Angew:精准可控的DNA编码扩增反应用于活细胞膜蛋白多重定量成像
活细胞上多重膜蛋白的原位成像,可用于揭示其丰度和空间分布,对准确描述细胞类型、状态和动态过程至关重要。目前常见的膜蛋白多重成像工具,或受限于较低的成像通量、或由于工作流程中固有的致命物理化学处理手段而与活细胞样本难以兼容。目前,基于DNA的编码技术和扩增反应,如滚环扩增(RCA)、杂交链反应(HCR)和引物交换反应(PER),为高信号强度、高通量的活细胞膜蛋白成像提供了强有力的工具。然而,这些方法大小不一的扩增子产物,在检测过程中可能改变多重靶标的原始相对比例,不利于靶标定量的精确性。因此,针对活细胞表面不同丰度的多重靶标,如何进行可精准控制的信号放大和定量分析,仍然面临一定的挑战。
为应对以上挑战,中国科学院杭州医学研究所的韩达研究员团队开发了一种精准可控的DNA编码的扩增反应,用于活细胞膜蛋白的多重成像。相关工作发表在Angewandte Chemie International Edition 上。该工作得到国家重点研发计划、国家自然科学基金等项目支持,上海交通大学刁楠楠博士为该论文第一作者,韩达研究员和汪俊彦助理研究员为共同通讯作者。

该工作提出了一种新的DNA扩增反应,即模板聚合反应(TAR),可一步组装具有预定义信号放大能力的梳状DNA纳米结构(CDN),用于精准定量的活细胞膜蛋白多重成像。通过使用正交序列和光触发的迭代标记技术,TAR在不到2小时内对活细胞表面6-10种膜蛋白,实现了可控的多重成像,且不改变多靶标原始相对丰度比。与传统核酸扩增反应相比,TAR可用于高精度、高灵敏度和高保真的多重膜蛋白成像。
首先,TAR的设计和机制如图1所示。TAR使用具有特定序列的Primer(序列a)以及包含5'茎-环结构域(序列aa*)和3'悬挂结构域(序列b*a*)的Hairpin模板,Hairpin 3'端序列b*a*可与Primer的延伸产物序列ab稳定杂交。同时,Hairpin模板茎-环结构域中的序列a通过链间或链内杂交与延伸产物中的3'端序列a相竞争,从而释放出下轮反应的引物序列a(图1a,Step 3;图1b,State 1)。随后,延伸产物的序列a与体系中游离的Hairpin模板杂交,从而启动新一轮TAR级联反应(图1a,Step 4)。最终,延伸产物与多个Hairpin模板组装形成CDN。由以上可知,TAR的信号放大效率取决于CDN中Hairpin模板的数量,即可通过调整TAR体系中Hairpin与Primer的初始浓度比例,精确控制CDN中集成的Hairpin模板数量。
在传统的引物交换反应(PER)中,Hairpin模板完成一轮反应后,将从延伸引物中解离并被重新利用,类似于“催化剂”,最终生成不同长度的ssDNA。与PER不同,Hairpin模板在TAR反应中类似于“燃料”,可与延伸引物稳定结合并组装形成稳定的纳米结构。成功触发TAR而非PER的关键,在于控制State 0、State 1和State 2之间的平衡,使State 0向State 1的转变有利于TAR的发生(图1b)。序列b和a的长度分布对TAR的反应自由能起着关键调节作用,通过系统地探究序列a和b长度对TAR产物产率的影响发现,当序列a和b分别为10 nt和6 nt时,TAR反应效率最高(图1c-d)。
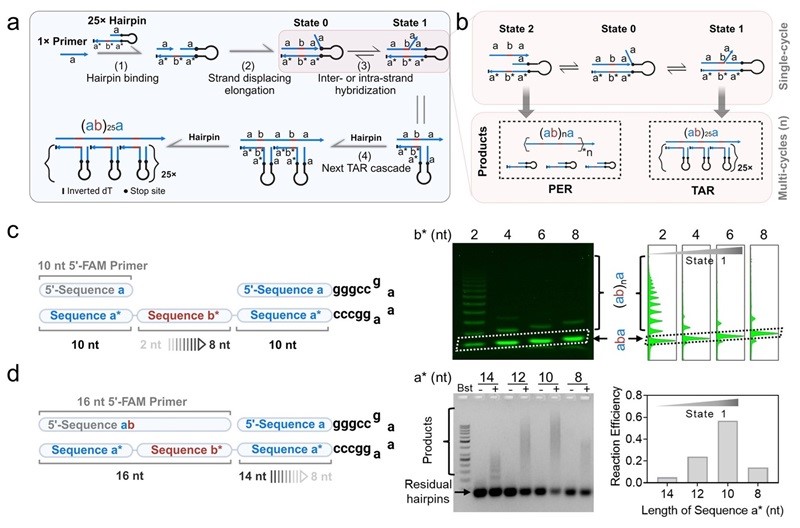
图1. TAR的设计原理和反应机制。
经过对TAR反应条件的优化,16套TAR序列均获得了长且均一的CDN产物(图2a-f)。随后,通过在TAR Primer 的5'端添加序列c,和用包被有不同浓度序列c*的磁珠模拟不同丰度的待检测物,作者验证了TAR体系中模板引物比对信号放大强度的控制能力(图2g)。流式结果显示,TAR可实现待检测靶标等比例、高保真和相对定量的检测,这为活细胞膜蛋白分析奠定了基础(图2h-j)。
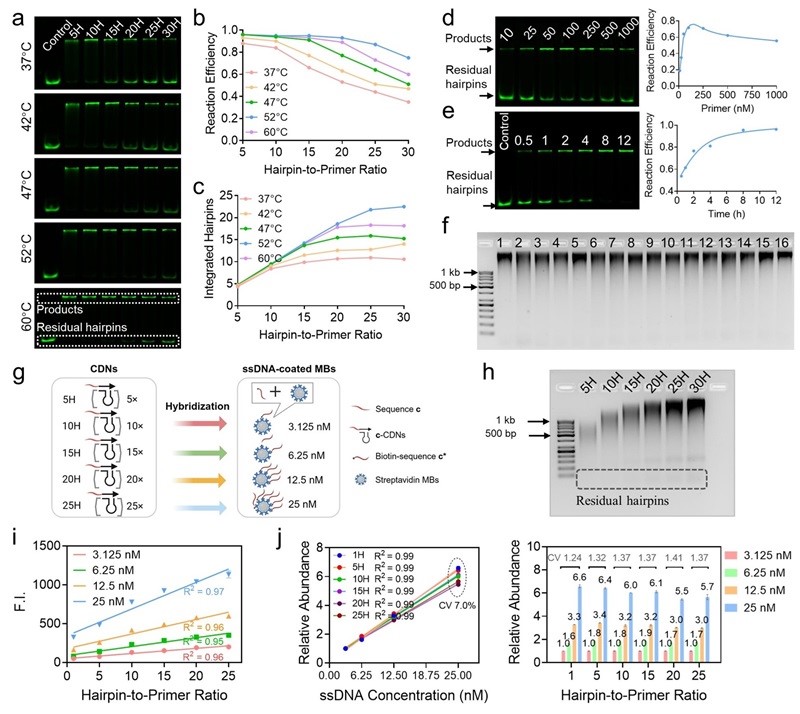
图2. 精准可控的TAR可用于体外高保真检测。
作者以常见的潜在肿瘤细胞标志物-膜受体酪氨酸蛋白激酶样7(PTK7)作为检测模型,通过联合使用亲和配体-核酸适体(Aptamer, Apt),探究了TAR在活细胞上放大膜蛋白信号的潜力(图3)。同时,Apt-CDN实现了单独Apt无法成像的SK-BR-3细胞表面低丰度膜蛋白PTK7和Met的成像。以上结果验证了TAR对活细胞膜蛋白的信号放大能力,尤其是低丰度膜蛋白。
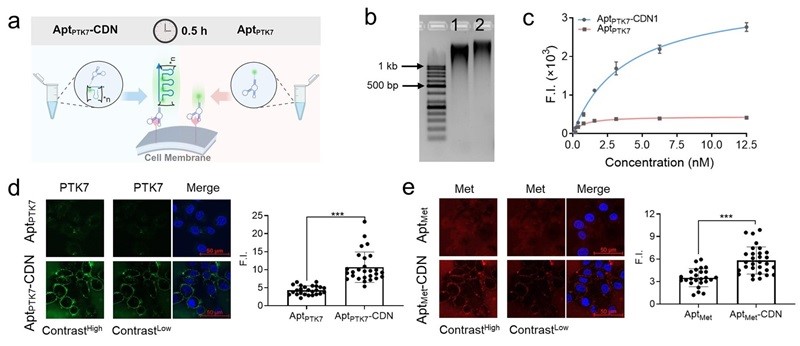
图3. TAR用于活细胞低丰度膜蛋白成像。
作者进一步选择了三种常见的潜在肿瘤标志物(Met、PTPRF和PTK7),使用正交TAR序列进行了多重靶标检测(图4)。在A-431和MDA-MB-453两种细胞系中,与单独使用Apt相比,Apt-CDN组三种膜蛋白的信号和信噪比显著增加。值得注意的是,三种膜蛋白Apt-CDN信号的相对比例与单独Apt组检测到的原始比例相一致,表明TAR能够在不干扰多个靶标原始比例的前提下进行信号的高保真放大。基于TAR的三重成像方法同时也与抗体具有兼容性,进一步证实了TAR可用于高保真度的定量、多重活细胞膜蛋白成像。
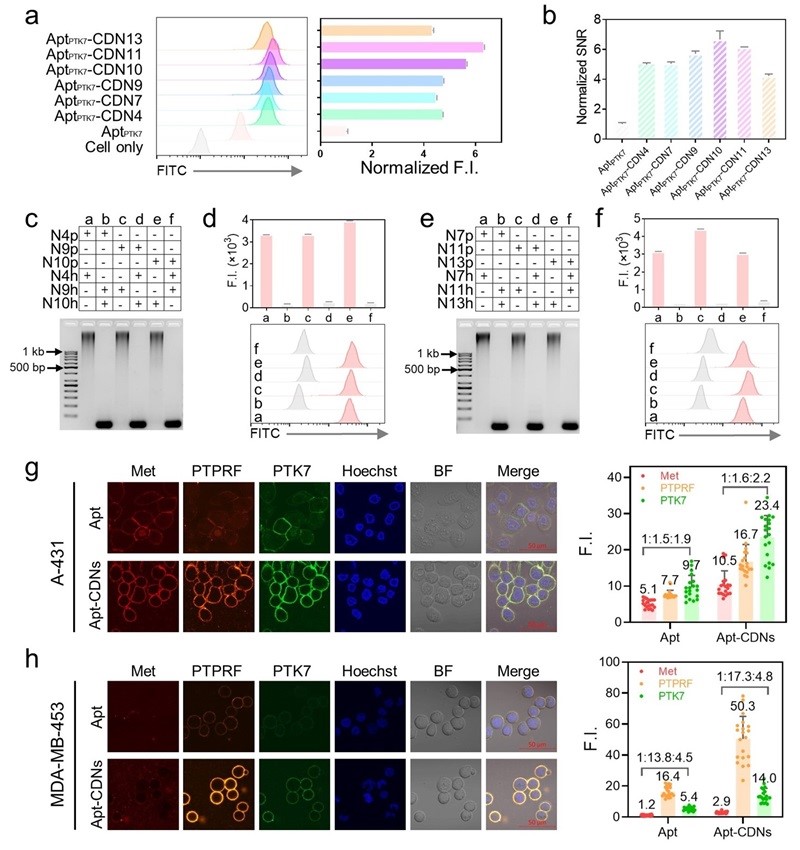
图4. 正交TAR用于活细胞膜蛋白高保真多重成像。
为了实现更高层级的多重成像,为活细胞膜蛋白的信号放大和多重成像提供强大的平台,作者将光可切割连接子(PC-Linker)引入了TAR多重成像检测体系。结果显示,在不影响细胞活性和形态的前提下,TAR与亲和配体(Aptamer和抗体)相结合,经两轮光谱多重检测,在A-431活细胞表面实现了六种膜蛋白的高保真成像(图5)。
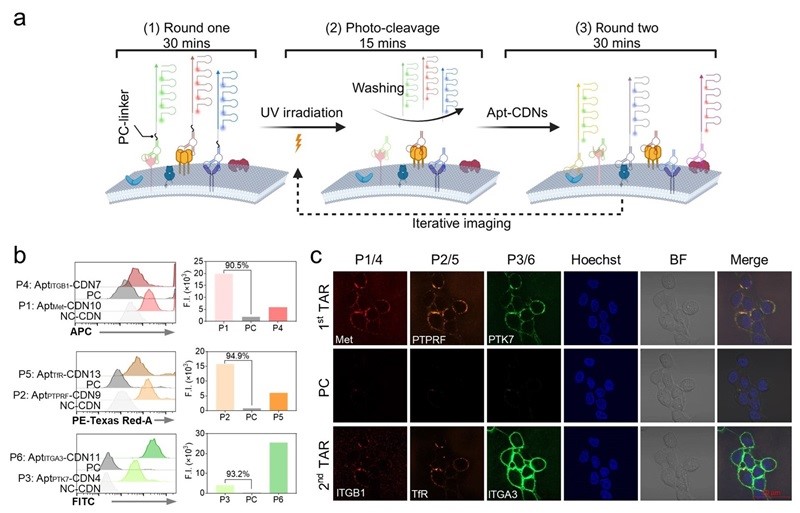
图5. TAR用于活细胞膜蛋白多轮迭代成像。
小结
该工作提出了一种新颖且高度精准可控的DNA扩增反应,用于活细胞表面多种膜蛋白的高灵敏成像。通过调整模板引物浓度比,可预定义TAR探针的信号放大能力,这对于其他基于DNA的信号放大策略(如RCA、PER和HCR)是难以实现的,因此TAR更有利于准确成像同一检测体系下不同丰度的待检测靶标,还可用于克服由于荧光强度不足或部分过曝导致的相对定量不准确的问题。由于TAR序列设计和操作程序的简单性,可在短时间内实现对复杂活细胞膜的高层级多重性成像。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Multiplexed and Quantitative Imaging of Live-Cell Membrane Proteins by a Precise and Controllable DNA-Encoded Amplification Reaction
Nannan Diao, Jianing Hou, Xinyu Peng, Yaru Wang, Axin He, Haiyan Gao, Linlin yang, Pei Guo, Junyan Wang, Da Han
Angew. Chem. Int. Ed., 2024, DOI: 10.1002/anie.202406330
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号