成都大学李俊龙课题组Nat. Catal.:NHC催化的超远端芳基C–H键位点选择性酰化反应
高选择性的远端惰性C–H键官能化一直是有机合成领域的重要挑战之一。其中,利用自由基介导的分子内氢原子转移(HAT)化学可以实现远端C–H键活化,然而这一策略通常局限于距离反应中心不超过7个化学键的C(sp3)–H键。相比之下,更远距离的芳基C(sp2)–H键具有较高的键能、空间位置不利等多种挑战,因而无法通过传统的自由基化学对其进行选择性活化。
近年来,氮杂环卡宾(NHC)有机催化的自由基反应已经成为发现具有挑战性和创新性反应的重要平台,为有机催化的自由基合成开辟了一条全新途径。成都大学李俊龙教授(点击查看介绍)团队一直致力于有机催化新反应的研究,近年来利用NHC有机小分子催化的自由基反应,实现了烯烃的氟烷基酰基化反应(Angew. Chem. Int. Ed. 2020, 59, 1863–1870, 点击阅读详细);利用氧化NHC自由基催化体系,完成了烯烃的双羰基化和烷基酰化反应(Angew. Chem. Int. Ed. 2022, 61, e202207824,点击阅读详细);结合1,5-HAT策略,完成了酰胺远端C–H键的直接酰化反应(Angew. Chem. Int. Ed. 2022, 61, e202116629, 点击阅读详细);通过NHC/PC双催化体系,实现了硼酸盐与酰基氟化物的偶联反应(Chem. Sci. 2022, 13, 2584–2590),以及烷基硼酸与酰基咪唑间的交叉偶联(ACS Catal. 2024, 14, 3181–3190)等。此外,该团队还利用氮杂环卡宾的双电子途径,实现非活化卤代烷烃的直接酰化反应(Angew. Chem. Int. Ed. 2023, 62, e202309572, 点击阅读详细)。

图片来源:成都大学李俊龙教授课题组
最近,该团队在氮杂环卡宾催化的自由基反应研究中取得了新的进展:利用NHC单电子还原带有离去基团的酰胺,生成的氮中心自由基通过分子内加成到芳环,产生五元环的Meisenheimer中间体,随后经过自由基偶联、重新芳构化过程,完成了一系列远端芳基C(sp2)–H键的活化,从而实现了一种全新的“超远端芳环的位点选择性酰基化”反应。该催化体系反应条件温和,具有高度的位置选择性,克服了芳烃固有的电子效应和位阻效应,完成了传统方法难以实现的酰基化反应,进一步丰富了氮自由基化学和NHC自由基催化的反应模式,为超远端芳基C(sp2)–H键的官能化提供了一个新颖的、绿色的、高效的合成工具。相关论文发表于Nature Catalysis,成都大学为该成果的唯一通讯单位,特聘研究员李青竹博士和成都大学2019级硕士研究生邹文林同学为本论文的共同第一作者,李俊龙教授为该论文的通讯作者。
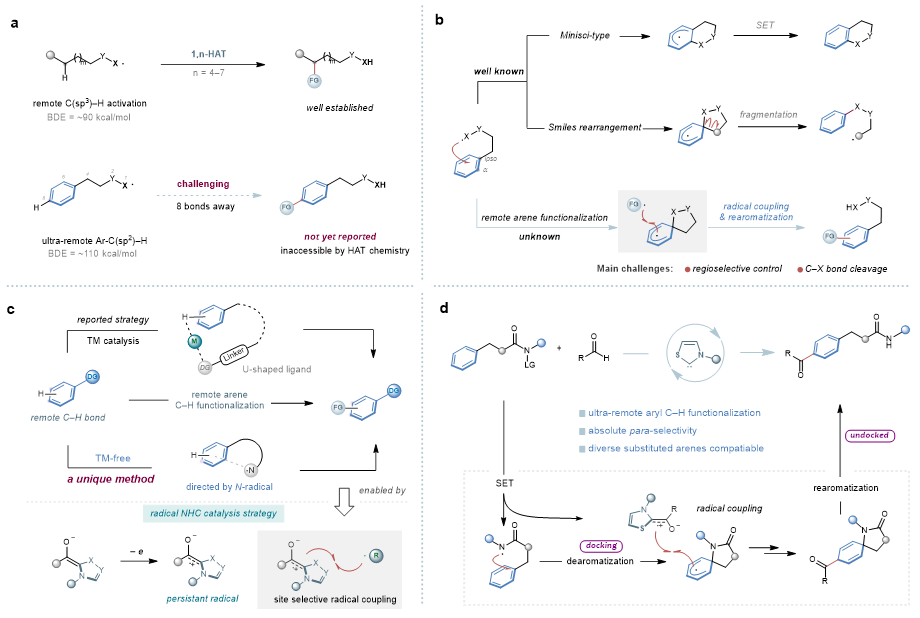
图1. 研究背景及N-自由基导向芳烃C–H键远端官能化的发现。
该团队首先以苯丙酰胺1a和苯丙醛2a为模型底物,通过大量的条件筛选发现:采用氮杂环卡宾N1为催化剂、K3PO4作碱、在甲苯中60 ℃反应效果最佳,能以96%的产率得到远端酰基化的产物3a。反应条件的敏感性评估结果表明:该反应对各种外部条件都比较耐受,但对氧气较为敏感,因而需要在惰性气体中进行反应。
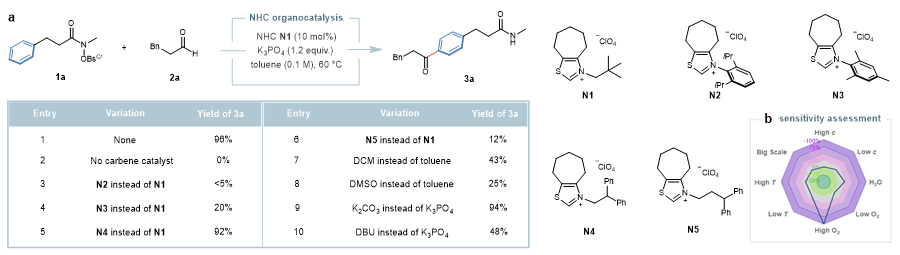
图2. 反应条件优化。
令人欣慰的是,该反应策略具有广泛的底物普适性。就醛类底物而言,不同电性基团取代的苯丙醛、直链脂肪醛、支链烷基醛、含有烯烃官能团或杂原子的烷基醛、环状烷基醛以及乙醛酸乙酯都能顺利进行反应;在对位、间位或邻位上具有吸电子或给电子取代基的苯甲醛、双取代芳醛、稠环芳醛和各种杂芳香醛也都能与该催化体系兼容。
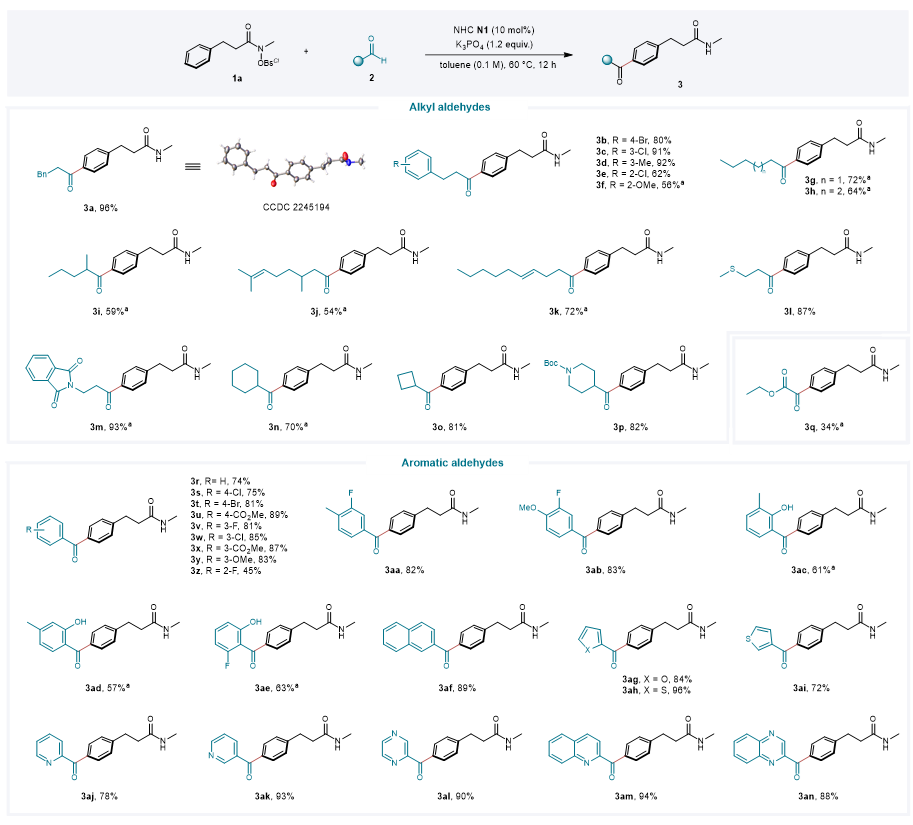
图3. 醛类底物拓展
酰胺类化合物的普适性考察结果表明:底物芳环上含有不同电性取代基、强定向基、强拉电子基或具有多个取代基时,也可以顺利地参与该反应。酰胺底物具有稠芳环、支链或增大N-自由基中心的空间位阻对催化效率均没有太大的影响。除了烷基酰胺,不同类型的氨基甲酸酯类底物也可以顺利进行反应。含有N-3,3-二苯丙基的氨基甲酸酯底物只得到了苄醇芳基对位酰化的产物,进一步证实了该反应的高位点选择性。此外,该反应还能实现联苯酰胺芳烃底物的位点选择性碳氢官能化。
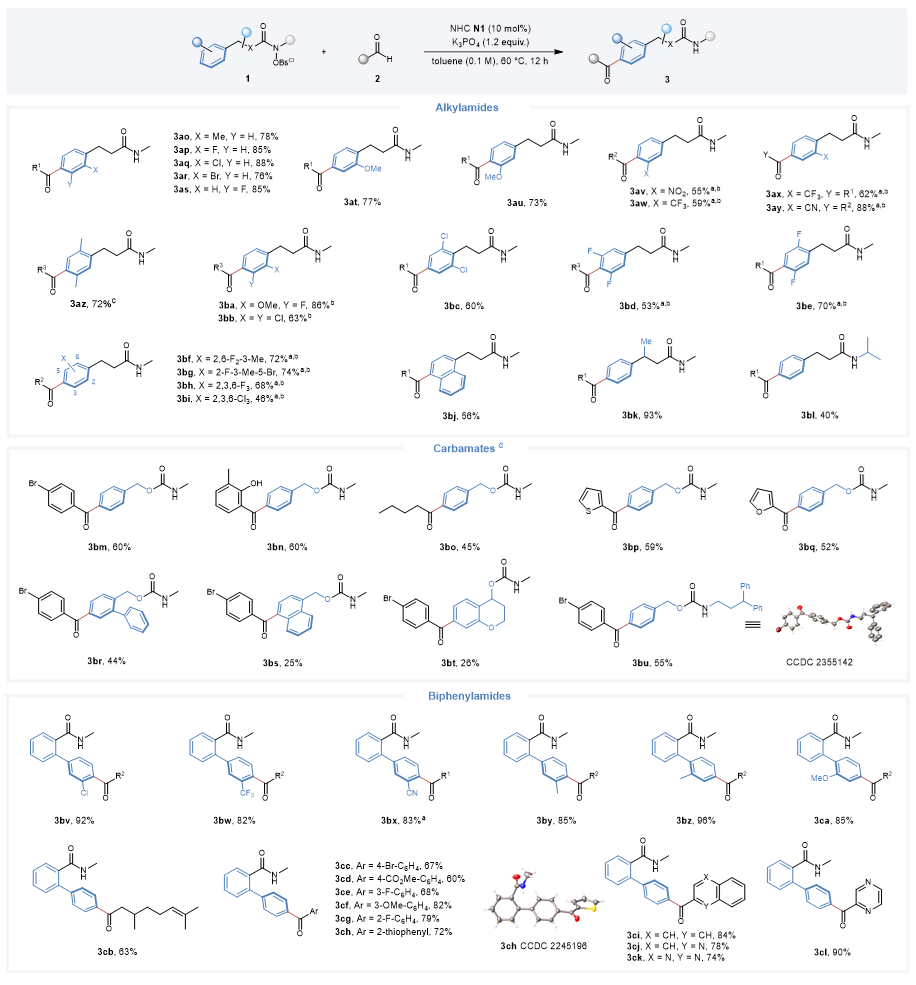
图4. 酰胺类底物拓展
该催化体系反应条件温和,可用于多种药物骨架、生物活性分子和糖类化合物的官能化修饰,如头孢类抗菌药物(cefoxitin)、非甾体类抗炎药芬布芬(fenbufen)和吲哚美辛(indometacin)、治疗痛风药物非布索坦(febuxostat)和丙磺舒(probenecid)、血脂调节药吉非罗齐(gemfibrozil)、治疗痤疮类药物阿达帕林(adapalene)、薄荷醇(L-menthol)、diacetone-D-galactose等。
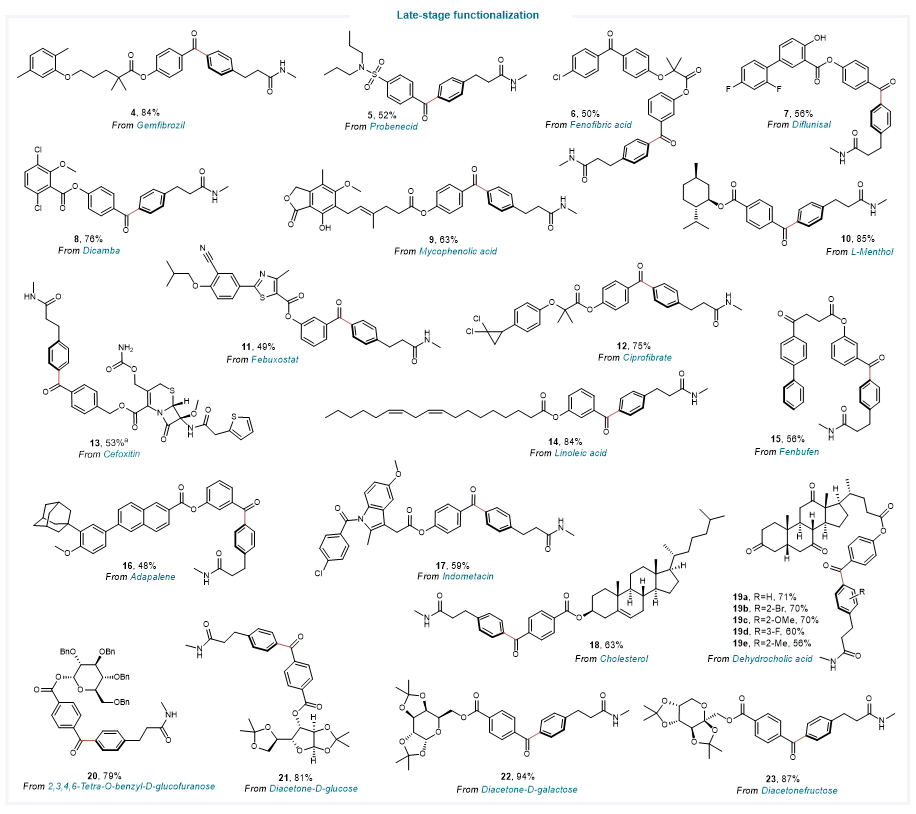
图5. 药物及生物活性分子的后期官能化应用
随后,作者通过对苯丙氨酸衍生物的官能化,进一步证明了该催化体系的通用性。此外,该反应对苯丙氨酸衍生的多种二肽、三肽、四肽和五肽衍生物也具有良好的兼容性,通过该反应还能实现糖和多肽骨架的快速连接。
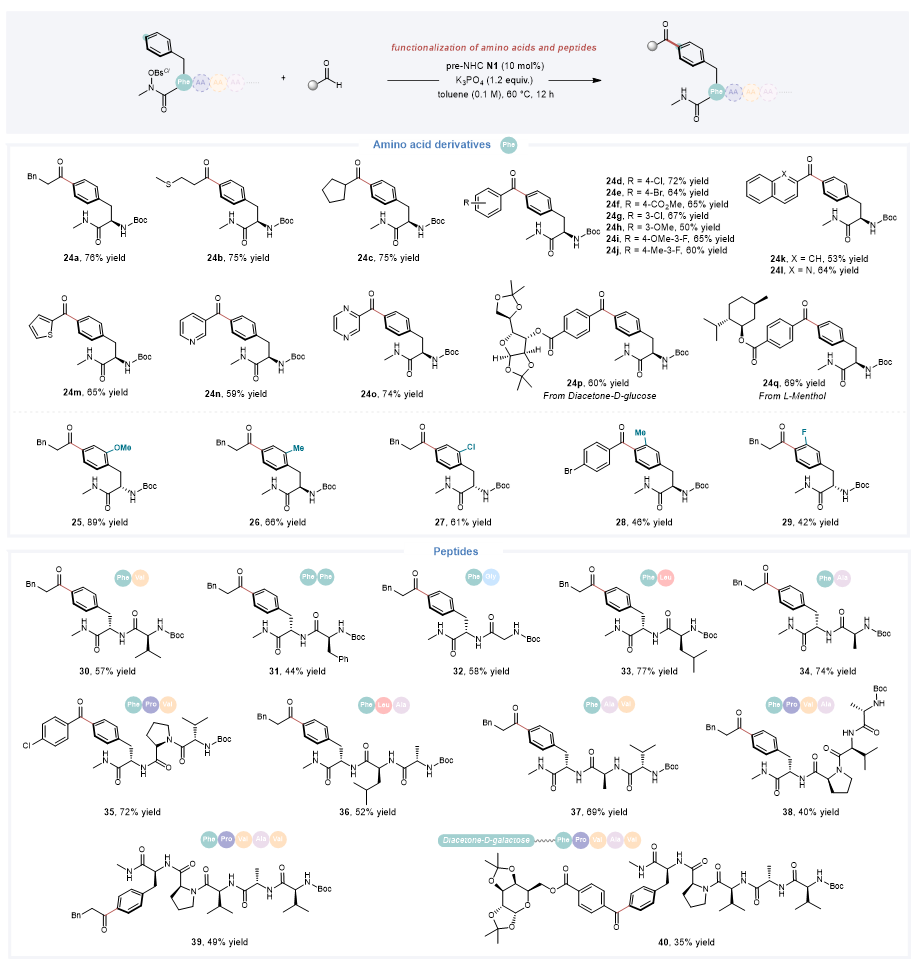
图6. 氨基酸衍生物及肽类的位点选择性官能化应用
这种远端碳氢键的官能化反应能够实现克级规模放大,并且酰化产物可以进行多样的化学转化,进一步彰显了本方法的实用性。为了阐明该远程酰化的反应机理,作者进行了详细的机理实验研究。首先,自由基抑制实验和自由基钟实验表明该催化反应涉及环己二烯自由基中间体;当9-蒽底物参与反应时,作者可以得到螺环酮中间产物,进一步加入强碱处理便可以顺利得到对应的酰化产物,表明该反应确实存在去芳构化的螺环酮中间体。此外,芳烃对位封堵或不饱和酰胺底物为反式烯烃时,反应都不能发生。氘代实验结果表明去质子化过程不是该反应的决速步骤。
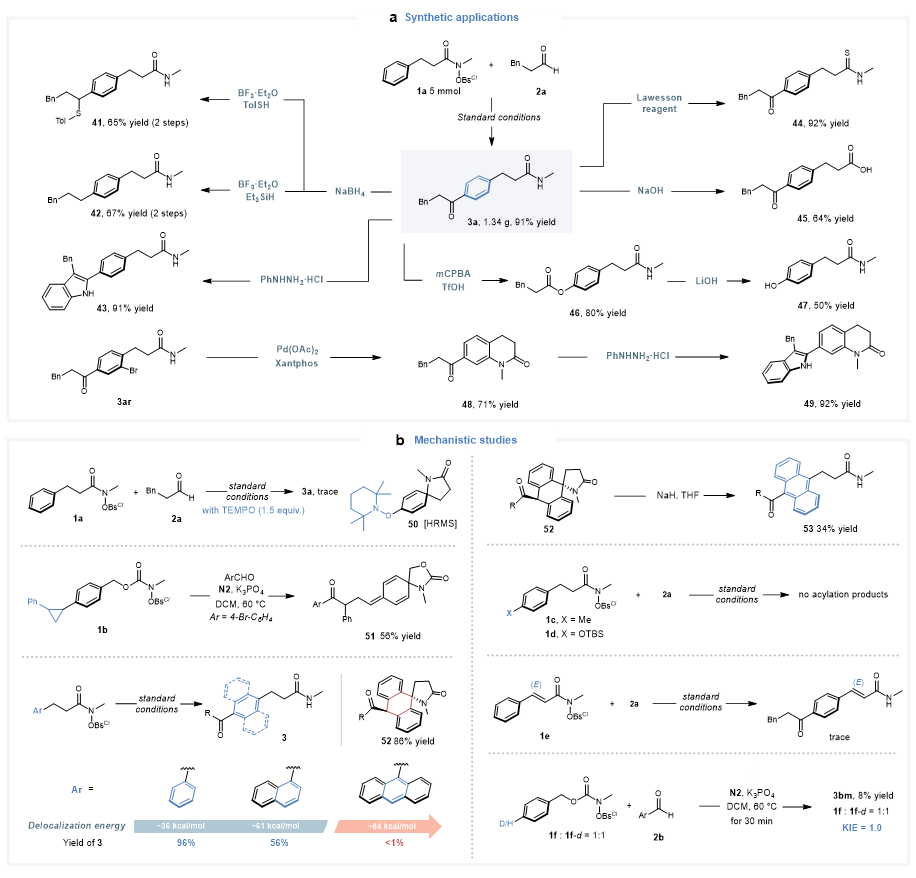
图7. 机理实验研究
在以上实验结果的基础上,作者进一步通过密度泛函理论(DFT)计算,研究了各反应路径的能量,通过自旋密度分布、扭曲和相互作用等分析,为NHC自由基催化远端碳氢键活化的位点选择性提供了合理的解释。在此基础上,作者提出了可能的反应机理。
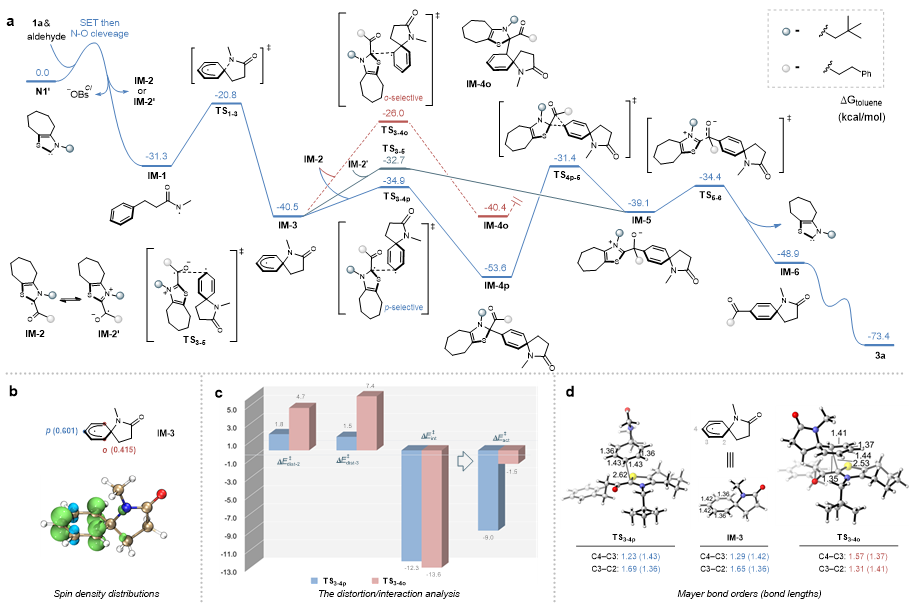
图8. DFT计算及可能的反应机理
总结
成都大学李俊龙课题组开发了一种“超远端芳环的位点选择性酰基化”反应,实现了距离活泼位点8根化学键的远程C–H键的高选择性活化。同时,该催化体系可以克服芳烃固有的电性效应和位阻效应,完成了一系列传统方法难以实现的酰基化反应,拓展了NHC自由基催化的应用范围。该催化体系为实现超远端芳基碳氢键的官能化提供了一个绿色简单的方法。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Remote site-selective arene C–H functionalization enabled by N-heterocyclic carbene organocatalysis
Qing-Zhu Li, Wen-Lin Zou, Zhao-Yuan Yu, Xin-Xin Kou, Yan-Qing Liu, Xiang Zhang, Yu He & Jun-Long Li*
Nat. Catal., 2024, DOI: 10.1038/s41929-024-01194-5
导师介绍
李俊龙
https://www.x-mol.com/university/faculty/78596
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号