南方科技大学王杰课题组Nat. Commun.:发展遗传编码的N-乙烯基组氨酸用于酶催化中心的重塑
近日,南方科技大学王杰课题组在Nature Communications 杂志上发表论文,开发了全新结构的Nδ-乙烯基组氨酸,实现了该非天然氨基酸在蛋白质中的高效编码,并将这一非天然氨基酸用于生物催化剂的定向进化(图1)。基于Nδ-乙烯基组氨酸侧链的特殊性质,作者对生物催化剂组氨酸催化中心进行了改进,大幅提升了酯酶和卡宾转移酶的性能。
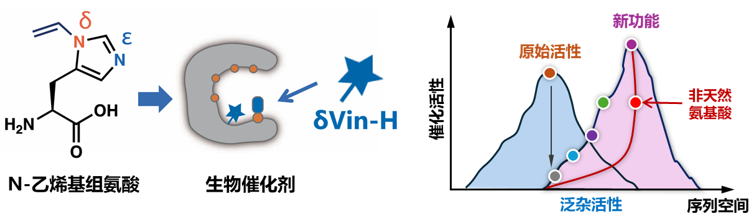
图1. Nδ乙烯基组氨酸(δVin-H)及其对酶活中心的进化
定向进化已经成为开发和改进蛋白功能的重要技术,但在大多数定向进化方法中,用来搭建蛋白的砌块还局限于20种天然氨基酸,这在一定程度上限制了酶的功能的开发。一方面天然氨基酸侧链的化学多样性有限,所能提供的化学性质不足,限制了新型酶的功能的开发,另一方面,天然氨基酸之间的突变对酶的结构是跳跃式和离散式的改变,难以实现对酶催化中心化学结构的微调和连续可调。如果将各类非天然氨基酸引入到定向进化过程中,将大大扩充蛋白质的化学空间和结构多样性,实现对酶催化中心结构的精细调控,从而大幅拓展酶活空间和蛋白质的各项性能。遗传密码子拓展技术作为一个强有力的工具可以将非天然氨基酸定点引入蛋白质(酶)的特定位点,对酶催化中心进行改进或重塑,将大大减少进化的路径(图1)。
组氨酸是酶催化中心使用频率最高的几个氨基酸之一,其侧链的咪唑基团作为一种关键的氨基酸残基广泛存在于各种酶催化过程中。不仅可以作为亲核基团参与水解酶的过程,同时还可以作为金属配位的位点调控金属中心的功能。在水解酶的催化三联体中,组氨酸由于其咪唑侧链独特的pKa值,使其可以接受丝氨酸提供的质子,使丝氨酸残基成为更强的亲核体,从而攻击底物肽键形成共价中间体。同时还可以作为质子的供体将质子转移给底物的氨基,完成底物的水解反应。此外,组氨酸的咪唑环能够与金属离子(如Zn2+、Fe2+、Cu2+等)形成配位键,这对于金属酶的功能调控至关重要。鉴于组氨酸在酶催化中心的普遍性,增强催化组氨酸的化学多样性已成为生物催化剂引入新特性的重要手段。通过调控组氨酸的化学结构,可以显著改变酶催化中心的化学多样性,从而有可能改善酶的功能。
天然氨基酸侧链的pKa可以覆盖3-12的范围,为蛋白质侧链的功能多样性提供了化学基础,但几乎所有的氨基酸侧链的pKa全部落在生理条件的pH范围(pH=5-9)之外,这也就意味着几乎所有的氨基酸侧链的带电状态和性质在生理pH范围下,都已经是确定的,例如赖氨酸会带正电,而天冬氨酸会带负电,这一性质不会随着生理pH的波动而变化。唯一pKa落在生理pH范围内的天然氨基酸是组氨酸,其侧链的pKa为7,也就是当生理条件的pH从6变化到8时,组氨酸侧链会从90%带正电,变为10%带正电,正是这一性质,使得酶的功能和蛋白质的性质可以响应这一pH范围的变化。
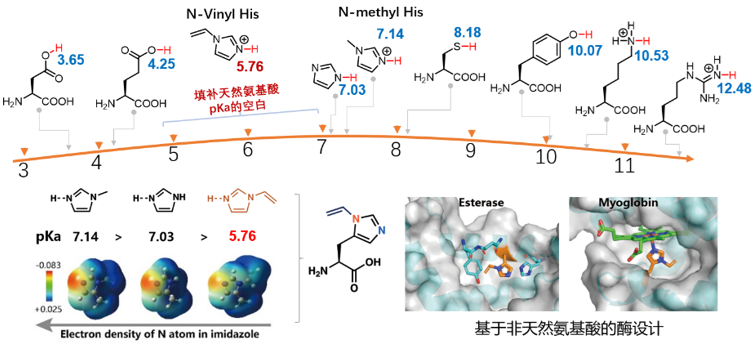
图2. Nδ乙烯基组氨酸的设计理念:从“离散化学”到“连续化学”
然而,在天然氨基酸的pKa覆盖的范围中,有一段是相对空白的区域:pH=4.5-7 (图2)。天然氨基酸侧链这一化学性质的缺失,意味着天然氨基酸构成的蛋白质功能还存在局限性,限制了蛋白质的功能改造。以水解酶为例,不论是酯酶还是蛋白酶,其催化中心的组氨酸,通常在肿瘤微环境、晚期内体、溶酶体等生理酸性条件下(pH=5-6)活性都较低,这是因为组氨酸侧链的pKa为7,在pH=5-6范围下,催化中心的组氨酸几乎都被质子化,亲核性较差,进而无法作为亲核中心发挥酶的正常功能。再比如,以血红素为催化中心的酶,组氨酸作为催化中心铁原子的轴向配体,负责调控铁原子的电性和催化性能,然而无论将轴向配体突变为何种天然氨基酸,其化学结构的改变都是跳跃式的,无法实现对催化中心铁原子的电子性质的微调,从而无法在不改变催化中心反应性质的基础上,调控其催化性能。
酶催化中心化学结构的精细调控,对基于天然氨基酸之间突变的传统定向进化来讲是难以实现的。基于这一挑战,作者提出了从“离散化学”到“连续化学”的设计理念,以实现对关键催化残基的特殊化学性质的连续可调。基于这一理念,作者设计了空间结构最小的乙烯基团,将乙烯基添加到组氨酸侧链咪唑δ位氮原子上(图1),得到一种全新的并且可以被遗传编码的组氨酸类似物-Nδ乙烯基组氨酸(δVin-H),它比天然组氨酸或甲基组氨酸(δMe-H)具有更缺电子的咪唑侧链,将组氨酸的Nε-氢的pKa从7.07调整到5.71,这一非天然氨基酸侧链的pKa填补了天然氨基酸侧链的pKa在4.5-7这一范围的“空白”。不仅如此,这一结构特殊为组氨酸提供了全新的电子性质,可以在酶催化口袋中创造出一个独特的催化中心,也为酶的催化中心的精细调控提供了新的化学结构。
δVin-H的合成与遗传编码
之后作者设计了一种δVin-H的合成路线用于高效制备δVin-H,并通过蛋白质的定向进化技术,作者筛选得到了一个识别δVin-H效率较高的吡咯赖氨酸-氨酰tRNA合成酶突变体,使得δVin-H插入蛋白的表达效率,接近野生型蛋白的表达水平。
具体来讲,受PylRS晶体结构的启发,作者选择了多个位点进行定点饱和突变文库的构建,之后通过双报告系统对该文库进行筛选,并鉴定出3个全新的PylRS突变体(hit#1-3)。作者进一步比较了hit#1、hit#2和hit#3对δVin-H的掺入效率,发现hit#3为效率最高的突变体。Hit#3可以将δVin-H高效插入GFP的190位置,其表达水平与GFP-WT相似(图3),即使在低浓度的δVin-H(0.1 mM)下,GFP-D190δVinH的表达水平也达到了GFP-WT的50%(图3)。
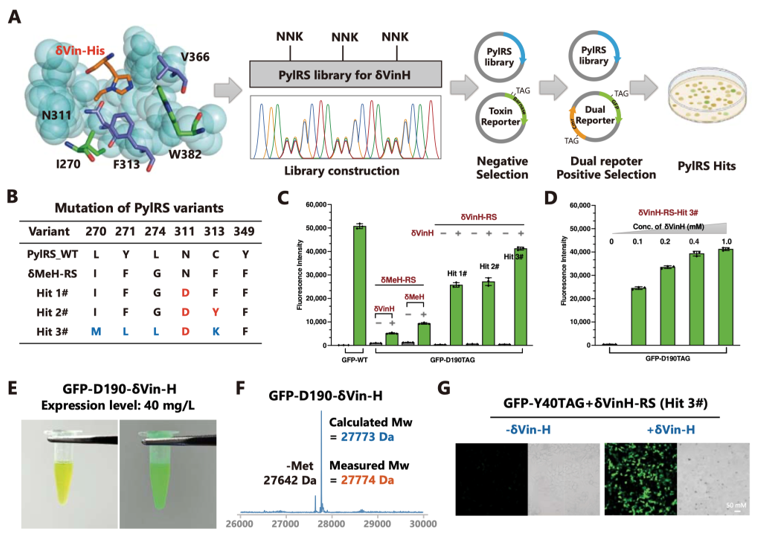
图3. 乙烯基组氨酸的遗传编码
通过δVin-H重塑酯酶OE1.3的催化中心
OE1.3是一种基于δMeH设计的人工酯水解酶,与催化三联体中的组氨酸不同,δMeH直接作为亲核试剂来进攻酯键。组氨酸的Nε作为亲核基团攻击酯基,速率控制步骤涉及酰基咪唑中间体的酰基释放。基于此机理,咪唑环的质子化百分比是决定亲核性和水解活性的关键因素。考虑到咪唑(pKa=7.04)、甲基咪唑(pKa=7.07)和乙烯基咪唑(pKa=5.71)的pKa值,作者预计在pH=5.5时催化中心的δVinH的质子化程度将远低于δMe-H和组氨酸,从而导致在这些生理相关的酸性条件下具有更强的亲核性和更高的水解活性(图4)。实验结果表明OE1.3中的δVin-H催化中心在pH=5.5时表现出最佳转化率和最快的水解反应速率,同时证明了δVin-H催化中心对酸性环境的耐受。
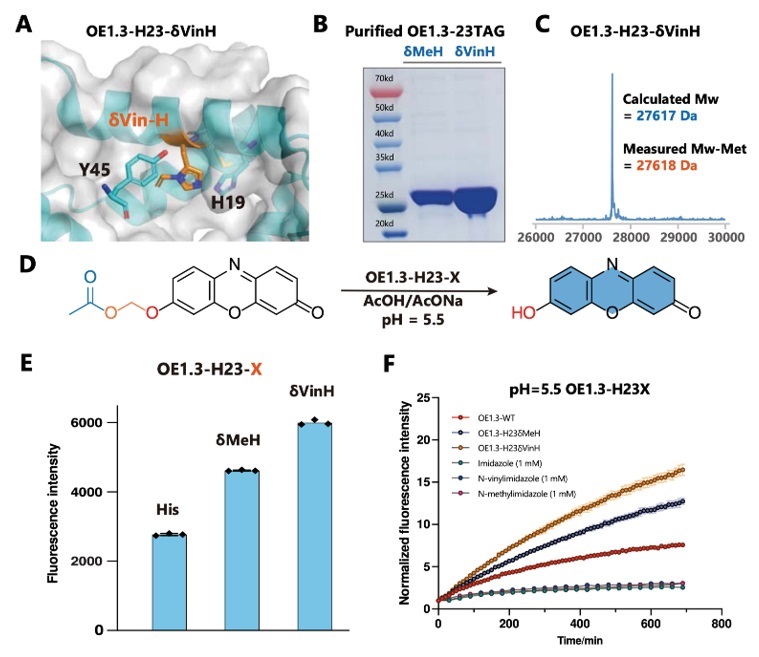
图4. 乙烯基组氨酸重塑酯酶OE1.3的催化中心
通过δVin-H重塑血红素依赖性蛋白的催化中心
血红素依赖性蛋白是一类非常大的金属酶,组氨酸可以作为轴向配体来固定和调节血红素催化中铁的电子性质。作者选择了四种不同的血红素依赖性蛋白质用于δVin-H的插入实验,包括全长P450-BM3-HStar-H400、过氧化物酶APEX2-H163、抹香鲸肌红蛋白Mb*-H93和计算机设计的血红素依赖性蛋白质dnHEM1.2-H149。通过SDS-PAGE和Western-blot表明,δVin-H对这四种蛋白质均表现出满意的插入效率(图5),证实了δVin-H在调节血红素依赖性蛋白质轴向配位方面的普遍适用性。
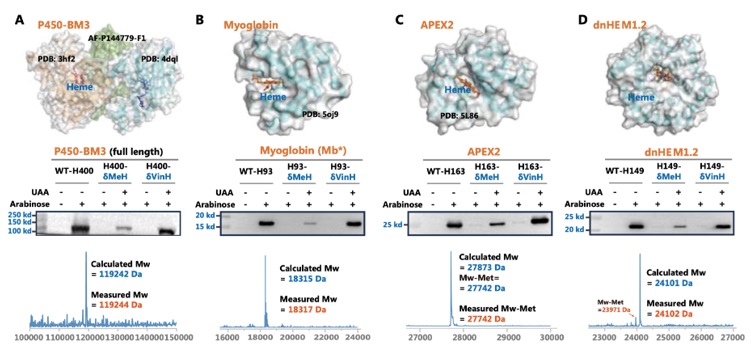
图5. 乙烯基组氨酸定点替换血红素依赖性代表的轴向配体
之后作者以肌红蛋白卡宾转移酶(Mb*)进行的进一步的研究。首先作者比较了纯化的Mb*-WT和Mb*-H93-δVinH的紫外可见(UV-Vis)光谱,发现这两种蛋白质在静息状态下表现出几乎相同的光谱特征 (图6B)。然而在加入还原剂 (连二亚硫酸钠) 后,Mb*-δVinH的还原峰明显高于Mb*-WT。另外,在进一步加入底物(EDA)后,Mb*-δVinH的还原峰显著下降,而Mb*-WT还原峰变化不大,这都表明在有氧条件下Mb*-δVinH催化中心的氧化还原循环,要比Mb*-WT更为有效,也预示了Mb*-δVinH更好的催化性能。
随后,作者在还原条件下采用了苯乙烯和重氮乙酸乙酯(EDA)的环丙烷化反应,以评估和比较Mb*-δVinH和Mb*-WT的催化性能。如图6C所示,在有氧条件下,以0.1%mol的酶进行烯烃环丙烷化反应的的测试,Mb*-δVinH催化苯乙烯环丙烷化产率达到80%,而Mb*-WT在相同条件下的产率仅为30%(图6C)。同时,在富电子苯乙烯底物中也观察到了类似的酶活性改善(图6D)
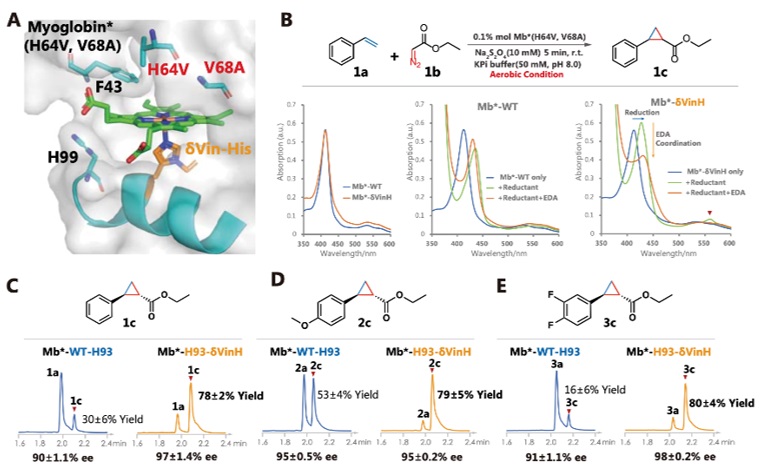
图6. 乙烯基组氨酸重塑肌红蛋白卡宾转移酶的催化中心
缺电子苯乙烯的环丙烷化反应一直都是酶催化领域的一个挑战,作者进一步探索了Mb*-δVinH针对2,3-二氟苯乙烯底物的反应活性,发现在有氧气的条件下进行环丙烷化反应,其转化率也有非常显著的提高(图6E)。以上发现均证明了δVin-H用于调节金属催化中心具有较大的潜力。
总之,作者发展了一种全新的可遗传编码的乙烯基组氨酸,用于酶催化中心的重塑。通过修改咪唑环的取代基,可以有效调整催化中心的性能,从而赋予生物催化剂新的特性。组氨酸类似物的持续开发将成为设计和增强人工酶活性的有力工具。扩大催化组氨酸的化学多样性,并探索其在各种酶系统中的应用,将为创造具有改进性能和新功能的定制生物催化剂开辟道路。
本文的通讯作者为南方科技大学化学系王杰副教授。南方科技大学化学系2020级硕士研究生黄浩然(现为北京大学博士研究生)、研究助理闫涛和南方科技大学化学系2023级硕士研究生刘畅为本文的共同第一作者,2021级硕士研究生陆宇翔以及武志刚博士、王兴初博士亦为本研究做出了贡献。该工作得到了国家自然科学基金委、科技部国家重点研发计划、北京分子科学国家研究中心、深圳市科创委、深圳市医学科院等项目的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Genetically encoded Nδ-vinyl histidine for the evolution of enzyme catalytic center
Haoran Huang, Tao Yan, Chang Liu, Yuxiang Lu, Zhigang Wu, Xingchu Wang & Jie Wang
Nat. Commun., 2024, 15, 5714, DOI: 10.1038/s41467-024-50005-9
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号