Nat. Synth.:解析trans-AT聚酮合成酶的特殊迭代作用
Trans-AT 聚酮合成酶可以合成大量结构特殊、活性多样的聚酮分子。这些酶中同时存在多种特殊模块或结构域,如β-分支模块、分支结构域和BV氧化结构域等,可在装配线上直接对延伸的聚酮骨架进行修饰并增加产物的结构多样性。然而,在trans-AT PKS的非经典催化过程中,单一模块或功能域的迭代使用过程尤为特殊。前期,科学家们发现在lankacindin类天然产物的生物合成过程中,仅含有四个trans-AT 聚酮合酶却负责八轮聚酮骨架的延伸,因此学术界长久以来认为该trans-AT PKS进行了特殊的迭代作用,并提出两种不同推测过程(图1)。
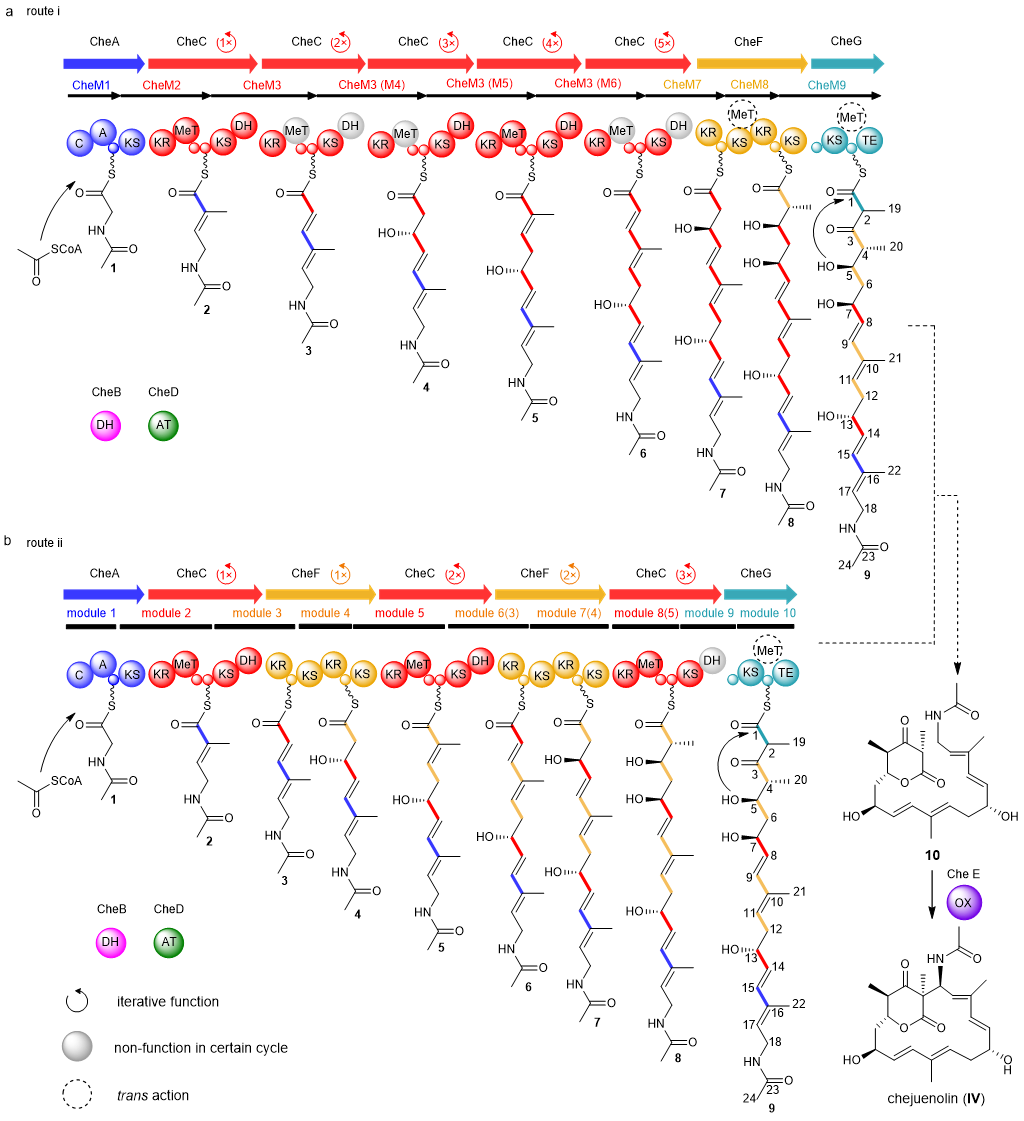
图1. Chejuenolin的推测生物合成过程。
近日,南京大学生命科学学院的研究团队在Nature Synthesis 杂志上发表研究论文,通过体内、体外重构阐明了trans-AT聚酮合成酶在lankacidin类天然产物生物合成中的特殊迭代作用。此外,他们还对trans-AT PKS中的跨模块作用的MT结构域、冗余的KS-ACP结构域等进行了功能表征。该研究团队还以经典I型聚酮的“模块化思维”对trans-AT聚酮合酶进行拆分和重构,并体外对新产生的“模块化trans-AT PKS”进行功能验证。最终他们成功地将全部trans-AT聚酮合酶进行融合,产生出~763 KDa的重组酶,并在大肠杆菌中实现了相应天然产物的生产,为trans-AT PKS的特殊迭代作用过程提供直接实验证据,并首次提出了衔接上下结构域的特殊迭代作用过程。
体外全生物合成chejuenolin
首先,该研究团队过表达并纯化了chejuenolin生物合成所需的所有蛋白,并进行了体外酶反应。在CheA-G存在的情况下,加入底物甘氨酸和必需辅因子,孵育后通过质谱检测到chejuenolin的产生。在不加入CheE后,发现可以检测到线上延伸后解链下来的中间体10。此外,研究团队发现,NRPS模块中的A结构域具有一定的底物宽泛性,可以直接利用N-乙酰甘氨酸为底物。
CheC蛋白迭代功能验证
为了验证CheC的迭代功能,同时也对两种推测的生物合成路径做出判断,该研究团队化学合成了硫酯中间体2b-7b,分别以2b-5b为底物与CheB-D蛋白进行体外酶反应,并通过碱水解,对潜在延伸的聚酮分子进行质谱检测。当以2b为底物时,可以检测到一轮和二轮延伸产物3a和4a;而以3b-5b为底物,均可以检测到相应的两轮延伸产物(图2a)。此外,6b为底物时无法检测到任何进一步延伸中间体。而在进一步添加CheF蛋白后,能够检测到进一步延伸中间体7a(图2a)。因此,CheC蛋白可进行五轮迭代作用,并验证了推测路径i的正确性。
为了进一步直接检测挂载在CheC蛋白上的中间体,该研究团队拆分了较大的CheC蛋白为三个“亚蛋白”,仍然以2b-5b分别作为底物,通过蛋白质谱对挂载在ACP上的中间体进行指认并利用极联质谱进行验证。通过以合成的相关化合物为标准品,研究团队以2b-5b为底物时,都成功检测到相应延伸一轮的聚酮中间体(图2b)。再次证明了CheC的特殊迭代作用。
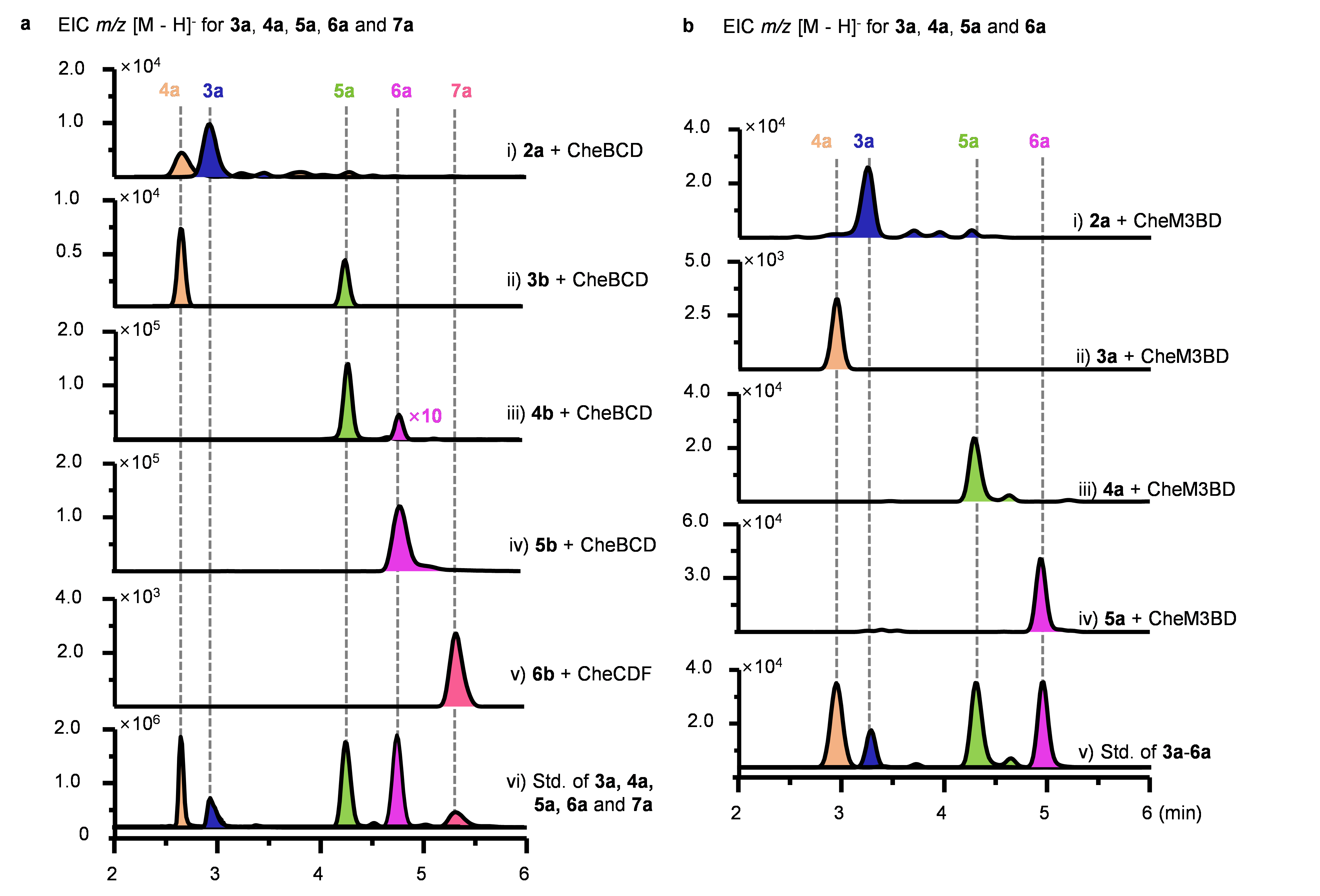

图2. CheC蛋白迭代功能验证。
CheC蛋白中MT的跨模块作用
Chejuenolide结构中存在着四个由MT结构域引入的甲基单元,但所有trans-PKS中仅CheC中存在着一个MT结构域。在路径i的生物合成过程中,C10和C16位的甲基化由CheC蛋白负责,但是C2和C4位的甲基化是否仍由CheC中的MeT功能域跨模块进行尚不清楚。研究团队通过将MT功能域单独表达并纯化后,通过体外实验证明,该MT结构域的加入能够产生出甲基化中间体8a,而不添加该MT结构域,则会检测到去甲基中间体8c。因此证明CheC中的MT同时跨模块甲基化作用。
模块9中冗余KS-ACP的协同作用
Chejuenolide 的生物合成途径中,中间体 8 仅需一轮延伸即可得到中间体 9,但模块 9 中存在两个串联的 KS-ACP 模块。研究通过点突变失活蛋白进行功能验证,结果表明任何一组 KS-ACP 存在都能满足 chejuenolide 的生物合成。
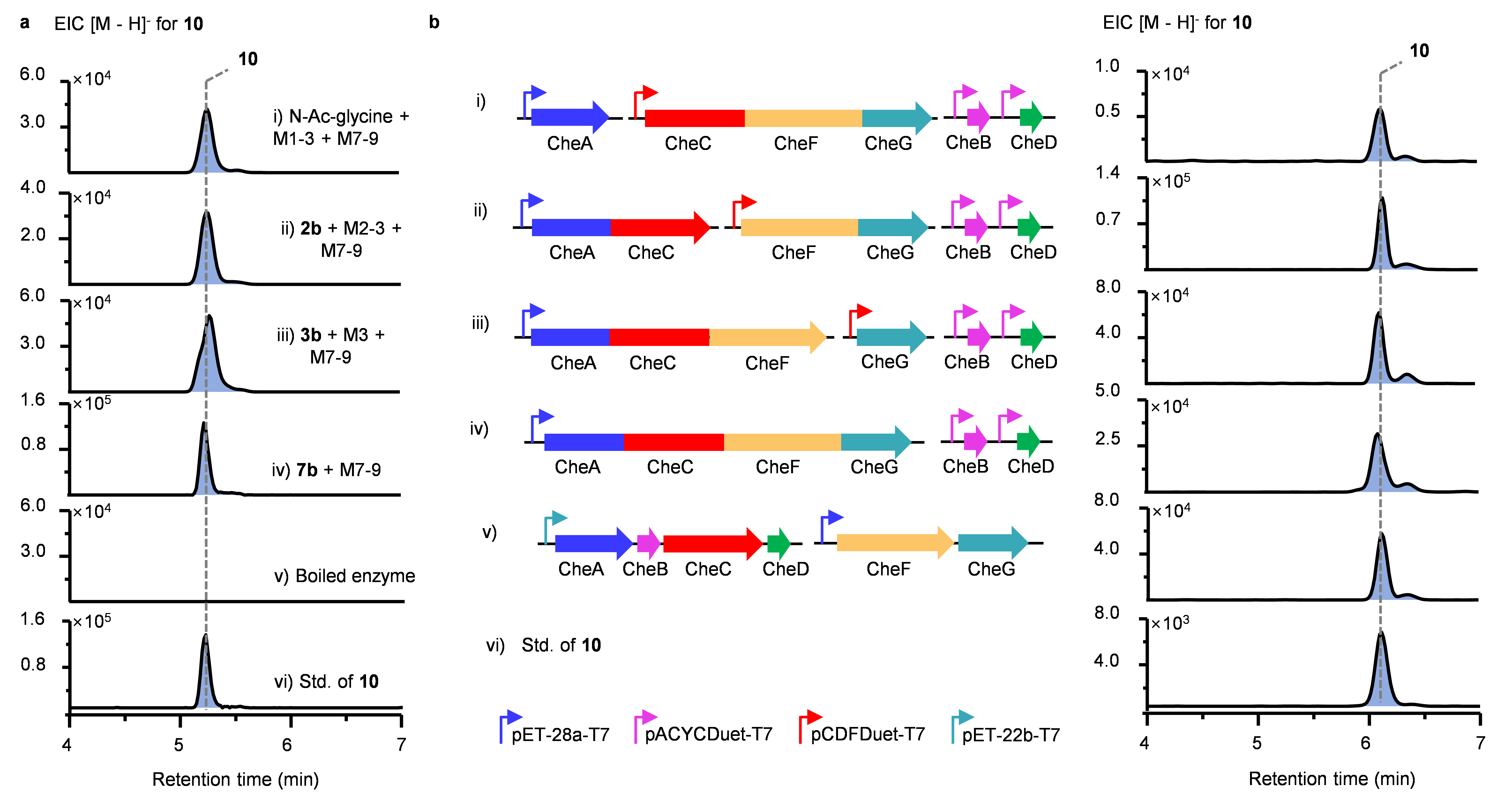
图3. LC-MS分析工程化的trans-AT PKS。
经典模块化思维对trans-AT PKS进行结构域重组
与经典的I型PKS模块组成“KS-AT-DH-MT-KR-ER-ACP”不同,CheA、CheC和CheF-G的功能域存在明显的模块拆分现象,为了验证这些NRPS和PKS是否按照经典模块化方式发挥作用,该研究团队对其重新工程化,产生了CheM1、CheM2、CheM3、CheM7-9共6个模块化蛋白。当以N-乙酰甘氨酸为起始底物,在CheB、CheD和辅因子的参与下,这些重新工程的模块蛋白成功的产生了10。当以2b、3b和7b为底物,与相应的重组模块蛋白反应时,也同样能检测到10(图3a)。以上结果表明,人工重组的模块蛋白仍具有功能。此外,对于CheM3的迭代功能也进行了验证,当以2b-5b为底物时,分别可以检测到延伸一轮的聚酮中间体,说明改造的CheM3模块化蛋白同样具有多次延伸功能。
Trans-AT PKS的蛋白质融合
在明确了各个模块化trans-AT PKS能够发挥功能后,该研究团队进一步对所有trans-AT PKS进行了蛋白质融合。经过多轮融合与分析后,他们成功将CheA+C+F+G融合,最终形成了~763 KDa巨型融合蛋白,并在大肠杆菌中成功验证其功能(图3b)。至此,提出单一的CheC的特殊催化过程,其既能与上游蛋白形成CheM2,与下游蛋白形成CheM7进行常规线性延伸,此外,其自身能以环形结构形成CheM3,发挥迭代作用,实现聚酮骨架的多轮延伸(图4)。
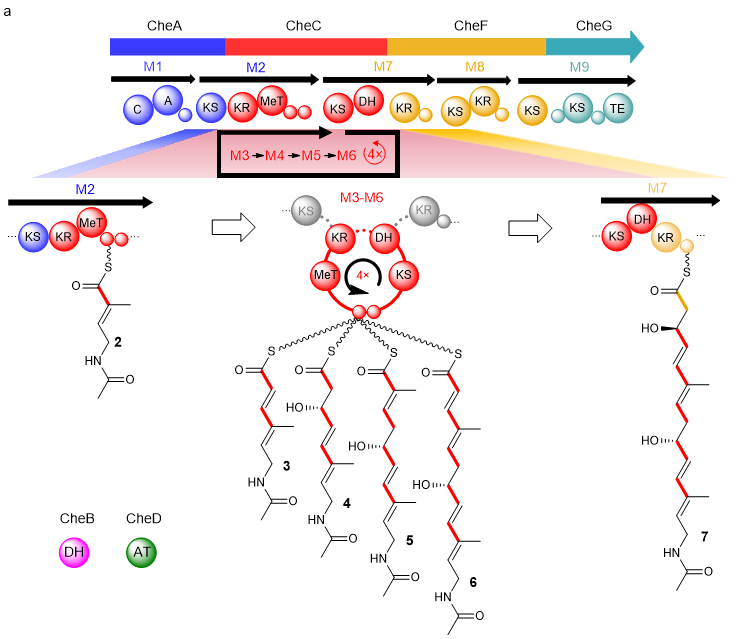
图4. CheC的特殊作用方式。
综上,南京大学生命科学学院的研究团队通过体内外实验,成功重构了完整的chejuenolide的生物合成途径,并为CheC的迭代作用提供了直接的实验证据。大量系统性分析工作,验证了CheC的特殊作用方式和过程,进一步揭示了trans-AT PKS独特的化学和酶学特征,为人工PKS蛋白的合理设计提供了有价值的见解。
南京大学生命科学学院博士后麦振鹏为论文第一作者,南京大学生命科学学院张博副教授、谭仁祥教授和戈惠明教授为该工作的通讯作者。此外,南京大学化学化工学院姚祝军教授对该工作给予了大力支持和指导。该研究得到了国家重点研发计划、国家自然基金及中央高校基本科研业务费等项目的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Insight into the role of a trans-AT polyketide synthase in the biosynthesis of lankacidin-type natural products
Zhen Peng Mai, Bo Zhang, Zi Xuan Pang, Jing Shi, Zi Fei Xu, Bing-Bing Huang, Shi Ying Ma, Rui Hua Jiao, Zhu-Jun Yao, Ren Xiang Tan & Hui Ming Ge
Nat. Synth., 2024, DOI: 10.1038/s44160-024-00599-1
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号