中国海洋大学李德海组JACS:NLRP3炎症小体抑制剂sorbremnoids 的发现和生物合成
注:文末有研究团队简介及本文作者科研思路分析
近日,中国海洋大学医药学院李德海(点击查看介绍)团队在Journal of the American Chemical Society 发表了研究论文,他们从真菌中挖掘了一类新颖NLRP3炎症小体抑制剂sorbremnoids并解析了其生物合成。其中,sorbremnoid A通过直接靶向于NLRP3蛋白,发挥抑制NLRP3炎症小体组装和激活的强效作用,并在糖尿病小鼠难愈性伤口愈合模型中表现出良好的促进伤口愈合的效果。
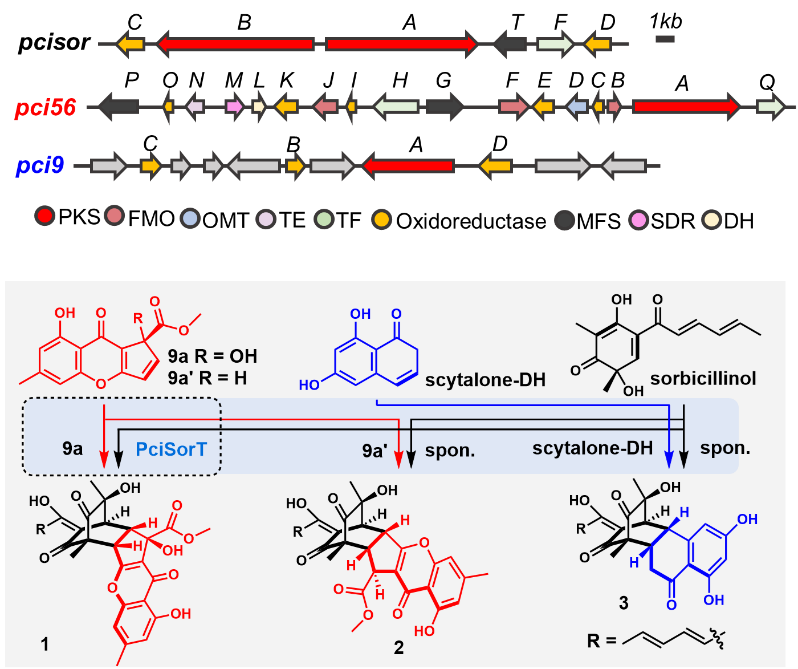
图1. 多条基因簇串扰生成杂合新骨架天然产物
NLRP3炎症小体(NOD-like receptor protein 3 inflammasome)是多种疾病病理性炎症的关键介质,其抑制剂的开发为帕金森病、阿尔茨海默病及糖尿病伤口愈合等疾病治疗提供了新策略。目前尚无NLRP3炎症小体的小分子抑制剂上市,而进入临床研究的多为MCC950类似物,存在骨架单一、结构同质化严重的问题。因此寻找结构新颖、高效的NLRP3炎症小体抑制剂具有重要意义。
李德海课题组通过多种组合手段有效激活了一株青霉菌Penicillium citrinum HDN11-186中的沉默基因簇,发现了三个具有新颖骨架的杂合天然产物:sorbremnoid A(1)、sorbremnoid B(2)和sorbtalone(3)(图1)。在化合物1-3的生物合成过程中,三条完全独立的基因簇分别合成高度活泼的单体分子9a/b、scytalone-DH和sorbicillinol,随后MFS样转运超家族蛋白PciSorT对9a和sorbicillinol进行富集,并通过区域和立体选择性的分子间Diels-Alder(DA)环化生成杂合二聚体1。化合物2和3则是9b和scytalone-DH作为亲双烯体与sorbicillinol发生符合热力学偏好的自发DA环化反应的产物(图1)。
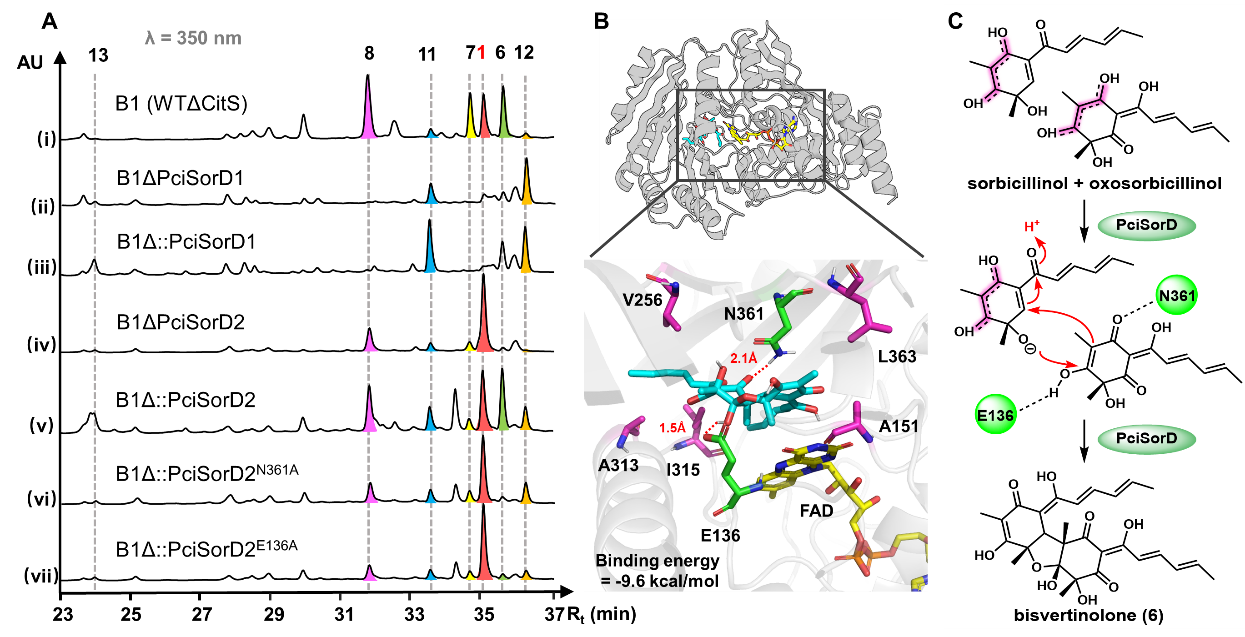
图2. PciSorD的功能验证
此外,研究人员通过对基因簇pcisor中编码SorD同源蛋白的基因pcisorD进行敲除、回补、分子对接和点突变,证实PciSorD参与了sorbicillinol与oxosorbicillinol的迈克尔加成反应,其中E136和N361在控制反应的区域选择性和烯醇式结构稳定方面发挥了关键作用(图2)。研究人员随后通过基因敲除、回补和计算化学实验,证明9a可能由FAD依赖型单加氧酶Pci56F催化11的C环开环脱羧生成(图3)。并通过计算化学,以及对基因簇pcisor中编码StaE同源蛋白的PciSorT的敲除和细胞内外代谢产物差异分析,最终证实1的合成由MFS样转运超家族蛋白PciSorT负责,并提出了细胞水平上这一系列二聚体在空间范围内的生物合成过程(图4)。
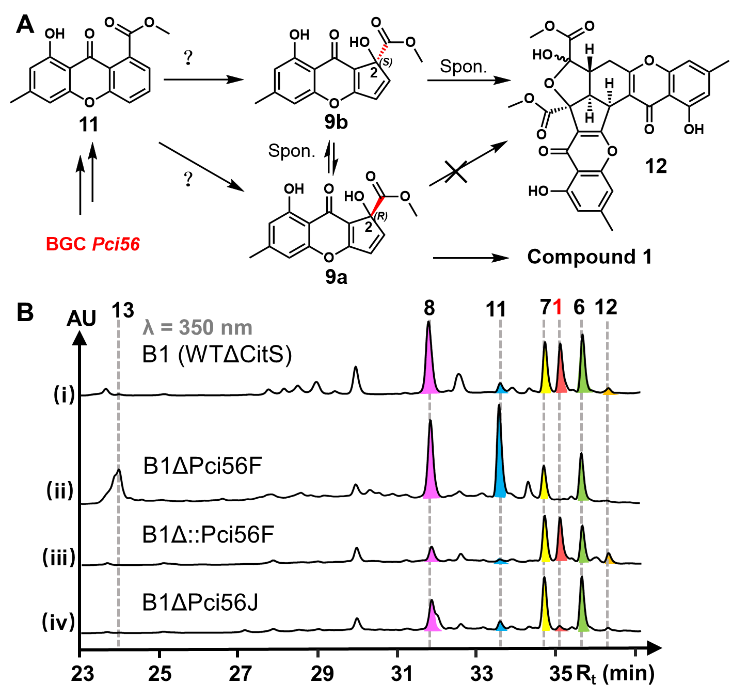
图3. 化合物11潜在的缩环反应与二聚化
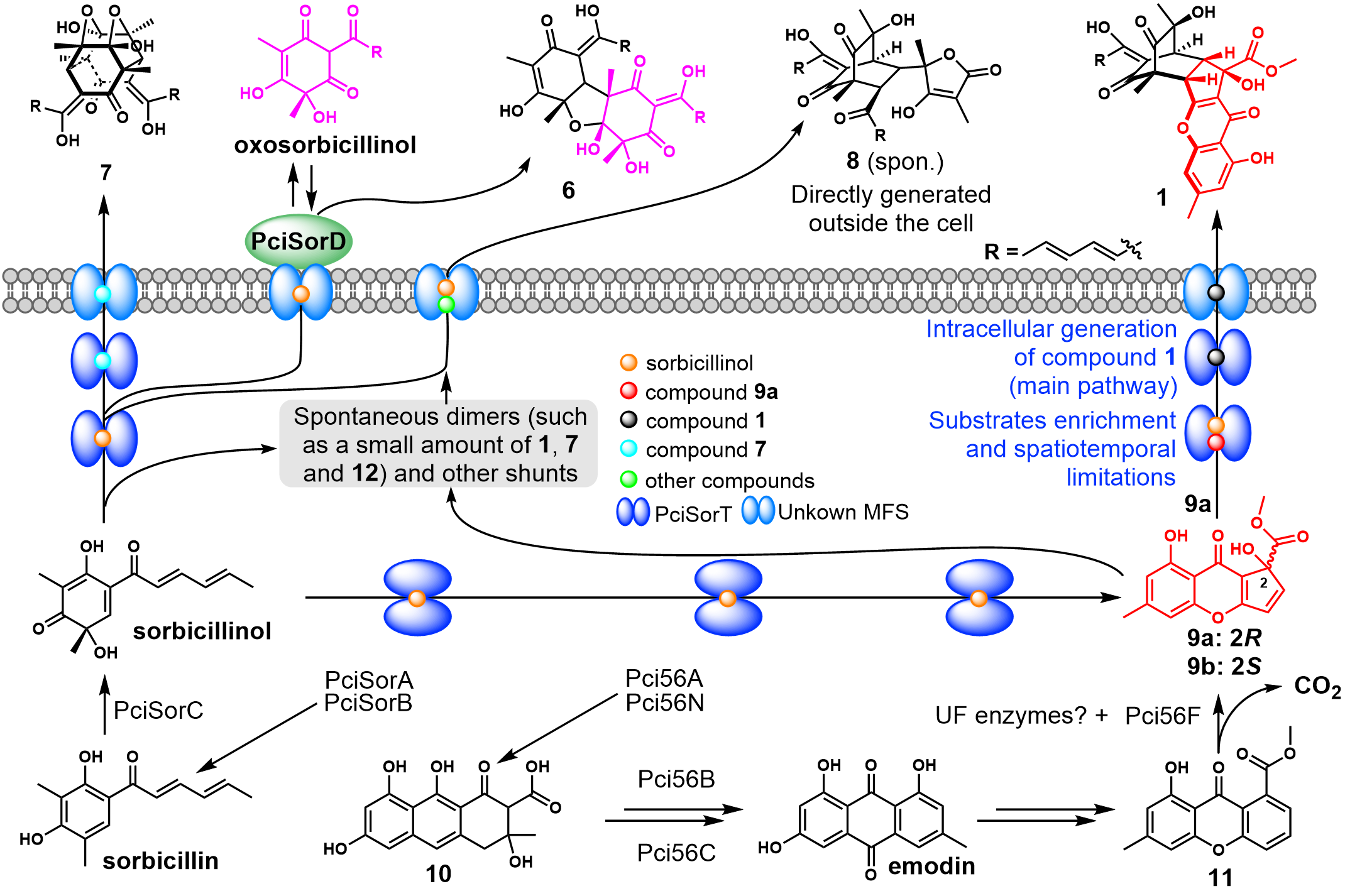
图4. 通过独立基因簇功能串扰的空间限制性生物合成途径
在随后的生物活性研究中发现,化合物1-3表现出剂量依赖性地抑制LPS/ATP诱导的炎症因子IL-1β的释放,IC50值分别为2.11、2.40和18.95 μM。化合物1为特异性的NLRP3炎症小体抑制剂,对其他炎症小体NLRC4和AIM2均无抑制作用。进一步研究表明,化合物1不抑制NF-𝛋B通路,而是通过直接靶向NLRP3蛋白,抑制NLRP3炎症小体的组装和活化发挥抗炎活性,其与NLRP3蛋白结合的KD值为15.57 μM。在糖尿病小鼠难愈性伤口愈合模型中,化合物1显著加速了难愈性伤口的愈合,表明其具有潜在的临床应用价值。
中国海洋大学为第一通讯单位,李德海教授为通讯作者,医药学院博士研究生张开金、硕士研究生刘峻妤以及江余祺副教授为并列第一作者。该工作得到国家自然科学基金、青岛海洋科技中心科技创新项目、山东省泰山学者青年专家项目、山东省自然科学基金重大基础研究项目和国家留学基金委的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Sorbremnoids A and B: NLRP3 Inflammasome Inhibitors Discovered from Spatially Restricted Crosstalk of Biosynthetic Pathways
Kaijin Zhang, Junyu Liu, Yuqi Jiang, Simin Sun, Rongrong Wang, Jingxian Sun, Chuanteng Ma, Yinghan Chen, Wenxue Wang, Xuewen Hou, Tianjiao Zhu, Guojian Zhang, Qian Che, Robert A. Keyzers, Ming Liu, and Dehai Li*
J. Am. Chem. Soc., 2024, 146, 18172–18183, DOI: 10.1021/jacs.4c06538
李德海教授简介

李德海,男,博士,教授,博导,医药学院副院长。国际期刊Curr. Org. Chem、The Natural Products Journal、Lett. Org. Chem.编辑;应用海洋学学报(中文核心期刊)第六届编委会委员。主要从事海洋天然药物化学研究,致力于利用化学和生物学手段从海洋微生物中发现具有潜在药用价值的活性成分。近年来在J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Adv. Sci.、Curr. Opin. Biotech.、J. Med. Chem.、Org. Lett.、J. Org. Chem.、J. Nat. Prod. 等发表SCI收录论文140余篇(第一或通讯作者90余篇)。个人H指数50,i10指数153(GoogleScholar数据);已授权专利9项。主持承担国家自然科学基金、山东省、教育部等二十余个项目。
https://www.x-mol.com/university/faculty/75614
科研思路分析
Q:这项研究最初是什么目的?或者说想法是怎么产生的?
A:橘青霉是自然界最常见的丝状真菌之一,我们课题组在多年的菌株分离过程中,积累了大量的微生物资源,其中就有数量众多的橘青霉。虽然来源不同,但它们大部分都具有一个共同特点,即除了主产物橘霉素及其衍生物之外,其他次级代谢产物种类很少或者产量极低。因此本着对其次级代谢潜力进行激活的目的,采取了敲除主产物代谢途径,以及过表达调控因子和初级代谢重要基因的手段,改善了其代谢通路,最终也是成功分离得到了新骨架产物。我们对产物进行了虚拟筛选,发现我们的化合物可以与NLRP3炎症小体蛋白有十分良好的结合,因此专门针对其进行了活性部分的研究。
Q:研究过程中遇到哪些挑战??
A:橘青霉的生长十分野蛮,其孢子量大,进行基因操作面临很大的污染压力,我们的敲除实验几乎每一步都重复了5次以上,尤其是对PciSorT的敲除,重复了将近20遍!这个蛋白对于减轻菌株的代谢压力有很重要的作用,对其敲除后,纯的突变株最多仅可以传代3次,便不再生长。因此,我们需要每次都重新进行敲除来验证其代谢产物,并需要克服巨大的污染挑战。当然,也正是因此,我们没法对该蛋白进行进一步的探究,所以我们仅仅是推测其具有“介导”环化的功能,而不敢定论其具有“催化”功能。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号