可肾清除金纳米颗粒在肝脏内的生物转化机制及其通过尿液法实现肝脏谷胱甘肽水平的无创定量检测研究
为了有效的评估纳米材料的生物效应和安全性,自纳米医学发展以来,人们便致力于研究纳米材料与生物体各器官的界面作用。其中,大多数纳米材料尺寸较大 (>6 nm),血清蛋白结合率高,则易被肝脏捕获并由肝胆系统清除至体外。相对的,具有超小尺寸 (< 6 nm) 且血清蛋白结合率低的纳米材料,可通过肾脏代谢,随尿液清除至体外,这减少了纳米材料在体内的蓄积,其具有更高的生物安全性,因此备受关注。近年来,学者们深度剖析了可肾清除纳米颗粒在肾脏中的相互作用及转运机制。但肝脏作为人体最大的解毒器官,是否影响可肾清除纳米颗粒的转运以及是否与其发生相互作用?仍然是一个未知的问题。
在肝脏中,肝实质细胞合成谷胱甘肽 (GSH) 并外流至肝窦周系。肝脏 GSH 在各种生物转化以及外源物质的解毒等方面都发挥着至关重要的作用。近日,华南理工大学附属第二医院杜步婕研究员(点击查看介绍)课题组和华南理工大学生物医学与科学工程学院蒋兴垭教授(点击查看介绍)团队合作,以可肾清除的 IRDye800CW 共轭的金纳米团簇 (800CW4-GS18-Au25) 为模型展开了研究,他们经研究发现,虽然可经肾清除的 800CW4-GS18-Au25 有着很低的血清蛋白结合率,在肝脏中的蓄积也很少,但其表面配体在通过肝脏时仍会逐渐被肝脏 GSH 介导的生物转化所改变。此外,他们还观察到了尿液中生物转化指数 (UBI) 与肝脏 GSH 之间的线性相关性,这使得 800CW4-GS18-Au25可以作为一种人工尿液生物标志物来定量检测肝脏 GSH 水平(图1)。
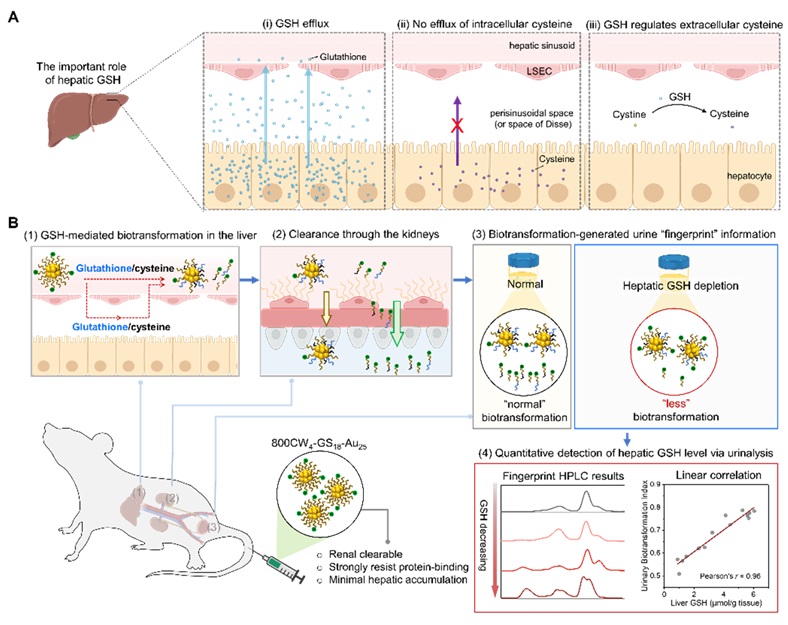
图1. 肝脏谷胱甘肽介导的生物转化对 800CW4-GS18-Au25 体内转运的影响及其通过尿液法实现肝脏谷胱甘肽水平的无创定量检测。
在该研究中,作者以原子精确级的金纳米团簇 Au25SG18 为核心与可肾清除染料 IRDye@800CW 进行偶联,得到了具有近红外发光的可肾清除纳米探针 800CW4-GS18-Au25,该探针具有良好的 GSH 响应能力,GSH 与 Au-S 键的化学反应可以使探针发生相应的光学变化,以便观察其在体内的生物转化及转运行为 (图2)。
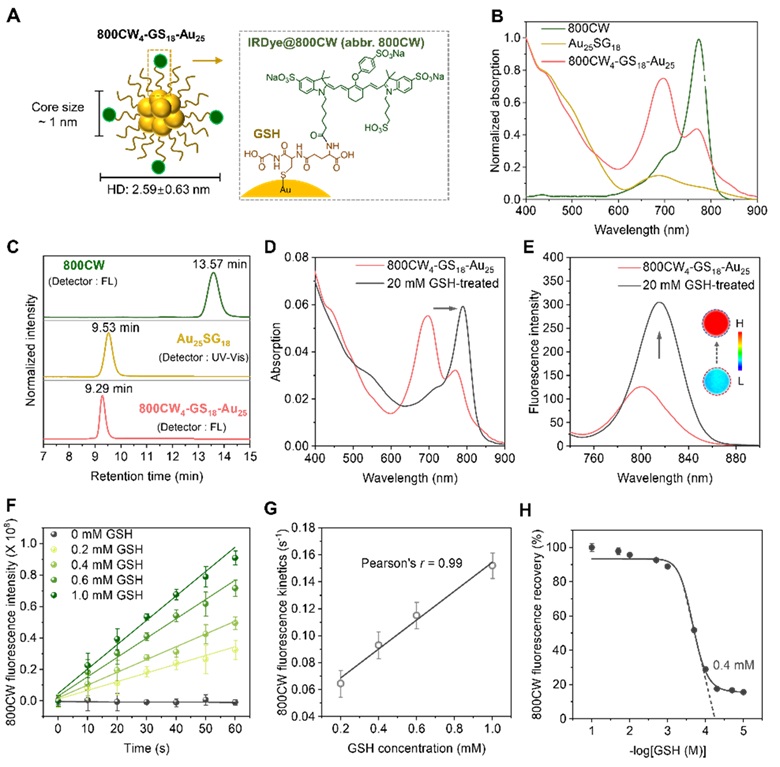
图2. 800CW4-GS18-Au25 的表征及对 GSH 的响应能力。
紧接着,作者对 800CW4-GS18-Au25 在体内进行了活体成像、生物分布、可肾清除率以及药代动力学的研究,发现该探针在未进入肾脏之前就已经发生了生物转化,且该转化并不是瞬间发生的,而是随着给药逐渐发生的 (图3)。
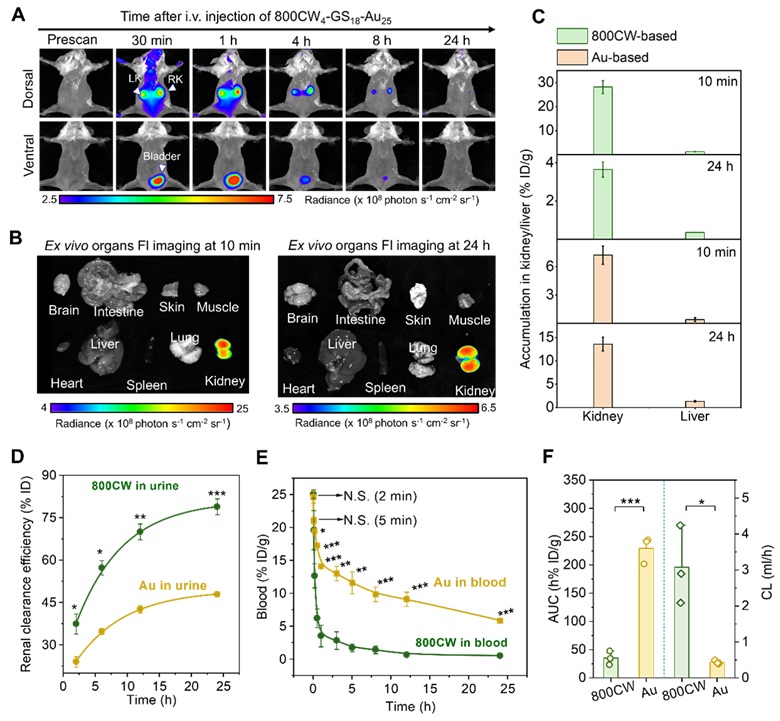
图3. 800CW4-GS18-Au25 的体内转运和生物转化。
为了确定探针生物转化的发生条件和转化场所,作者通过马来酸二乙酯 (DEM) 抑制肝脏 GSH 的产生(图4)及其小鼠肝脏血管结扎模型(图5),深入探究了肝脏谷胱甘肽对可肾清除金纳米颗粒体内生物转化的重要影响。确定了800CW4-GS18-Au25 是在肝脏由肝脏 GSH 介导发生了生物转化。
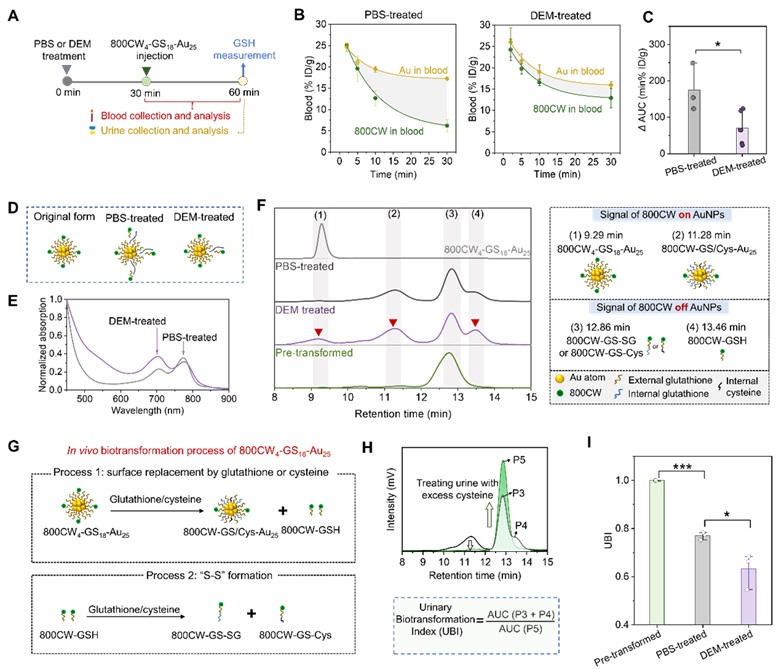
图4. 肝脏 GSH 介导 800CW4-GS18-Au25 的体内生物转化。
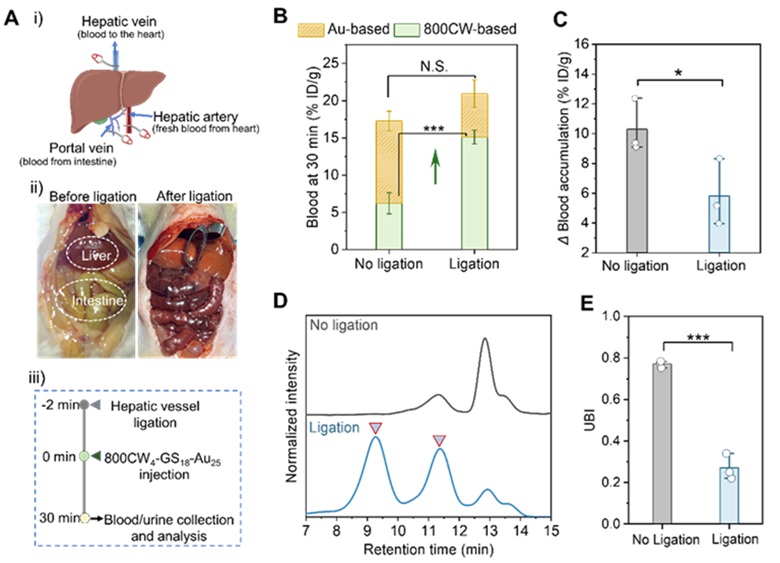
图5. 肝脏主导的 800CW4-GS18-Au25 的体内生物转化。
基于 800CW4-GS18-Au25 对肝脏 GSH 的响应性及其可肾清除的能力,其可作为一种人工尿液生物标志物,通过尿液高效液相色谱分析,在活体水平上实现肝脏GSH的无创定量评估,并实现了药物肝损伤的早期检测(图6)。
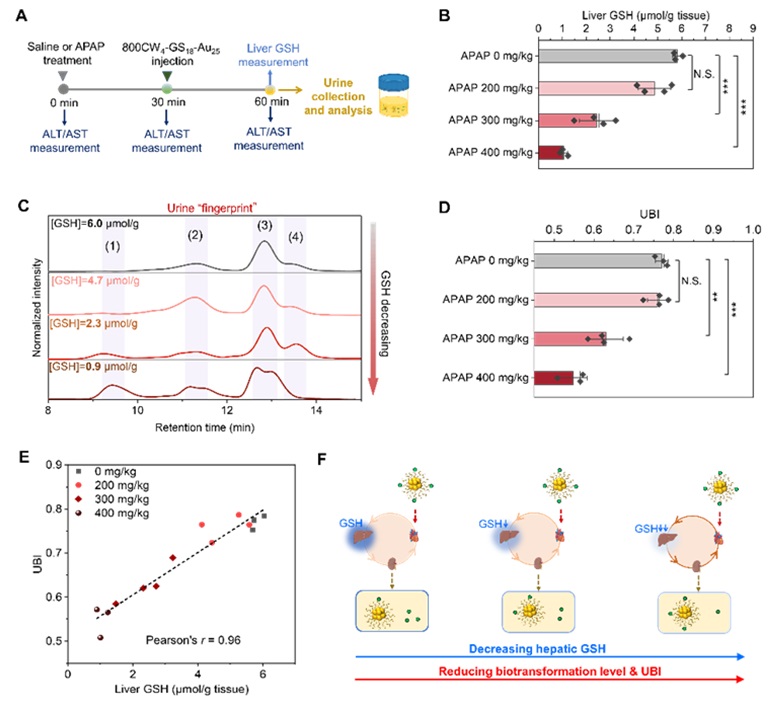
图6. 800CW4-GS18-Au25 无创尿液检测肝脏谷胱甘肽水平。
据文献调研,这是首例用尿液法实现对肝脏 GSH 远程无创定量评估的研究。此外,该工作的机制探究拓宽了人们对纳米颗粒体内转运的深入认知,有望推动疾病生物检测纳米探针的未来发展。
这一成果近期发表在国际权威期刊 Angew. Chem. Int. Ed.上。杜步婕课题组博士生祁禹鸣同学为该论文的第一作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Hepatic Biotransformation of Renal Clearable Gold Nanoparticles for Noninvasive Detection of Liver Glutathione Level via Urinalysis
Yuming Qi, Mingze Xu, Huixu Lu, Xiaoxian Wang, Yexi Peng, Ziyuan Wang, Fengying Liang, Xiangya Jiang* and Bujie Du*
Angew. Chem. Int. Ed., 2024, DOI: 10.1002/anie.202409477
杜步婕博士简介

杜步婕,研究员,华南理工大学学术教授,博士生导师。2014年于北京理工大学应用化学专业获得理学学士学位;2019年于美国德克萨斯大学达拉斯分校化学与生物化学系获得博士学位,导师为Jie Zheng教授;同年10月进入美国麻省理工学院Koch综合癌症研究所开展博士后研究,合作导师为Robert Langer教授。2021年12月加入华南理工大学附属第二医院(广州市第一人民医院),任特聘研究员。杜步婕博士长期致力于研究可肾清除纳米材料与生物体的界面作用并基于此实现疾病早期诊断和治疗等应用,至今以第一作/通讯作者身份在Nature Nanotechnology、Nature Reviews Materials、Angewandte Chemie International Edition、ACS Nano等杂志发表多篇论文,目前作为项目负责人主持国家级高层次人才青年项目、国家重点研发计划青年科学家项目和国家自然科学基金面上等项目。
https://www.x-mol.com/groups/du_bujie
蒋兴垭博士简介

蒋兴垭,华南理工大学教授,博士生导师。2014年于北京理工大学获得应用化学学士学位,2019年于美国德克萨斯大学达拉斯分校获得化学博士学位,2019-2021年在美国哈佛大学医学院进行博士后工作,2021年底加入华南理工大学生物医学科学与工程学院/国家人体组织功能重建工程技术研究中心从事教学科研工作。主要研究纳米材料和纳米药物与活体的界面相互作用机制及生物学效应,主要关注金属纳米粒子与肝脏、肾脏和肿瘤等器官组织的相互作用及其体内转运和代谢清除过程,以促进对相关纳米材料与体内复杂生理环境相互作用的基础认知,并设计和开发新型纳米药物用于疾病诊疗。研究成果以通讯/第一作者发表于Nature Nanotechnology、Science Advances、Angew. Chem. Int. Ed.、ACS Nano、Nano Today 等国际知名学术期刊。著有专著2章,申请中国、美国发明专利5项,已授权1项。主持和参与国家级青年人才项目、国家自然科学基金面上项目、国家重点研发计划等科研项目。
https://www.x-mol.com/groups/ultranano
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!

















































 京公网安备 11010802027423号
京公网安备 11010802027423号