唐奕团队Nature:新型SAM依赖酶LepI,天然产物生物合成中催化周环反应
周环反应是一类在反应过程中能形成环状过渡态的协同反应,在有机合成中有着广泛的应用。尤其是其中的环加成反应,在天然产物的全合成中经常被用来构建复杂的多环骨架结构,并同时在产物结构中一次性引入多个手性中心。在天然产物的生物合成研究中,周环反应也经常被推测包含在许多化合物的生物合成途径中。然而到目前为止,被报道证实的可以催化此类反应的酶却只有屈指可数的几例。相比有机合成中的催化剂,生物合成中的酶往往具有更高的立体专一性和催化效率。未来,在天然产物和具有生理活性的小分子的合成中,生物催化将会发挥越来越重要的作用。因此,基于周环反应的重要性,在天然产物生物合成研究中发现并证实具有催化此类反应功能的新型酶催化剂将具有重大意义。
最近,美国加州大学洛杉矶分校(UCLA)的唐奕(Yi Tang)教授(点击查看介绍)课题组在研究真菌次级代谢产物Leporin B的生物合成过程中,发现并证实了一种S-腺苷甲硫氨酸(SAM)依赖的多功能酶LepI,既能催化杂Diels-Alder反应,又能催化retro-Claisen重排。

唐奕教授。图片来源:UCLA
该课题组在研究过程中发现,化合物4(图1)是Leporin B生物合成途径中的一个关键中间体。在没有LepI存在下,该化合物可以自发脱水形成(E )-5和(Z )-5,并进一步可以自发发生分子内Diels-Alder反应(IMDA)或杂Diels-Alder反应(HDA)从而生成一系列的环加成反应产物(图1)。例如,(E )-5在自发条件下,既可以发生Diels-Alder反应形成化合物6,也可以发生杂Diels-Alder反应形成Leporin C(2)。而在LepI的催化下,化合物4专一性的脱水形成(E )-5,并进一步发生杂Diels-Alder反应形成单一产物Leporin C,从而证实LepI是一种可以催化分子内杂Diels-Alder反应的酶。Leporin C可以进一步在单加氧酶LepD的催化下发生氧化而被转化成Leporin B(1),从而完成Leporin B的生物合成。
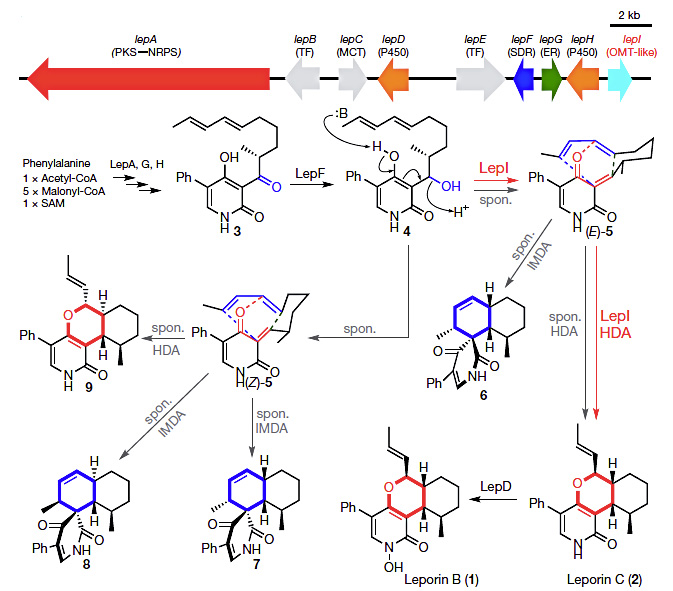
图1. Leporin B生物合成的基因簇和生物合成途径(Spon.: 自发发生的)。图片来源:Nature
进一步研究发现,LepI还可以将6转化成2,这是一个retro-Claisen重排反应(图2)。值得一提的是,LepI是第一个被报道的可以催化retro-Claisen重排反应的酶。
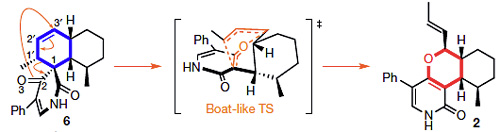
图2. LepI催化的retro-Claisen重排。图片来源:Nature
在确证LepI功能的基础上,该课题组对辅因子SAM在酶促反应中的作用机制也进行了相应探究。研究表明,SAM的结构类似物SAH和Sinefungin可以对LepI的功能进行竞争性抑制(图3),从而证实SAM所带的正电荷在LepI所催化的反应中起关键作用。
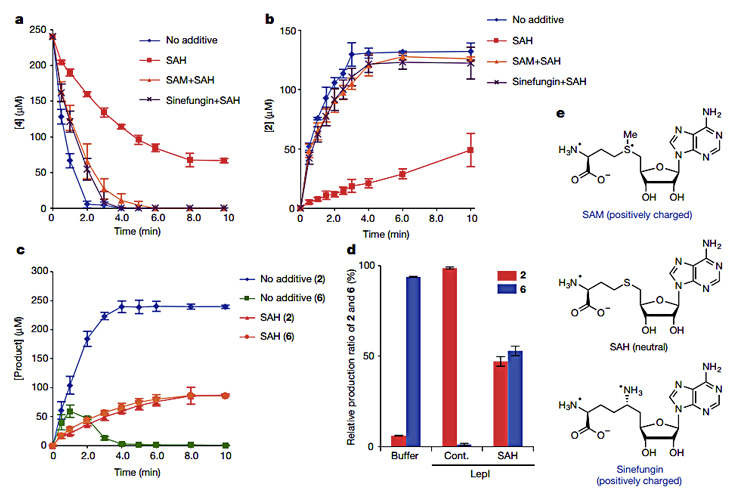
图3. SAM在LepI酶促反应中的作用机制研究。图片来源:Nature
为了深入理解LepI催化的机理,该课题组和专长于计算的Ken Houk教授课题组进行了合作,对反应历程进行了密度泛函理论(DFT)计算(图4)。理论计算结果表明:第一,(E )-5到2所需的活化能比(Z )-5的低,而且(E )-5发生分子内Diels-Alder和杂Diels-Alder反应的过渡态是一样的,这个过渡态TS-1表现在势能面中,就是一个分叉的鞍点;第二,在没有酶催化的情况下,TS-1中碳碳键的距离比碳氧键的近,这对分子内Diels-Alder反应来说是有利的,半经典分子动力学的模拟与之相符;第三,以三甲基锍离子代替带正电的SAM,通过静电作用,可以拉近TS-1中的碳与氧的距离,同时拉长碳碳键,从而使杂Diels-Alder反应发生的倾向更大。所以,在有LepI存在下的势能面,TS-1倾向于向杂Diels-Alder反应的方向发展。另外,使用锍鎓离子或铵根离子来模拟LepI对TS-2的作用,发现能垒降低了2.4或3.4 kcal·mol-1。
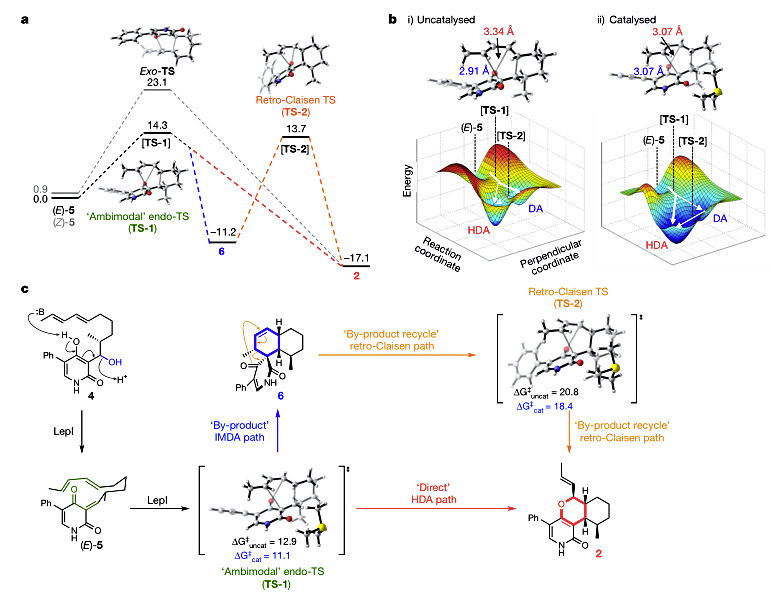
图4. 运用计算化学的方法阐释LepI的催化机制。图片来源:Nature
——小结——
目前,科研工作者们只发现了少数可以催化周环反应的酶,而其中催化retro-Claisen重排的酶更是从来没有被报道过。令人意外的是,LepI作为氧甲基转移酶的同源蛋白,不仅可以催化杂Diels-Alder反应,还可以催化retro-Claisen重排反应。因此该工作不仅拓展了我们对SAM依赖酶的功能认知,也让我们对SAM的作用有了新的认识,同时也预示着SAM及依赖SAM的酶在生物新陈代谢中还有更多新的作用和功能等着科学家去发现和探索。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

SAM-dependent enzyme-catalysed pericyclic reactions in natural product biosynthesis.
Nature, 2017, DOI: 10.1038/nature23882
导师介绍
唐奕
http://www.x-mol.com/university/faculty/873
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号