JACS:催化剂调控的双环[1.1.0]丁烷与α-烯叠氮化物的环化反应合成氮杂双环[3.1.1]庚烯
近年来,在“逃离平面”药物设计概念的引导下,笼状小分子例如双环[1.1.1]戊烷 (BCP),双环[2.1.1]己烷 (BCH) 和双环[3.1.1]庚烷 (BCHep) 被用作苯环的3D生物电子等排体,在提高候选药物的理化性质方面有着重要的应用。同时,吡啶是FDA批准药物中第二常见的氮杂环,目前已知有7000种以上的生物活性分子和10%的上市药物都含有吡啶结构。然而,这种生物电子等排策略应用于吡啶生物电子等排体的探索鲜有报道。2023年,Mykhailiuk课题组开发一类吡啶的3D生物电子等排体—氮杂双环[3.1.1]庚烷 (3-aza-BCHep),其修饰的药物分子卢帕他定类似物与母体药物相比具有更好的理化性质和代谢稳定性(图1a)。由于吡啶结构中的sp2杂化氮原子含有非共轭的孤对电子,以及C=N双键上具有π电子,这些结构特征影响着碱性以及与目标蛋白分子之间的结合能力,氮原子的杂化态是探索吡啶的生物电子等排体的重要考量。从这些方面考虑,含有sp2杂化氮原子的双环[3.1.1]庚烯结构 (aza-BCHepes) 可以更好地模拟吡啶。然而由于结构的刚性以及亚胺的稳定性等因素,合成含有sp2杂化氮原子的氮杂双环[3.1.1]庚烯骨架是具有挑战的,目前尚无这类结构的合成报道。因此,开发高效的催化策略以快速地获得新型氮杂双环[3.1.1]庚烯骨架在药物创新中具有重要价值。
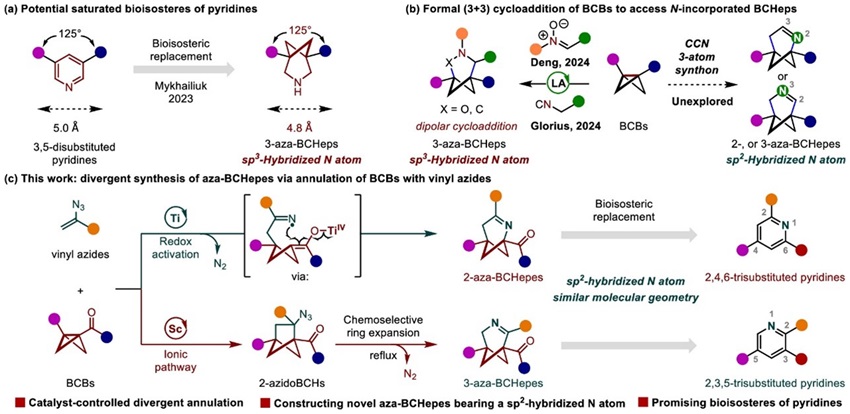
图1. 背景介绍及研究内容。图片来源:JACS
双环[1.1.0]丁烷 (BCBs) 参与的环化反应被认为是构建桥环[n.1.1]烷烃的高效合成方法。然而,目前的研究主要集中于 (3 + 2) 环加成反应来合成双环[2.1.1]己烷,(3 + 3) 环加成反应局限于环丙烷的开环/环化反应。最近,邓卫平课题组和Glorius课题组分别报道了两例Lewis酸催化的BCBs参与的 (3 + 3) 偶极环加成反应,构建了一系列含有sp3杂化氮原子的3-氮杂[3.1.1]庚烷化合物(图1b)。这些报道表明BCBs参与的环化反应是构建氮杂[3.1.1]庚烷的有效方法,但是利用该方法实现含有sp2杂化氮原子的双环[3.1.1]庚烯 (aza-BCHepes) 的合成尚无报道。
华东理工大学郑军(点击查看介绍)课题组在前期的工作中,已发展了一类Ti(salen) 催化的BCBs和氮杂二烯的环加成反应,高效地构建了2-氨基双环[2.1.1]己烷,为苯胺的生物电子等排体提供了新的研究思路 (Org. Lett. 2024, 26, 1745−1750)。在此基础上,郑军课题组最新报道了催化剂调控的双环[1.1.0]丁烷与α-烯叠氮化物的环化反应,发散性地合成了2-和3-氮杂双环[3.1.1]庚烯 (aza-BCHepes)。该研究从简单易得的α-烯基叠氮化物和BCBs出发,采用催化剂调控的 (3 + 3) 和 (3 + 2) 环化反应策略,开发了一种构建全新的2-和3-氮杂双环[3.1.1]庚烯结构的实用方法。相关成果发表在J. Am. Chem. Soc.上(图1c)。
全文详细介绍了构建氮杂双环[3.1.1]庚烯结构的两种途径:(一) 钛催化的单电子还原BCBs与α-烯基叠氮化物的 (3 + 3) 环化反应,实现了2-aza-BCHepes的简洁合成;(二) 钪催化的BCBs与α-烯基叠氮化物的 (3 + 2) 偶极环加成反应,获得的叠氮双环[2.1.1]己烷 (2-azidoBCHs) 可进行化学选择性地重排,实现了3-aza-BCHepes的高效构建。总体来说,该方法从相同的底物出发,通过改变反应的催化剂,调控BCBs与α-烯基叠氮化物的反应性质,实现了两类氮杂双环[3.1.1]庚烯的发散性合成。该方法具有反应条件温和,催化效率高,官能团耐受性广等特点。
作者首先确立了Ti(salen) 催化的 (3 + 3) 环化反应的最佳条件:以甲苯作为溶剂,Ti-1 (5 mol %)为催化剂, Mn (0.3 equiv)为还原剂, Et3N•HCl (0.5 equiv)为添加剂。随后对Ti(salen)催化体系的底物范围进行了考察(图2)。总体而言,一系列BCB酮可与α-烯基叠氮化物2a顺利反应,以优异的收率得到2-aza-BCHepes(3a-3p)。除了取代苯基外,桥头乙烯基取代的BCB酮也能顺利地进行反应(3f)。然而BCB酮类1p和1q并不适用于该催化,作者推测是由于它们形成的环丁基自由基稳定性较差。除苯基酮外,2-萘基、噻吩基、2-溴噻吩基和咪唑基等芳香族BCB酮类也可兼容该反应。对α-烯基叠氮化物的底物范围进行拓展,发现该反应可以兼容药物化学中常见的官能团,如氟、氯、溴、三氟甲基和酯。此外,由金刚烷、布洛芬、丙磺舒衍生的α-烯基叠氮化物也能高效地转化为相应的产物。
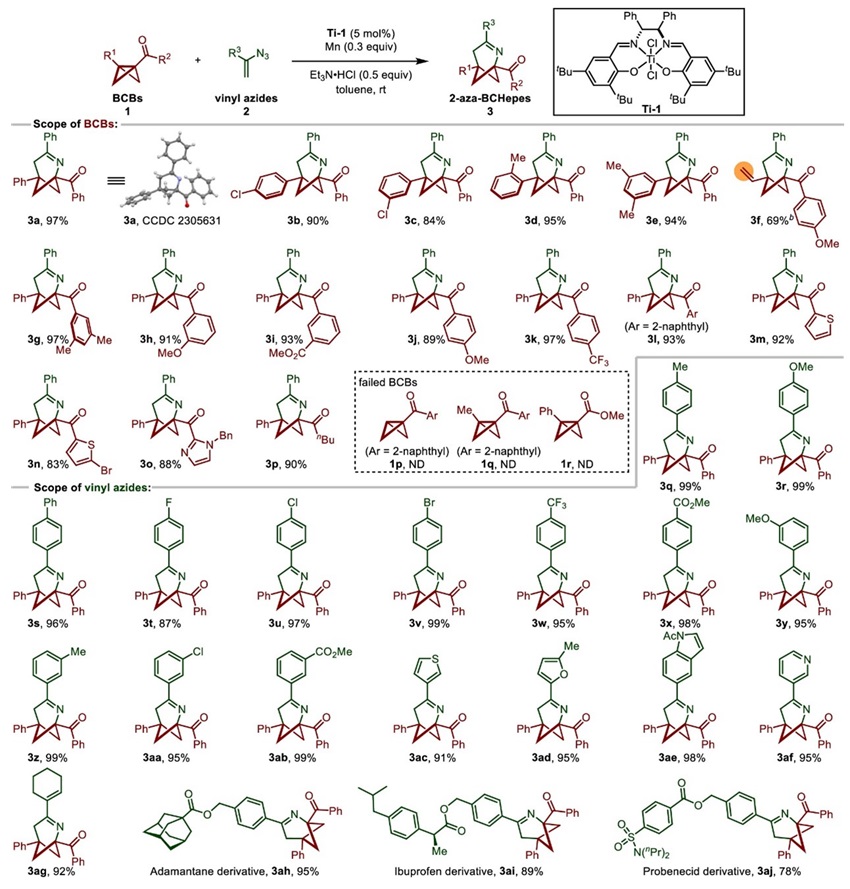
图2. Ti催化 (3 + 3) 环化反应的底物范围。图片来源:JACS
虽然目前BCB与缺电子烯烃的 (3 + 2) 环化反应已有较多研究,但是BCB和富电子烯烃的 (3 + 2) 环化反应的报道并不常见。作者发现Sc(OTf)3可以顺利催化BCB和富电性的乙烯基叠氮的 (3 + 2) 偶极环加成反应(图3)。同时,反应对于BCB酮和乙烯基叠氮均具有良好的官能团兼容性。此外,富电子的杂芳烃,如噻吩、呋喃和吲哚也能兼容,不受反应条件影响。由药物分子衍生的烯基叠氮,如金刚烷、布洛芬和丙磺舒,能以81 - 99%的产率得到2-azidoBCHs。
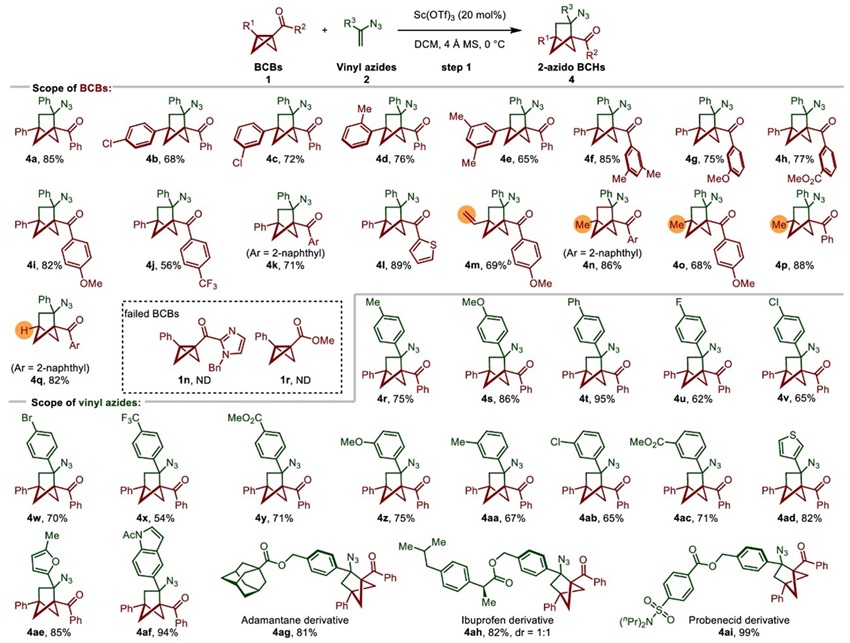
图3. Sc催化 (3 + 2) 环化反应的底物范围。图片来源:JACS
随后,作者发现2-azidoBCHs在对二甲苯中回流可顺利发生扩环反应,以优异的化学选择性得到3-aza-BCHepes(图4),并且BCB苯环上的-Me、-OMe、-Cl、-CO2Me等取代基对扩环反应均能兼容。同时,桥头乙烯基BCH、甲基BCH和单取代叠氮基BCH均能顺利发生扩环反应。此外,包括呋喃和吲哚在内的杂芳环取代的2-azidoBCHs和药物分子衍生物修饰的BCHs也能兼容此反应,揭示该方法在药物化学中的潜在应用。
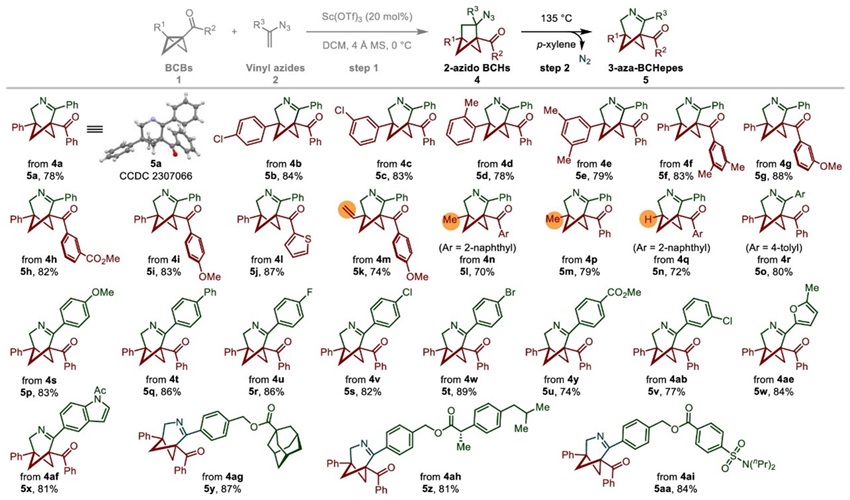
图4. 2-azidoBCH扩环反应的底物范围。图片来源:JACS
钛催化和钪催化体系均可以扩大到2 mmol规模,且收率没有影响,2-azidoBCH扩环反应也能以良好的收率扩大到1.5 mmol规模。同时,产物后续可以进行多样地衍生化,例如2-和3-氮杂双环[3.1.1]庚烯还原成相应的2-和3-氮杂[3.1.1]庚烷;azaBCHepes兼容Beckmann重排和Baeyer-Villiger氧化,转化成有价值的酰胺与酯;3n可以经过简单的两步反应,顺利地得到刚性桥环氨基酸等药物化学上有价值的氮杂桥环(图5)。
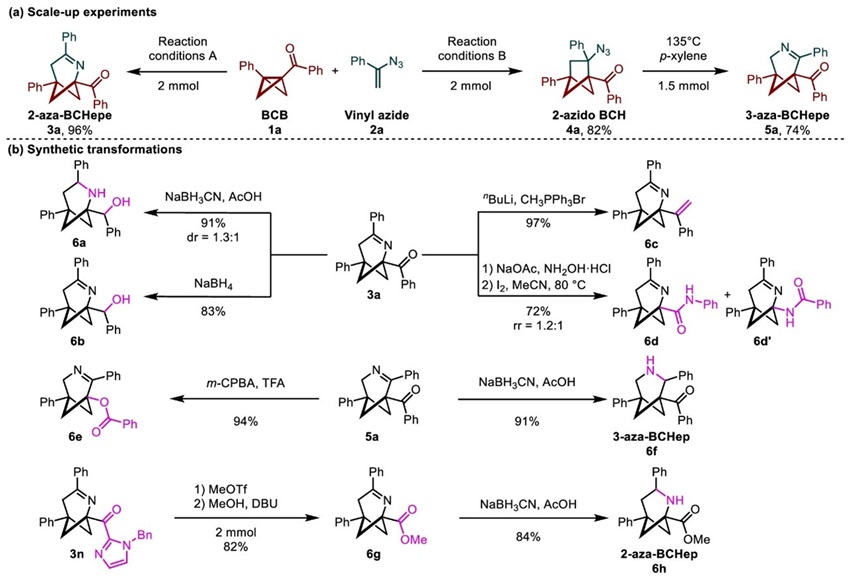
图5. 放大量实验和产物衍生化。图片来源:JACS
自由基捕获、EPR实验和Hammett曲线分析等机理研究表明钛催化体系是经历了自由基历程,而钪催化体系则更倾向于离子型的机理(图6)。
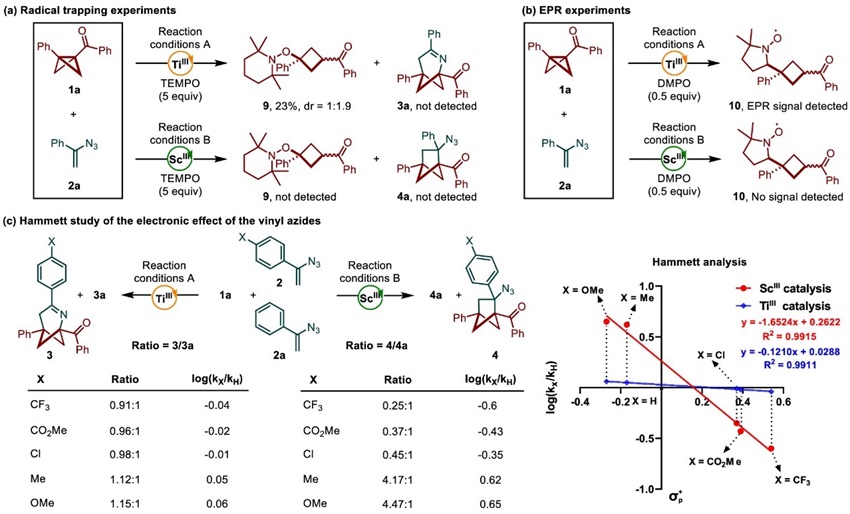
图6. 机理研究。图片来源:JACS
随后,作者将2-和3-氮杂双环[3.1.1]庚烯 (3a和5a) 的单晶结构与相应吡啶的理论计算结构进行比较。矢量分析表明:2-和3-氮杂双环[3.1.1]庚烯在空间结构上很好地模拟吡啶环,是三取代吡啶的有潜力的三维生物电子等排体(图7)。
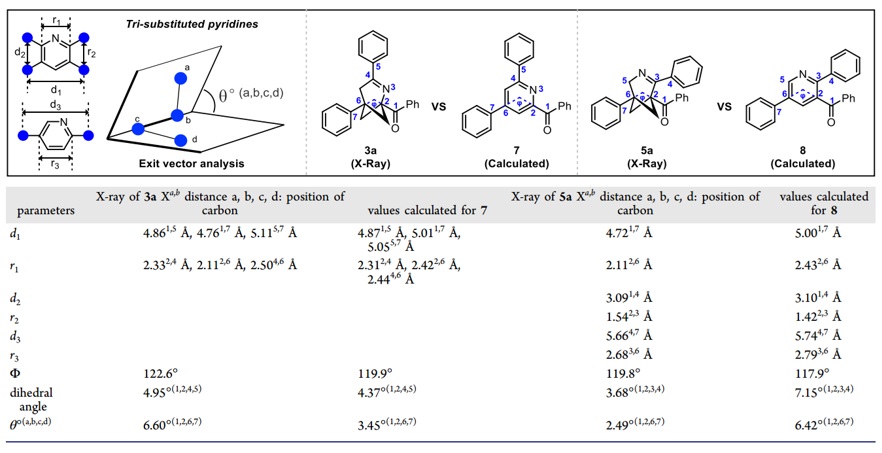
图7. 矢量分析。图片来源:JACS
综上,郑军课题组发展了α-烯基叠氮化物和BCBs的发散性环化反应,通过催化剂调控的不同反应机制,实现了全新含有sp2杂化氮原子的2-和3-氮杂双环[3.1.1]庚烯的高效构筑。相近的几何形状表明氮杂双环[3.1.1]庚烯可以作为不同取代模式吡啶的生物电子等排体,sp2杂化氮原子的设计也为探索吡啶的刚性生物电子等排体提供了新的研究思路。同时,产物经过多样化的后续衍生化可以合成2-和3-氮杂[3.1.1]庚烷以及刚性桥环氨基酸等药物化学上有价值的氮杂桥环。该研究不仅丰富了BCB的环化反应,拓展了氮杂双环[3.1.1]骨架的化学空间,而且为新药研发提供了一类具有潜力的吡啶生物电子等排体。
华东理工大学的博士研究生林忠仁为本文的第一作者,郑军教授为本文通讯作者。研究工作得到了虞心红教授的大力支持和悉心指导。该研究工作得到了国家高层次人才青年项目、国家自然科学基金项目、上海市科技创新计划项目等项目资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Synthesis of Azabicyclo[3.1.1]heptenes Enabled by Catalyst-Controlled Annulations of Bicyclo[1.1.0]butanes with Vinyl Azides
Zhongren Lin, Haosong Ren, Xinbo Lin, Xinhong Yu, and Jun Zheng*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c04485
郑军教授简介

郑军,华东理工大学药学院教授,博士生导师。2011年在苏州大学材料与化学化工学部获得学士学位;2016年在上海有机化学研究所取得博士学位,师从游书力院士;随后在德国弗莱堡大学Bernhard Breit教授课题组从事博士后研究工作。2022年7月加入华东理工大学药学院,任课题组长。以第一作者和通讯作者(或共同通讯作者)发表J. Am. Chem. Soc., Angew. Chem. Int. Ed., ACS Catal.等论文17篇。获国家和上海市高层次人才引进计划(2022,2021),德国洪堡学者(2017),中科院优秀博士论文(2017),“东岳药业”研究生奖教金特等奖(2023)。课题组的研究方向是不对称催化和自由基化学,致力于手性药物的绿色合成工艺开发,以及药物分子中芳香体系的生物电子等排体的设计、合成和应用研究。
联系方式:jz@ecust.edu.cn
课题组主页:
https://www.x-mol.com/groups/Zheng_Jun
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号