浙工大毛斌课题组/汕头大学倪绍飞Nat. Commun.:手性磷酸催化烯基氮杂芳环的不对称环氧化反应
在过去三十年中,不对称环氧化技术的发展极大地推动了化学合成领域的革命,特别是在光学活性环氧化物的合成策略方面取得了显著进展。这些环氧化物在医药、农药和材料科学等多个领域发挥着核心作用。在此期间,手性金属催化和有机催化领域取得了令人瞩目的进展,尤其是通过Sharpless环氧化、Jacobsen-Katsuki环氧化以及史一安教授团队开发的果糖基环氧化技术,成功地应用于中性或富电子烯烃的高选择性环氧化反应,使用亲电氧化剂实现了高效转化(图1a)。进一步推动这一领域发展的是Weitz-Scheffer环氧化等非共价有机催化技术,利用手性配体增强的金属过氧化物、多肽和金鸡纳碱等作为催化剂组分,大幅扩展了底物适用范围,并实现了前所未有的高对映体选择性。此外,Jørgensen、MacMillan、Córdova以及List等科学家在共价氨基催化领域的突出贡献,进一步拓宽了不对称环氧化的底物范围,通过激活亚胺离子中间体,实现了对各种烯酮和烯醛的高立体选择性环氧化(图1b)。然而,针对烯基氮杂芳烃的对映选择性环氧化,特别是在合成手性α-氮杂芳基环氧化合物方面,仍面临巨大挑战。氮杂芳烃的固有限制,例如较低的吸电子能力和倾向形成N-氧化物,限制了传统环氧化技术的应用。尽管非共价有机催化在电子不足烯烃的环氧化中显示出潜力,但在复杂含氮杂环系统中实现高效率和立体选择性的反应仍是未解决的挑战。
针对这些挑战,浙江工业大学毛斌教授课题组开发了一种创新的手性磷酸催化剂,结合双氧水作为绿色氧化剂,在温和条件下成功实现了多达十余种含氮芳杂环烯烃的高选择性不对称环氧化。这项研究成功实现了单取代、双取代、三取代及四取代α-氮杂芳基环氧烷的高效合成。机理研究揭示,这种优异的立体选择性源于手性磷酸催化剂与氮杂芳环以及双氧水之间的协同非共价键相互作用。这项研究成果不仅填补了现有合成方法的空白,而且为烯基氮杂芳环的不对称环氧化提供了新的解决方案,有望在医药合成和农业化学品开发中发挥重要作用。相关成果已发表在Nature Communications 上,汕头大学的倪绍飞老师与毛斌教授共同担任该研究的通讯作者。
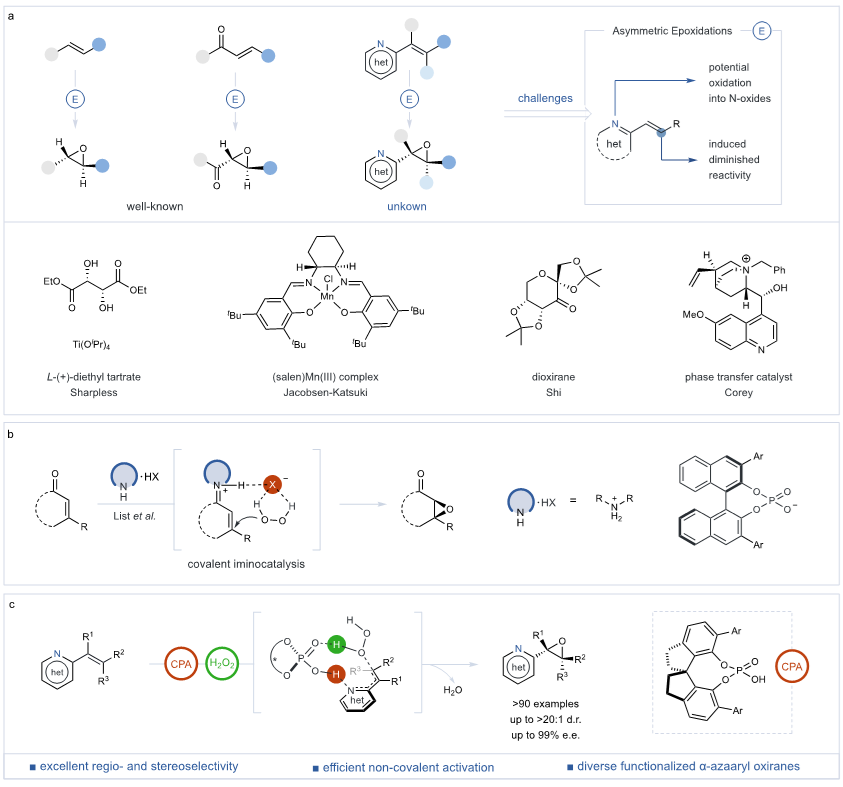
图1. 研究背景及本文工作
为合成对映体富集的α-氮杂芳基环氧化物,作者设计了一种以手性磷酸和双氧水为基础的催化系统。通过在底物中引入氰基,不仅显著提升了反应的活性,还增强了立体选择性。在优化后的反应条件下,特别是使用 (Z)-构型底物1aa和手性螺环磷酸 (S)−4a,实现了高产率(97%)和高对映选择性(97% e.e.)的顺式环氧化物合成。此外,该反应的特异性表现在未检测到氮杂芳烃氮原子氧化产物,突显了氧化过程对双键的高度专一性。硫酸镁作为干燥剂的使用,有效提高了反应效率。尽管替代氧化剂CHP和TBHP保持了高对映选择性,但在提升产率方面并未展现优势。溶剂筛选结果表明二氯甲烷与甲苯效果相当,本体系在不同条件下展现出良好的鲁棒性。

图2. 条件筛选
在合成α-氮杂芳环烯基底物的关键步骤中,Knoevenagel缩合反应被成功应用,将一系列含有不同电子吸引取代基的杂环乙腈与醛类化合物有效结合。通过上述不对称环氧化方法,作者合成了一系列具有不同氮杂环结构的α-杂环氧化物,包括吡啶、二嗪、三嗪以及苯并N-杂环衍生物,甚至非芳香性的草酮衍生物,均展现出优异的产率和对映体选择性(图3)。

图3. 含氮杂环底物拓展
研究进一步探索了β-位取代基对反应的影响,发现不同电子性质的芳基和杂芳基取代基均能兼容该反应体系,成功合成了具有高对映体选择性的三取代α-氮杂芳基氧化物。此外,该催化体系对各种脂肪族取代基和功能性基团(如卤素、酯、醚、炔等)展现了广泛适用性,进一步扩展了合成α-杂环氧化物的应用范围。该方法在处理四取代烯烃时表现出卓越的立体选择性,能够高效生成具有手性四元立体中心的环氧化物,这对于合成具有生物活性的复杂分子具有重要意义(图4)。同时,该方法在天然产物以及药物衍生底物上的应用,如 (S)-香芹醛、(R)-松油醛、非布司他中间体、胆固醇和D-葡萄糖醛酸等,进一步证明了其在合成具有生物活性的复杂氮杂芳环分子方面的潜力。

图4. 含氮杂环底物拓展及天然产物和药物修饰
在对乙烯基取代氮杂芳环化合物的深入研究中,作者发现原始的磷酸催化体系由于乙烯基底物在α位稳定阴离子能力的降低而效果不佳。通过采用N-膦酰胺催化剂 (R)-4j,大幅提高了反应性和对映选择性,成功合成了多种具有高对映选择性 (86–96% e.e.) 的α-杂环端基环氧化物(6a–6n)。该方法展示了广泛的适用性,有效地环氧化了各种1,2-二取代 (E)-烯烃和复杂的乙烯基氮杂芳烃,均表现出高立体选择性。
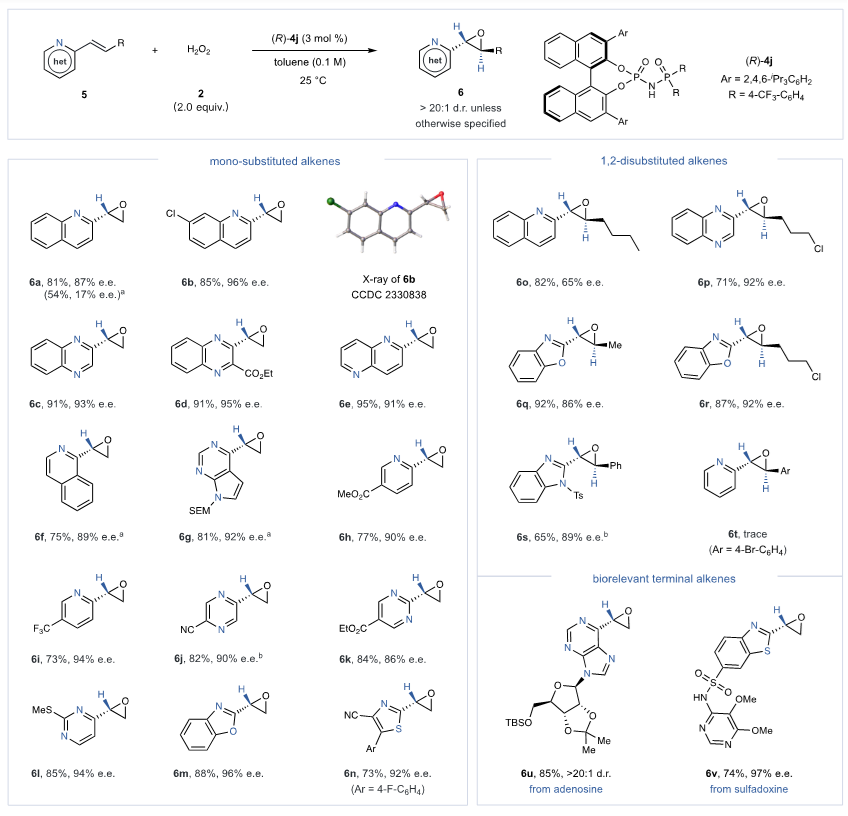
图5. 末端烯烃与1,2-二取代烯烃底物
作者进行了克级反应和进一步的衍生化反应(图6)。在催化剂浓度仅为0.5 mol %的条件下,1ci与过氧化氢2进行环氧化反应,得到2.8克的环氧化物3ci,成功再现了初步实验的优异表现,产率为85%,对映选择性为97%(图6a)。α-氰基环氧化物如3cj和3co由于其可调节的氰基(CN)基团,表现出高度的多功能性,可选择性地转化为各种衍生物,同时保持环氧结构的完整性和对映体纯度(图6b)。手性环氧化物3ci和3cj也经历了区域选择性和立体特异性的开环反应,生成具有邻位立体中心的化合物,其中反应部位由试剂的选择决定。通过乙腈诱导的开环和随后的环化反应,从3co形成了五元环化合物7i,而3ci在哌啶介导的重排反应中转化为7j。这些转化展示了手性α-氮杂芳环环氧化物的多样反应性,建立了一种催化立体选择性合成邻位立体中心密集的功能化芳香氮杂环化合物的方法。
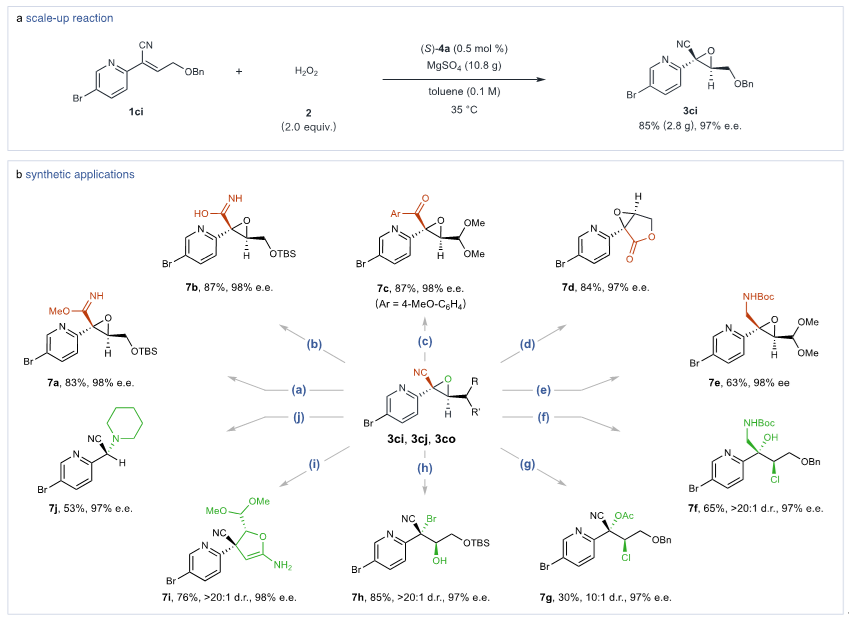
图6. 产物衍生化
通过全面的机理研究,作者揭示了环氧化过程中底物特异性的关键作用。首先,氮杂芳环中的氮原子在最佳条件下的去除会导致环氧化过程的停止,确认了C=N键作为活化位点的重要性(图7a)。在对10:1 E/Z混合物1dg进行环氧化时,生成的反式/顺式立体异构体3dg的比例降至2:1,表明立体化学完整性有所妥协。此外,在没有过氧化氢但包含手性磷酸的对照实验中,1dg的E/Z比例从10:1改变为2.5:1,强调了催化剂-底物相互作用在异构化过程中的深远影响。实验还表明,催化剂和环氧化物3bi的对映选择性之间存在正线性关系,暗示单体催化剂在关键过渡态中的影响(图7b)。基于Burés图形法的动力学研究证实了反应对催化剂浓度的一阶依赖性,强调了催化剂在形成立体结果和整体反应动力学中的重要作用(图7c)。

图7. 动力学反应机理研究
为了解释观察到的立体选择性,作者采用了密度泛函理论(DFT)计算,揭示了一个关键中间体Int1-SR的形成,该中间体通过催化剂、过氧化氢和底物之间的非共价相互作用稳定,表现为显著的能量降低(图8a)。从Int1-SR到最终环氧化物的转变需要克服20.4 kcal/mol的自由能障,在对比分析中,非氰基变体1aa表现出显著较高的障碍,说明氰基取代基在降低反应能量要求方面的深远影响。这一发现强调了取代基性质对催化效率和立体选择性的显著影响。进一步的能量分解分析和结构分析证实了催化剂构象动态在立体选择性中的关键作用,结合详细的实验研究和DFT计算,提出了一个用于烯基氮杂芳烃立体选择性环氧化的催化机制(图8c)。
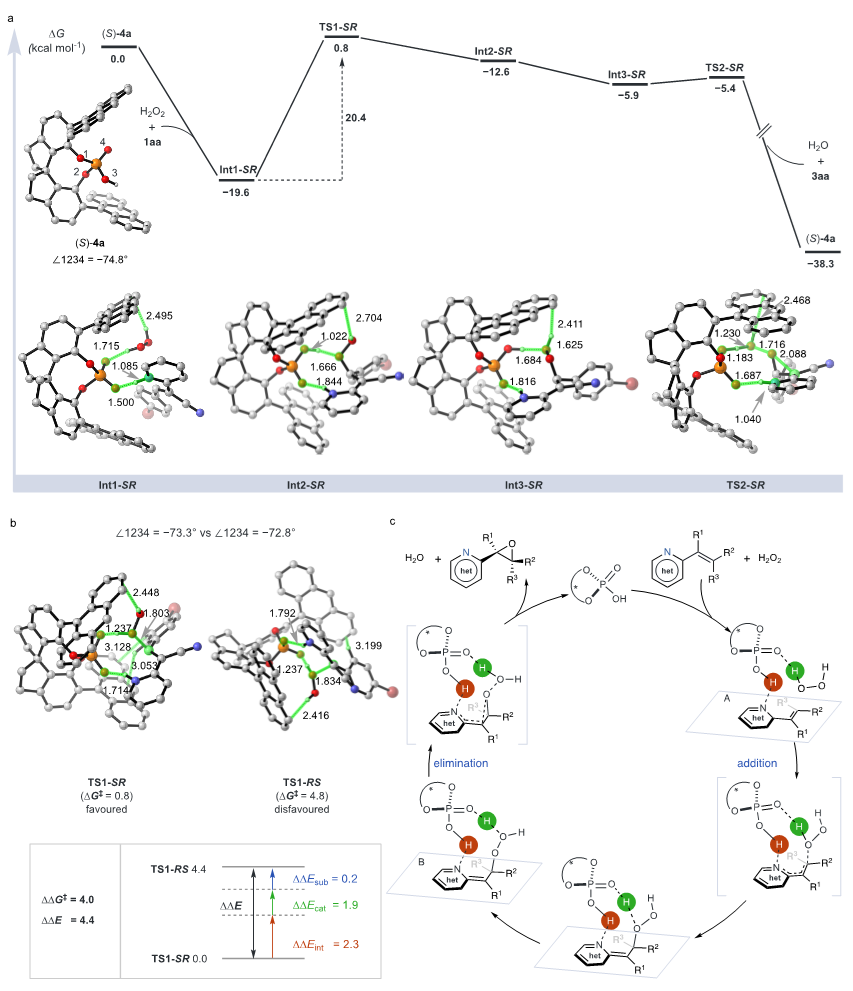
图8. DFT机理研究
总之,毛斌教授课题组的这项研究不仅在理论上深化了对不对称环氧化机理的理解,而且在实践中提供了一种高效、高选择性合成手性α-氮杂芳基环氧化合物的新方法。这一方法利用环境友好的双氧水作为氧化剂,结合手性布朗斯特酸催化,实现了高达99%的立体选择性,对特定位点表现出特异反应性。研究成果展示了在药物开发和合成化学中构建复杂氮杂环骨架的广泛应用前景。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Chiral phosphoric acid-catalyzed asymmetric epoxidation of alkenyl azaheteroarenes using hydrogen peroxide
Hao-Chen Wen, Wei Chen, Meng Li, Chen Ma, Jian-Fei Wang, Aiping Fu, Shi-Qi Xu, Yi-Feng Zhou, Shao-Fei Ni* & Bin Mao*
Nat. Commun., 2024, DOI: 10.1038/s41467-024-49435-2
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!







































 京公网安备 11010802027423号
京公网安备 11010802027423号