Nature:酮亚胺的不对称氢化,如何识别相似取代基?
在过去的几十年里,不对称催化领域取得了巨大进展,其中的标志性事件就是Benjamin List和David MacMillan两位化学家因在不对称有机催化领域的贡献而荣获2021年诺贝尔化学奖。一般来说,不对称催化的核心目标是创造一种能够区分底物的前手性面或前手性中心的立体选择性催化剂,特别是不对称催化不饱和双键的亲核加成反应(图1a)。虽然目前大多数工作都集中在含有芳基和烷基的底物上,但当取代基具有非常相似的空间和电性(如:伯烷基和甲基)时却难以实现高对映选择性。另一方面,手性胺是生物活性分子、天然产物、农用化学品的重要结构单元,迄今为止化学家发展了多种方法来构建手性胺,其中最具代表性的是亚胺的不对称氢化反应。然而,二烷基酮亚胺的不对称氢化反应仍极具挑战性,这是因为E-和Z-立体异构体之间存在快速平衡,而且它们在典型反应条件下会互变异构为四种潜在的烯胺中间体,从而引发复杂的反应途径并导致产物的对映选择性较低(图1b)。
尽管传统方法中手性催化剂主要利用催化剂和底物之间的空间相互作用来控制立体选择性,但是自然界中的酶则是利用有限的活性位点对有机转化进行精确控制。受此启发,清华大学的刘强教授课题组设计并构建了一类具有精细可调限域结构的阴离子型锰氢中间体(图1c),能够在二烷基酮亚胺的不对称氢化反应中精准识别微小差异的烷基取代基(如:甲基和乙基、乙基和正丙基),从而以优异的对映选择性获得一系列手性胺产物(图1d),催化剂周转数(TON)高达107800。此外,机理研究表明优异的立体选择性源于受限手性催化剂的模块化组装以及催化剂和底物之间的协同非共价键相互作用。相关成果于近日发表在Nature 上,蓝宇教授与刘强教授为通讯作者。
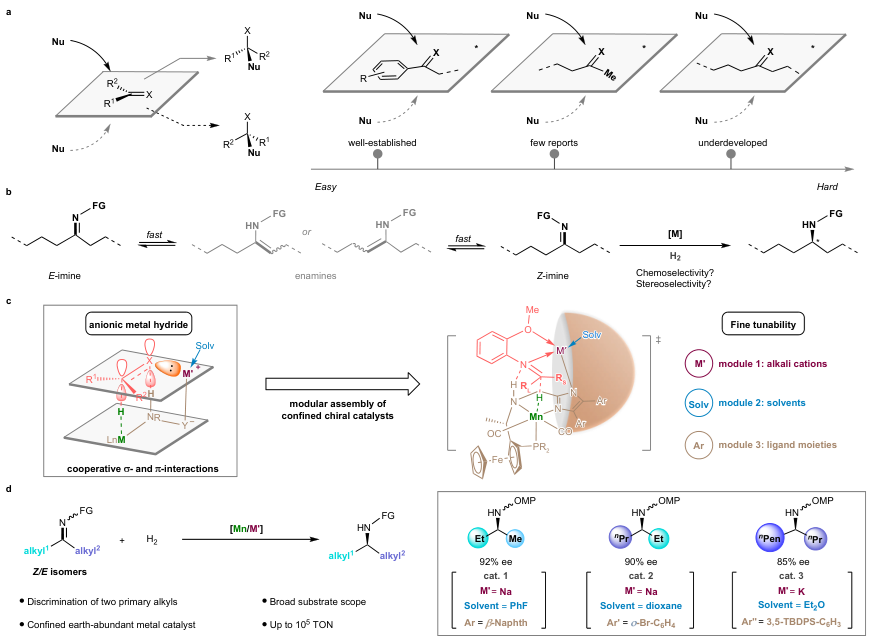
图1. 反应设计。图片来源:Nature
对N-保护基、溶剂和温度等关键反应参数进行优化后,作者选择由3-庚酮和邻甲氧基苯胺衍生的酮亚胺1a(Z/E=1:1)为模板底物对催化剂结构进行筛选(图2a),结果显示NNP钳形配体的4,5-二取代咪唑单元对受限反应位点的对映选择性至关重要,其中芳基取代基的电性影响较小,而取代基的位置却显著影响对映选择性,例如:在对位或间位带有取代基的催化剂效果较差(ee值:3%-48%),而使用邻位取代芳基催化剂时却显著提高对映选择性,特别是邻溴苯基取代的催化剂Mn-13能以95%的产率和91% ee值获得所需产物2a。此外,对照实验表明金属抗衡阳离子和溶剂在该反应中也起着关键作用(图2b),进而证明了金属抗衡阳离子、溶剂以及受限位点中的配体参与了精确对映诱导。
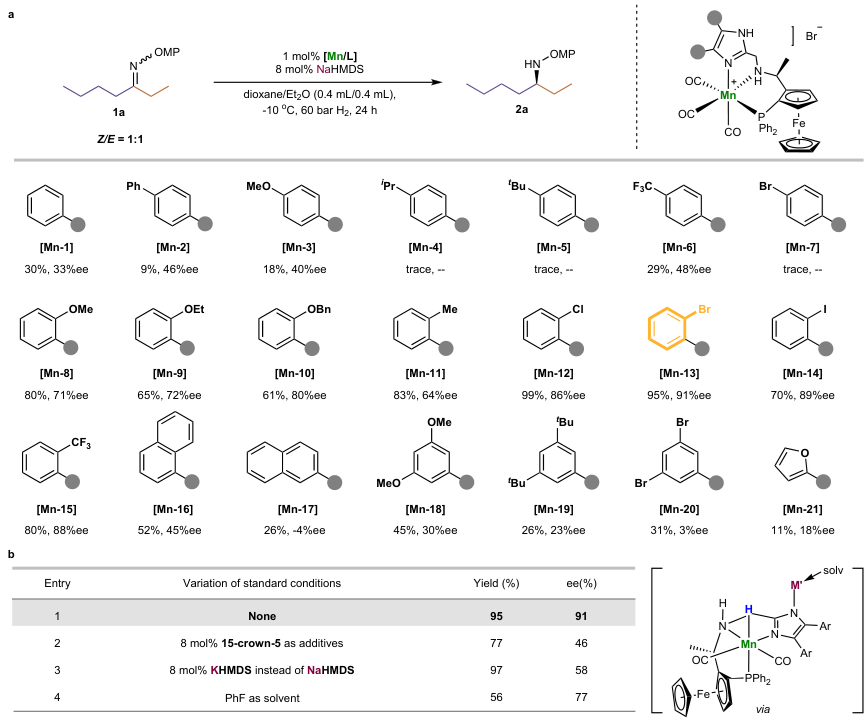
图2. 条件筛选。图片来源:Nature
随后,作者进行了密度泛函理论(DFT)计算来探究立体选择性控制,结果显示二烷基亚胺的E/Z异构化通过碱辅助的烯胺-亚胺互变异构化进行,并且E/Z亚胺异构体之间的快速平衡使得仅有一种异构体能够按照有利的反应途径参与氢化反应。如图3a所示,作者研究了阴离子Mn-H络合物与底物的四种配位模式,结果显示与稳定的螯合配位(即钠离子与底物的N、O原子配位)相比,涉及阳离子-π相互作用的过渡态由于弱配位导致能垒较高。此外,过渡态Z-S-TS4比E-R-TS6的能垒低2.2 kcal/mol,进而表明(S)-构型产物2a为主要异构体,这与实验结果相一致。为了更深入了解对映选择性的起源,作者使用分子范德华表面图来分析乙基正丁基亚胺1a的氢化物转移过渡态(图3b),其中Z-S-TS4的表面图显示乙基能够很好地适应受限的反应位点,而E-R-TS6中大位阻正丁基却难以适应,这说明高立体选择性源于受限手性催化剂的模块化组装及其与底物的协同非共价相互作用。类似地,作者在抗衡钾离子中观察到较小的活化势垒(1.3 kcal/mol,图3c),这是因为钾离子比钠离子的半径大,因此较大的手性空间限制导致对映选择性较差,进而说明抗衡阳离子对对映诱导的显著影响。此外,乙基甲基亚胺1al和乙基正丙基亚胺1b的计算氢化物转移过渡态的能量差与实验中观察到的对映选择性相一致(图3d),进一步DFT计算研究了乙基正丁基亚胺1a与Mn-13催化剂上二茂铁三齿配体的配位模式,结果表明在整个催化循环中面向配位优先于经向配位。其次,作者还进行了实验验证,具体而言:锰络合物Mn-17在2.0 equiv tBuOK的作用下以定量产率得到相应的阴离子锰三羰基络合物Mn-17b并通过31P NMR、IR和HRMS分析对其进行表征,Mn-17b失去一分子CO,以低转化率形成相应的阴离子锰二羰基络合物Mn-17c,其与氢气反应形成具有催化活性的阴离子锰氢物种Mn-17d(图3e)。另外,氘标记实验排除了涉及烯胺中间体进行氢化的可能性(图3f)。
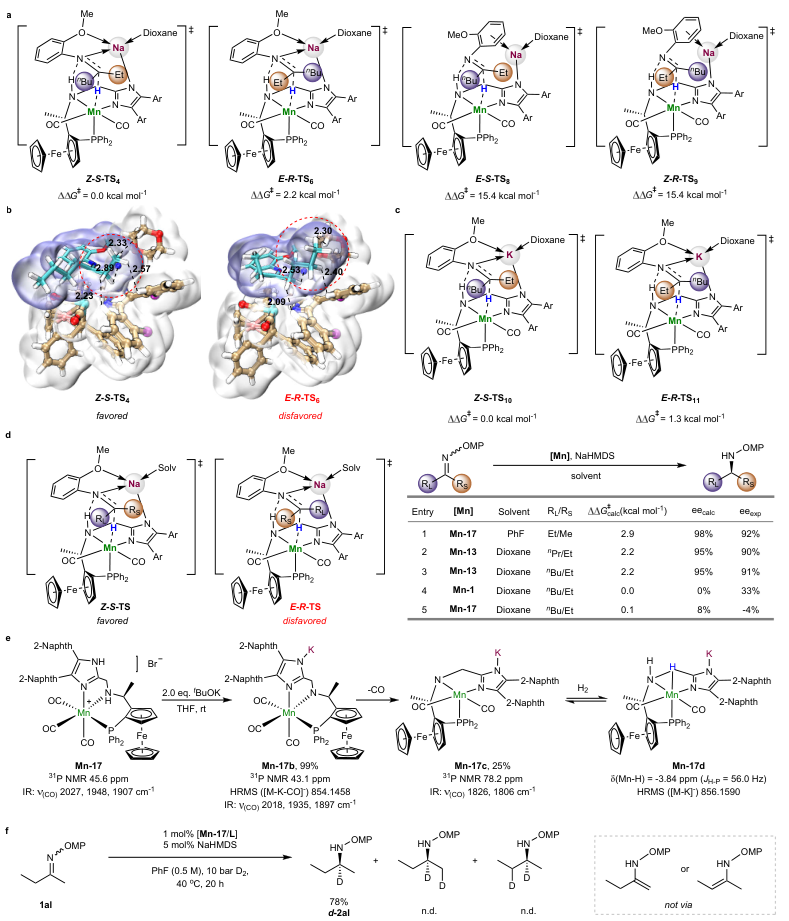
图3. 机理研究和DFT计算。图片来源:Nature
在最优条件下,作者利用不同的催化剂对亚胺的底物范围进行了考察(图4),结果显示一系列乙基烷基亚胺(2a-2h)、乙基苄基酮亚胺(2i-2l)、正丙基烷基亚胺(2m-2o)、仲烷基和伯烷基取代的亚胺(2p-2v)以及带有各种官能团的亚胺底物(如:烯基(2w)、炔基(2x)、苯基(2y)、叔丁基二甲基硅氧基(2z)、硒基(2aa)、苄氧基(2ab)、呋喃(2ac)、噻吩(2ad)、叔丁基(2ae)、1,3-二氧六环(2af、2ag)和甲氧基(2ah、2ai))甚至大位阻叔/伯烷基亚胺(2aj-2ak)均能有效地进行不对称氢化反应,以良好至优异的产率(63-99%)和对映选择性(85-99% ee)获得相应产物。对反应条件进行稍加修改后,2-丁酮衍生的底物1al在萘基取代Mn-17的催化下以91%的产率和92% ee值获得所需产物2al。类似地,多种伯烷基/甲基酮亚胺(2am-2au)、仲烷基/甲基酮亚胺(2av-2bc)、叔烷基/甲基酮亚胺(2bd、2be)和芳基/烷基亚胺也能以优异的产率(87-99%)和对映选择性(90-99% ee)转化为相应的手性胺产物,进一步展现出该方法的实用性。
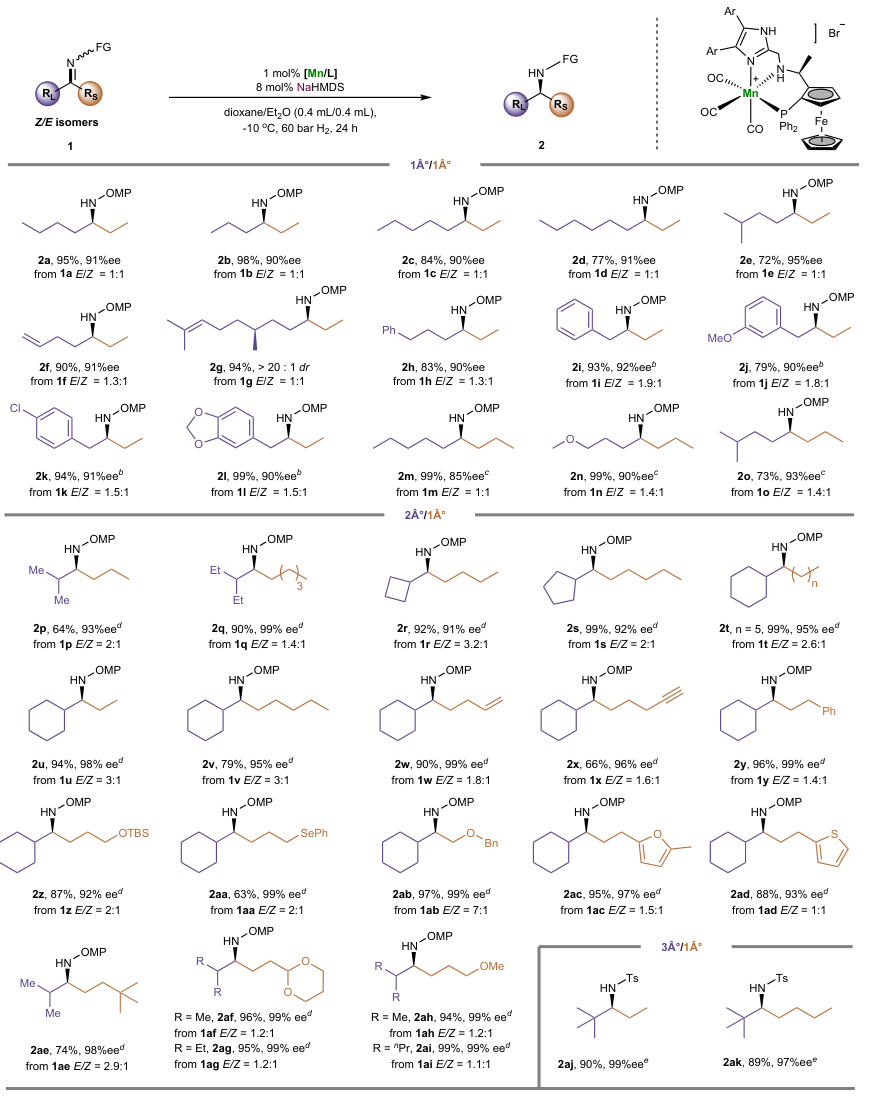
图4. 底物拓展。图片来源:Nature
如图5a所示,亚胺1as的不对称氢化反应能在低催化剂负载量(9 ppm)下以克级规模进行(29.6 g,110 mmol,S/C = 110000:1),并且催化剂周转数(TON)高达107800,这是迄今为止地球储量丰富金属催化剂不对称氢化的最高纪录。最后,作者进行了合成应用研究,具体而言:1)2as在高碘酸的作用下脱除OMP保护基,以61%的产率得到手性伯胺3并且对映选择性没有损失,3是合成平喘药物 (R,S)-福莫特罗的关键中间体(图5b);2)2aq经脱除保护基、与3,4-二甲氧基苯乙酸进行缩合反应、还原反应和去甲基化反应,有效地合成了(S)-左多巴酚丁胺(图5c);3)2ab经脱除保护基、与烟酸衍生物缩合以两步60%的产率、>99% ee值获得MER酪氨酸激酶抑制剂8(图5d)。

图5. 合成应用。图片来源:Nature
总结
本文作者设计并构建了一类具有精细可调限域结构的阴离子型锰氢催化活性中间体,并在酮亚胺化合物的不对称氢化反应中成功地实现了对微小差异烷基取代基之间的精准手性识别。该反应具有广泛的底物兼容性,并且可实现高达107800的周转数(TON)。此外,机理研究表明优异的立体选择性源于受限手性催化剂的模块化组装以及催化剂和底物之间的协同非共价相互作用。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Asymmetric hydrogenation of ketimines with minimally different alkyl groups
Mingyang Wang, Shihan Liu, Hao Liu, Yujie Wang, Yu Lan, Qiang Liu
Nature, 2024, DOI: 10.1038/s41586-024-07581-z
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!







































 京公网安备 11010802027423号
京公网安备 11010802027423号