OSU郑庆飞课题组JACS:利用生物正交化学标记和富集肿瘤细胞中的组蛋白单胺化修饰
近日,美国俄亥俄州立大学郑庆飞课题组在J. Am. Chem. Soc.杂志上发表研究论文,报道了基于芳基重氮盐和双环壬炔的两类化学生物学探针,并通过生物正交反应将其分别用于标记和富集组蛋白上的5-羟色胺化和多巴胺化两类翻译后修饰,首次证明了这两种组蛋白单胺化在癌症细胞的染色体中大量积累并在癌症的表观遗传学调控过程中起到重要作用(图1)。
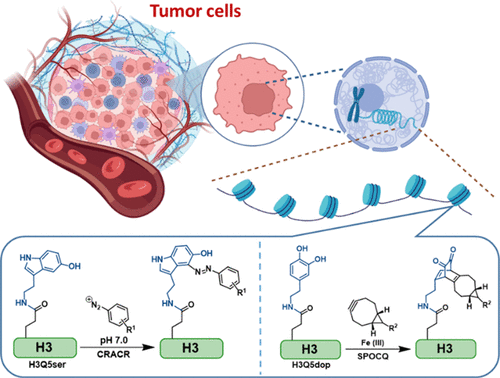
图1. 使用本研究中的化学探针能够快速、高效、灵敏地标记和富集细胞和组织样品中的组蛋白单胺化修饰并由此证实了肿瘤细胞和组织中此类表观遗传学修饰的大量积累
组蛋白的单胺化是近年来发现的一类新型表观遗传学修饰,主要发生过在组蛋白H3的5号位谷氨酰胺(H3Q5)上,目前已经报道的类型包括5-羟色胺化(Nature, 2019, DOI: 10.1038/s41586-019-1024-7)、多巴胺化(Science, 2020, DOI: 10.1126/science.aaw8806)和组胺化(bioRxiv, 2022, DOI: 10.1101/2022.12.06.519310)等。在前期的研究中,郑庆飞博士等通过一系列的生物化学手段证实了谷氨酰胺转胺酶2(Transglutaminase 2, TGM2)的关键催化残基C277通过转氨反应与H3的Q5残基形成关键硫酯中间体,该活性中间体能够与生物体内的单胺代谢产物(5-羟色胺、多巴胺、组胺等)发生亲核取代反应(图2),最终在底物谷氨酰胺残基的侧链形成稳定的异肽键(isopeptide bond),而由于TGM2催化的转氨反应具有可逆性和广谱的底物适应性,H3Q5单胺化的引入、移除和置换均可由TGM2催化调控完成(bioRxiv, 2022, DOI: 10.1101/2022.12.06.519310)。前期的研究也表明,这一类新型的组蛋白翻译后修饰在表观遗传学和基因转录调控过程中起到重要作用。然而,由于检测工具(例如位点特异性抗体或泛特异性抗体)和分析方法(例如质谱、核磁或免疫印迹分析)的限制,快速、高效、灵敏地检测和分析组蛋白单胺化显得十分困难。
在本研究中,郑庆飞课题组首先设计并合成了具有生物素标签的光活化芳基重氮盐探针(Probe 1),并将其用于特异性标记组蛋白中由于翻译后修饰引入的5-羟色胺基团(图2),他们发现该生物正交反应(CRACR)可以应用于检测分析体外生化反应、培养的细胞样品(图3)、临床肿瘤样本和动物肿瘤标本(图4)中组蛋白H3的5-羟色胺化修饰。同时,为了进一步简化实验流程,他们还制备了自身具备荧光基团的芳基重氮盐探针(Probe 3),并将之直接用于组织样本中组蛋白5-羟色胺化修饰的快速检测(图4)。
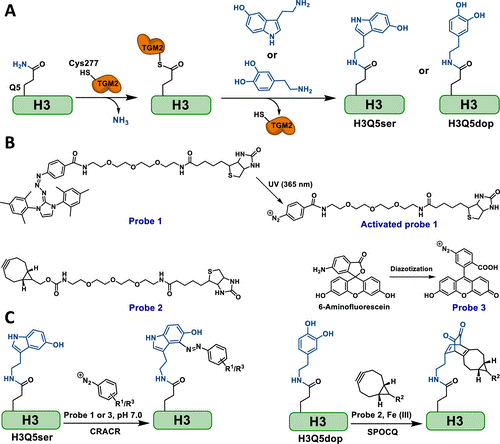
图2. 由TGM2催化的组蛋白H3单胺化反应以及作者在本研究中设计、合成的两类化学探针,能够通过生物正交反应CRACR和SPOCQ分别特异性标记修饰蛋白侧链的5-羟基吲哚和邻苯二酚基团
随后,作者又设计并合成了具有生物素标签的双环壬炔探针(Probe 2),并通过生物正交反应(SPOCQ)将其特异性地加成到修饰组蛋白侧链中的邻二苯酚结构单元中(图2)。此反应同样可以应用于检测分析体外生化反应、培养的细胞样品(图3)、临床肿瘤样本和动物肿瘤标本(图4)中组蛋白H3的多巴胺化修饰。作者认为,肿瘤组织中组蛋白H3Q5单胺化的富集可以归因于其“书写器”蛋白TGM2在多种肿瘤细胞中过量表达并对于癌细胞的增殖、扩散和转移具有重要的调控作用。
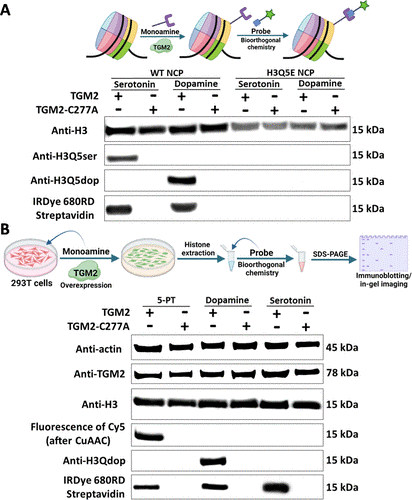
图3. 利用本研究中开发的化学探针标记体外生化反应和细胞样品中的组蛋白单胺化修饰
最后,作者使用Probe 1对于小鼠结肠癌样本中具有5-羟色胺化修饰的组蛋白H3进行了特异性富集,通过比对不同组分中组蛋白H3的4号位赖氨酸三甲基化(H3K4me3)的水平,进一步证明了H3Q5ser通过稳定关键表观遗传学因子H3K4me3“间接”参与了基因调控。他们还进一步利用十二聚核小体作为底物通过体外生化实验揭示了组蛋白H3Q5单胺化能够通过芳香环的位阻效应“直接”影响染色体的三维空间折叠,并由此调控基因转录。
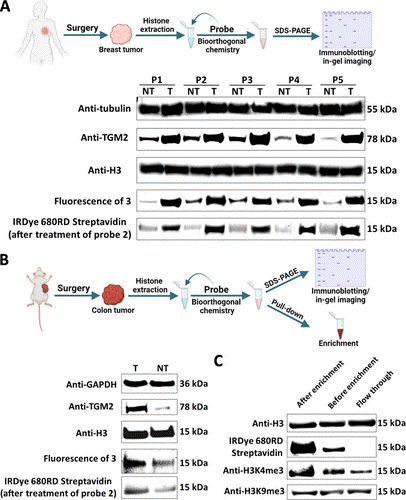
图4. 利用本研究中开发的化学探针标记和富集临床乳腺癌和小鼠结肠癌样品中的组蛋白单胺化修饰
总之,在本研究中,作者首次开发了一系列的化学生物学工具,通过生物正交反应特异性地标记和富集了不同种类生物样本中的组蛋白单胺化翻译后修饰,并首次发现组蛋白H3Q5的单胺化修饰在肿瘤细胞中大量积累并通过多种机理起到了重要的表观遗传学调控作用。值得指出的是,本研究中的探针可以直接标记目标翻译后修饰本身,而无需对生物体系进行任何外源性模拟供体的喂养,在疾病早期诊断和生物标记物分析等方面具有巨大的应用前景。作者还进一步将这些探针用于结肠癌细胞中具有单胺化翻译后修饰的全蛋白组研究(J. Proteome Res., 2024, DOI: 10.1021/acs.jproteome.4c00379; bioRxiv, 2024, DOI: 10.1101/2024.05.10.593574),利用基于这些探针的化学蛋白质组学方法,他们成功鉴定到了结肠癌细胞中几百个具有单胺化翻译后修饰的蛋白和相应的修饰位点,其中不乏诸多对于肿瘤发生、发展和治疗具有重要调控作用的关键蛋白,这也进一步暗示设计针对蛋白质单胺化翻译后修饰的药物可能成为未来癌症治疗的新策略。
张楠博士(下图左一)、吴璟华博士(下图左四)和Farzana Hossain博士是本文的共同第一作者,本文的通讯作者是郑庆飞博士(下图左三)。

原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Bioorthogonal Labeling and Enrichment of Histone Monoaminylation Reveal Its Accumulation and Regulatory Function in Cancer Cell Chromatin
Nan Zhang, Jinghua Wu, Farzana Hossain, Haidong Peng, Huapeng Li, Connor Gibson, Min Chen, Huan Zhang, Shuaixin Gao, Xinru Zheng, Yongdong Wang, Jiangjiang Zhu, Jing J. Wang, Ian Maze, Qingfei Zheng
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c04249
研究团队简介

本文通讯作者郑庆飞博士,现任美国俄亥俄州立大学医学院助理教授,2012年本科毕业于清华大学化学系化学生物学基础科学班,2017年博士毕业于中国科学院上海有机化学研究所,2017-2021于美国纪念斯隆凯特琳癌症中心进行博士后研究工作,2021年8月加入俄亥俄州立大学。郑博士长期从事蛋白质翻译后修饰、癌症表观遗传学、肿瘤微生物组、微生物代谢的研究,研究手段包括化学生物学、合成生物学、生物物理、化学蛋白质组学和代谢组学等。
郑博士的课题组今年将招收多名博士后研究员、研究助理和博士研究生,欢迎具有化学、药学、生物学或医学背景的申请者,感兴趣的同学请联系zhenglab.purduemcmp@gmail.com进行申请或咨询。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!







































 京公网安备 11010802027423号
京公网安备 11010802027423号