宋杰课题组系列文章:详细阐述环状单链DNA的蛋白表达机制及调控新思路
导读:
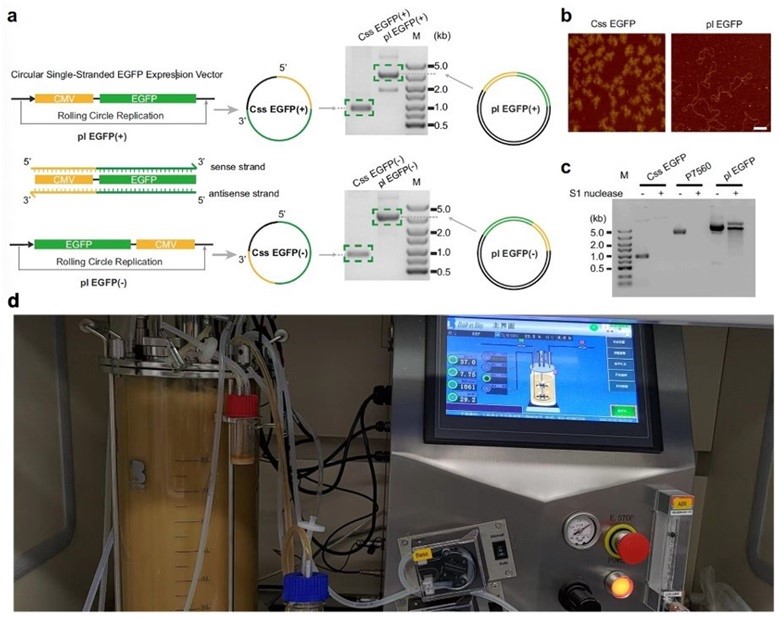
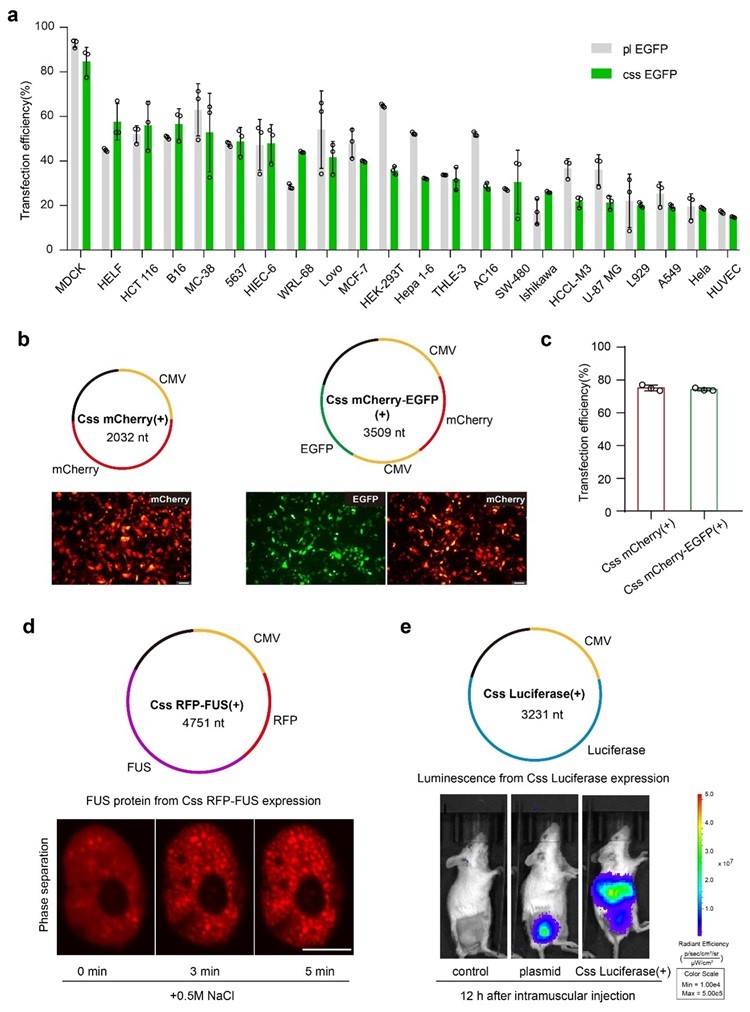
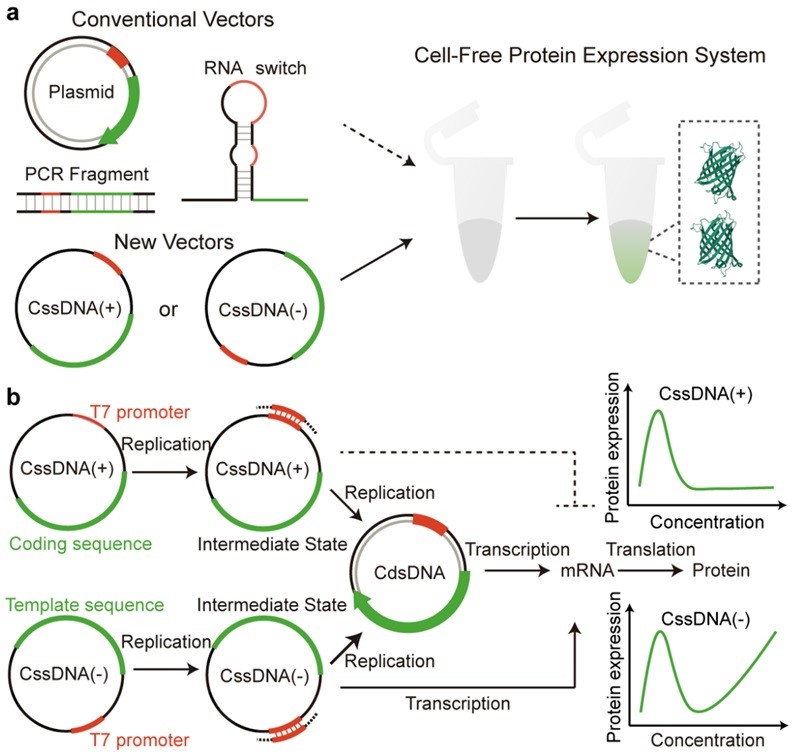
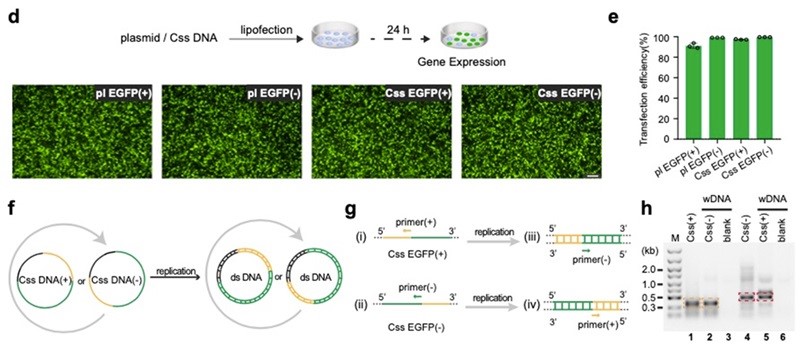
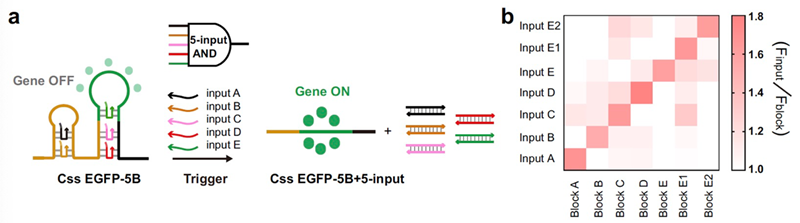
围绕环状单链DNA这一分子生物学新工具,宋杰课题组近期在Nature Communications 上连续发表两篇文章分别从无细胞体系(Nat. Commun., 2024, 15, 4635)和细胞及动物体内(Nat. Commun., 2023, 14, 6665)阐述环状单链DNA的蛋白表达机制及调控新思路,并详细综述了环状单链DNA的物种起源、生物效应和前沿应用(ACS Synth. Biol., 2024, 13, 1038)以及DNA作为基因治疗的潜在应用(Mol. Pharmaceutics, 2024, 21, 427)。


如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!







































 京公网安备 11010802027423号
京公网安备 11010802027423号