Science:不爆炸的芳基重氮化学用于Sandmeyer反应
一个多世纪之前,瑞士化学家Sandmeyer利用芳基重氮盐对d10金属的氧化加成制备了一系列芳基卤化物(图1A),这是因为重氮盐具有高亲电性、低还原电位以及N2作为离去基团等优势,从而能够实现具有挑战性的转化(如:单电子转移(SET)引发的对主族元素的氧化加成)。迄今为止,化学家仍然通过亚硝酸根离子(NO+,由亚硝酸盐试剂的酸性降解形成)与苯胺在低温下进行反应来合成芳基重氮盐,但其极不稳定,受热或震动易爆炸,这给合成带来了很大的难度和危险性。为了减少与重氮化学相关的危险,化学家已经开发了替代脱氨方案(如:使用吡啶作为离去基团或二氮烯作为中间体),但是这些反应通常不能实现重氮化方法的适用性和原子经济性。另一方面,尽管硝酸盐在热力学上是一种比亚硝酸盐更强的氧化剂,但其没有用于重氮化过程,这可能要归因于对还原过程的高动力学稳定性。在酸性条件下,NO3-和硝酸酯不产生用于重氮化的亚硝基鎓阳离子(NO+),而是形成硝鎓离子(NO2+),后者作为亲电试剂进行芳烃硝化而非重氮化。在自然界中,几种微生物通过将硝酸盐用作呼吸的末端电子受体来还原硝酸盐,例如:化能自养反硝化流感菌使用硫代硫酸盐(S2O32-)产生氮气(N2)和硫酸盐(SO42-)作为NO3-还原副产物。在植物中,硝酸盐还原是用硝酸盐还原酶金属酶进行的(图1B),例如:真核硝酸还原酶在钼基活性位点和氢键辅助下通过氧原子转移机制进行操作。
近日,德国马克斯-普朗克研究所的Tobias Ritter教授(点击查看介绍)课题组使用硫代硫酸盐或二卤化铜作为电子供体来实现硝酸盐还原(图1C),该步骤是速率限速步,产生的芳基重氮盐作为瞬态中间体,可一步将苯胺安全、高效地脱氨基卤化为相应的芳基卤化物。与传统的重氮化学相比,该过程能够避免热失控反应、分离或储存重氮盐的两步序列,同时可以解决重氮化学的几个局限性,例如:其它官能团的不期望氧化;具有空间位阻苯胺和杂芳胺的官能团化无法进行;由于自由基二聚和加水分别形成的竞争性联芳基和苯酚而导致产率下降;不期望的质子脱胺化等。相关成果发表在Science 上。
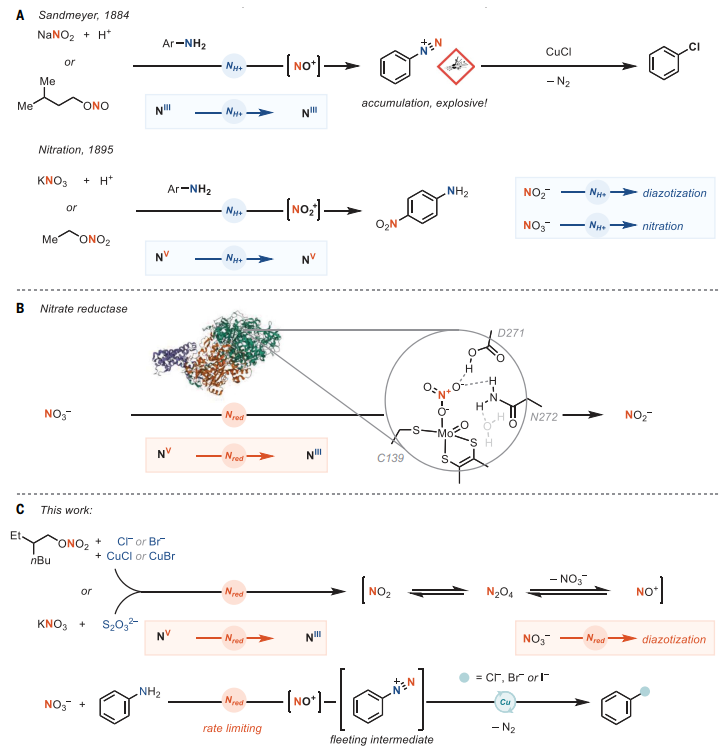
图1. 重氮盐作为中间体。图片来源:Science
首先,作者选择对氨基苯甲酸乙酯1为模板底物对脱氨基氯化、溴化和碘化过程进行了条件优化并获得最佳条件(图2A),具体而言:1)脱氨基氯化反应使用四丁基氯化铵(TBACl)、CuCl和硝酸酯(如:硝酸异辛酯(2))实现;2)脱氨基溴化反应在TBANO3、Na2S2O3•5H2O为还原剂、1,2-二溴乙烷(4,DBE)为溴源和CuBr的作用下进行;3)脱氨基碘化反应利用KNO3、Na2S2O3•5H2O为还原剂、1,2-二碘乙烷(DIE)为碘源实现,并且三种反应都在乙腈回流下进行。尽管该方法的反应条件与传统重氮化不一致,但是所有基于机理的实验都与芳基重氮盐的中间性相一致,随后的反应过程类似于Sandmeyer反应。此外,气相色谱-质谱法(GC-MS)还观察到未标记、部分标记和完全标记的N2作为反应产物,这与芳基重氮盐的形成及其后续转化相一致;而且在整个反应过程中1H或15N NMR谱没有检测到重氮盐,进一步证实芳基重氮盐没有积累,而是作为瞬态中间体。其次,作者使用不同的NV试剂进行对照实验并结合密度泛函理论(DFT)计算提出脱氨基氯化机制(图2B):即烷基硝酸盐通过SET进行还原并原位生成二氯铜酸盐7,可还原硝酸异辛酯2并得到NO2和铜酸盐8。接着,NO2和铜酸盐8进一步反应形成CuCl和硝酰氯(NO2Cl),其可以均裂N-Cl键并形成NO2和氯自由基,NO2通过二聚化为N2O4并随后歧化为NO+NO3-来产生芳基重氮盐,再与CuCl通过常规的Sandmeyer型反应便可形成芳基氯化物。对于脱氨基溴化反应,硝酸酯2在CuBr和TBABr的存在下以63%的产率获得芳基溴化物(图2C),而TBANO3和1,2-二溴乙烷4的组合能将产率提高至77%,并且反应中添加Na2S2O3•5H2O可以抑制底物1的二溴化。其具体过程如下:二溴乙烷4经亲核取代转化为硝酸酯9,同时释放的溴化物可以被CuBr捕获并产生CuBr2−(10),后者还原形成的硝酸酯9以产生NO2和中间体11,两者进一步反应形成CuBr和硝酰溴(NO2Br),其可以均裂N-Br键并形成NO2和溴自由基,NO2通过二聚化为N2O4并随后歧化为NO+NO3-来产生芳基重氮盐,再与CuBr通过常规的Sandmeyer型反应便可形成芳基溴化物。类似地,底物1在硝酸酯2、CuI和TBAI的存在下进行脱氨基碘化反应时能以68%的产率获得产物6,若用硫代硫酸盐代替铜盐作为还原剂时产率高达98%。由于S2O32-在<140 ℃下无法还原NO3-,因此S2O32-先被碘氧化为四硫酸盐(S4O62-),可被碘催化进一步转化为二氧化硫(SO2)、硫酸盐(SO42-)和硫(S8),SO2可以有效还原NO3-,同时反应顶部空间的气相电子顺磁共振(EPR)实验证实了NO3-和SO2形成NO2(图2D)。
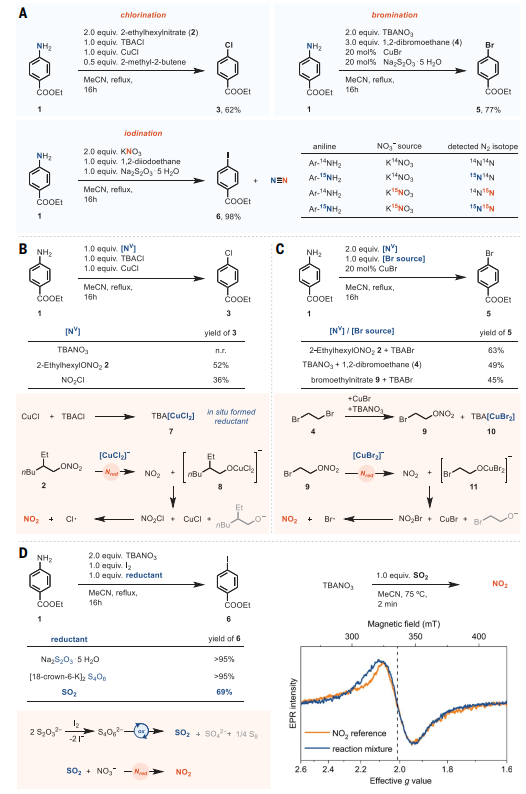
图2. 机理研究。图片来源:Science
在最优条件下,作者对苯胺的底物范围进行了考察(图3),结果显示不同结构和电性的芳烃和杂芳烃(12-50)均能以良好的产率进行硝酸盐还原的脱氨基卤化反应,并且不需要对反应条件进行底物依赖性优化,同时反应使用工业级溶剂、市售原料和试剂,无需惰性气氛、流动设备。此外,由于在反应过程中负责生成NO+的含氮物种(如:NO2)是气态的,因此反应需要在封闭体系中进行。值得一提的是,使用密闭反应容器并不是脱氨基氯化(如:产物19在密闭体系产率为75%,回流时为64%)和脱氨基溴化(如:产物27在密闭体系产率为67%,回流时为78%)的必要条件,但是脱氨基碘化反应则需要密闭体系,这可能是由于高温下SO2在乙腈中的溶解度降低,并且反应器的尺寸和顶部空间体积的变化对反应产率没有明显影响。
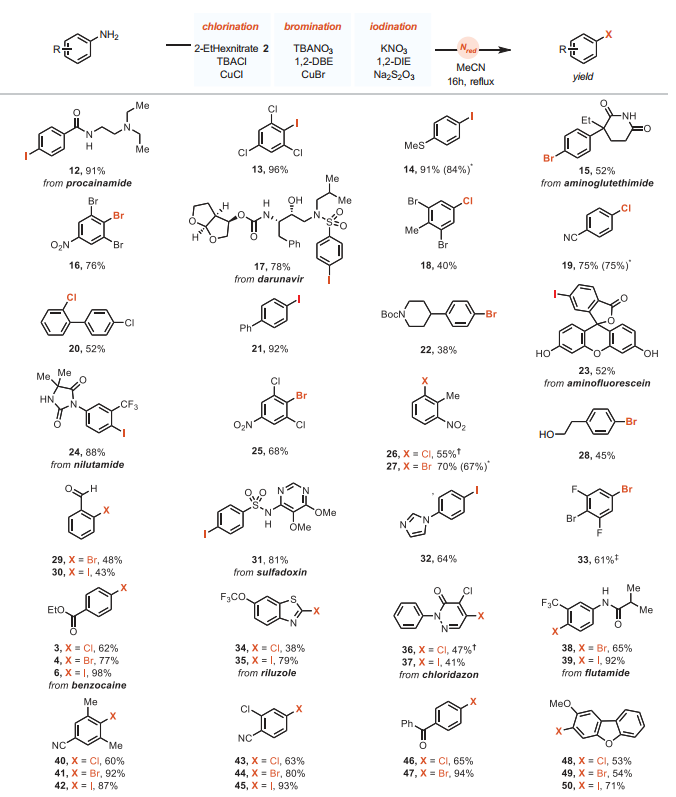
图3. 底物范围。图片来源:Science
在硝酸盐和亚硝酸酯2的存在下,对氧化剂敏感的硫醚骨架也能实现这一转化(14),特别是邻位,邻位-二取代苯胺(13)的脱氨基碘化产率高达96%(图4A)。类似地,氨基杂环或杂环取代的苯胺也能兼容该反应,以47-81%的产率得到相应产物(31、35、36)。与传统重氮化学相比,该方法在危险性和爆炸性方面的改进更加明显(图4B)。尽管邻氨基苯甲酸(51)和间甲基苯胺(53)是本科实验制备重氮的重要底物,但是这两种重氮盐均会引发爆炸,并且吡啶基重氮盐在固态下通常不稳定。此外,由于芳基重氮盐每6个碳原子含有不止一个高能官能团,因此它们被归类为潜在的爆炸性物质并且在干燥时甚至溶液中都会引起爆炸,例如:硝基芳烃57或叠氮化物59。在二硝基取代芳基重氮盐61的案例中,Ciba工厂发生了致命爆炸,造成3人死亡、31人受伤。相比之下,利用硝酸盐还原策略则能有效避免重氮盐的积累,并且无需剧烈反应条件便可直接合成芳基卤化物。
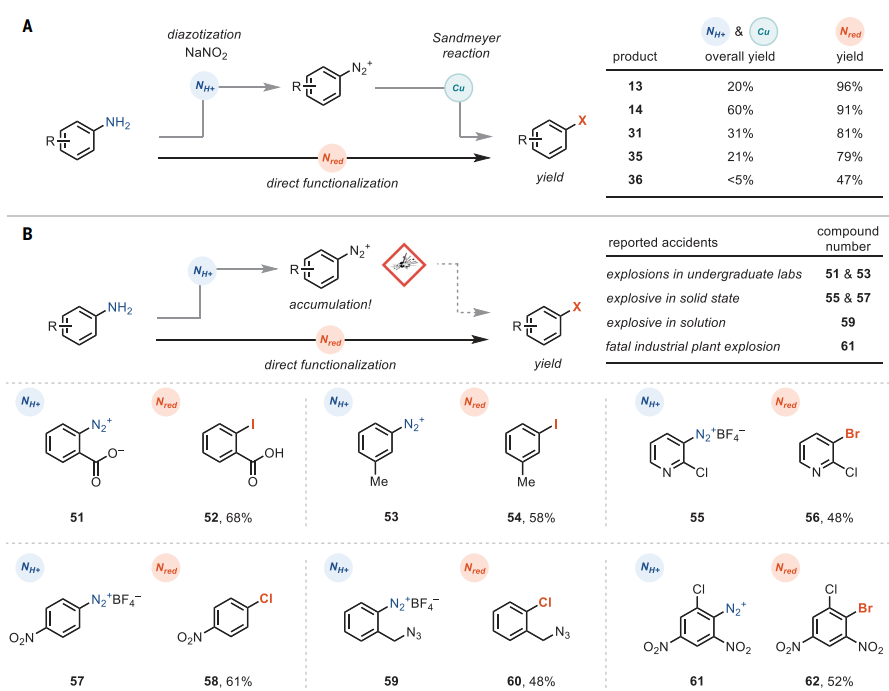
图4. 苯胺的直接卤化。图片来源:Science
总结
Tobias Ritter课题组使用硫代硫酸盐或二卤化铜作为电子供体来实现硝酸盐还原,由于该步骤是速率限速步,因此产生的芳基重氮盐作为瞬态中间体,进而可以一步法将苯胺安全、高效地脱氨基卤化为相应的芳基卤化物。与传统的重氮化学相比,该过程能够避免热失控反应、分离或储存重氮盐的两步序列,同时硝酸盐及其酯更廉价易得并且底物范围更广泛。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Nitrate reduction enables safer aryldiazonium chemistry
Javier Mateos, Tim Schulte, Deepak Behera, Markus Leutzsch, Ahmet Altun, Takuma Sato, Felix Waldbach, Alexander Schnegg, Frank Neese, Tobias Ritter
Science, 2024, 384, 446-452, DOI: 10.1126/science.adn7006
导师介绍
Tobias Ritter
https://www.x-mol.com/university/faculty/50250
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号