微型可拉伸电化学传感器实时监测机械拉伸诱导的囊泡释放
胞吐过程涉及细胞内囊泡膜与细胞膜的融合以及囊泡内容物(如神经递质和激素)的释放,是神经元和分泌细胞发挥其功能的基本生物学事件。作为一种依赖于囊泡膜与细胞膜复杂融合的细胞过程,囊泡胞吐受到胞外微环境中的各种机械力的调控,例如渗透压、膜张力、剪切力等。近年来,越来越多的研究表明,机械刺激可以激活细胞膜上的机械传感器,进而引发细胞内的生化信号通路,如钙响应、囊泡的运输和聚集。然而,机械力是否以及如何影响胞吐过程中囊泡内容物的释放尚不明确。
单细胞电化学方法具有时空分辨率高、灵敏度高等优势,在定量化学信号分子释放和揭示单个胞吐事件动力学信息方面发挥了重要的作用。然而,现有的电化学传感器大多数是刚性硬质电极,难以适应细胞在机械力作用下的变形;新兴的可拉伸电化学传感器具备良好的机械顺应性,在诱导群体细胞及组织形变及同步实时监测方面展现出独特优势。因此,微型可拉伸电化学传感器将是一种在单细胞水平实时监测机械力诱导囊泡胞吐过程的强有力工具。然而,受电极材料和微型化技术的限制,微米尺度的可拉伸电化学传感器还鲜有报道,严重阻碍了对单细胞力学信号转导过程的探究。
近日,武汉大学黄卫华教授(点击查看介绍)和刘艳玲教授(点击查看介绍)团队结合光刻技术和掩膜法,开发了一种简便且高度可控的微米级可拉伸电化学传感器制备策略,通过将单个肾上腺嗜铬细胞培养在微电极表面,拉伸微电极对细胞施加机械形变并同时实时监测儿茶酚胺胞吐释放,首次实现了对拉伸应变诱导的单个细胞的囊泡胞吐事件的实时定量监测。结果表明,该微电极具有优异的结构及机械稳定性,对三种儿茶酚胺(多巴胺、肾上腺素、去甲肾上腺素)的检出限均低至2 μM。随后,该团队将单个肾上腺嗜铬细胞培养在微电极表面,并施加机械拉伸应力,成功实现机械力诱导的胞吐释放实时监测。结果发现,机械拉伸可以通过激活嗜铬细胞的机械敏感通道Piezo1引起Ca2+内流,从而诱导儿茶酚胺胞吐释放;相较于高浓度K+刺激,拉伸应力通过加速融合孔的打开和延长融合孔的关闭,诱导更多的儿茶酚胺分子从囊泡释放。
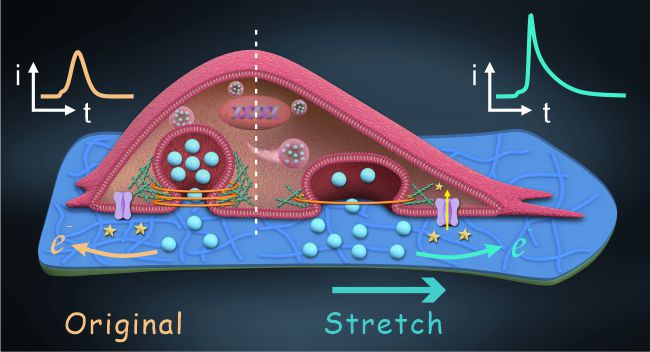
图1. 微电极实时监测拉伸诱导的单个肾上腺嗜铬细胞胞吐释放示意图
这项工作提出了一种利用微尺度可拉伸电化学传感器来研究机械力调控细胞行为和功能的新策略,基于嗜铬细胞取得的结果为理解机械刺激如何调节神经传递和细胞信号提供了新的视角。
这一研究成果近期发表在Angew. Chem. Int. Ed.上,文章的第一作者是武汉大学化学与分子科学学院2019级博士研究生严景,通讯作者是武汉大学化学与分子科学学院刘艳玲教授。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Mechanical Strain Induces and Increases Vesicular Release Monitored by Microfabricated Stretchable Electrodes
Jing Yan, Fu-Li Zhang, Kai-Qi Jin, Jia-Xin Li, Li-Jun Wang, Wen-Ting Fan, Wei-Hua Huang, Yan-Ling Liu
Angew. Chem. Int. Ed., 2024, DOI: 10.1002/anie.202403241
导师介绍
黄卫华
https://www.x-mol.com/university/faculty/13594
刘艳玲
https://www.x-mol.com/university/faculty/276746
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!

















































 京公网安备 11010802027423号
京公网安备 11010802027423号