多肽特异性修饰JACS:高选择性捕获和同时荧光标记N末端为甘氨酸多肽的方法
过去几十年以来,关于多肽中氨基酸侧链及其N/C末端的修饰方法不断涌现,极大地促进了多肽和蛋白修饰物在生物诊断、治疗和蛋白质组学等领域中的应用。然而,由于反应活性的相似性,多肽的N末端氨基的特异性识别和修饰仍然是领域内的难点。通常情况下,当氨基邻位碳上有侧基时,可能辅助实现氨基的识别和修饰。例如,半胱氨酸在与醛基反应时,由于侧链中巯基的参与,特异性地生成了噻唑烷类化合物。然而,在所有天然的氨基酸中,甘氨酸由于不含侧链,其可以区别于其它氨基酸的特异性识别与修饰则显得尤为困难。而另一方面,末端为甘氨酸的蛋白质和多肽是重要的生物识别位点,其修饰对于多种生物过程的研究都有着重要作用。
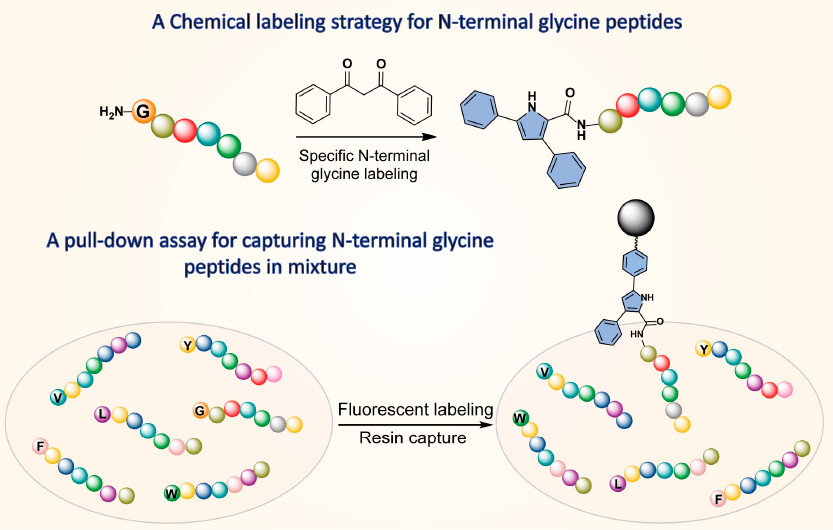
图1. N末端为甘氨酸多肽的荧光标记及特异性识别示意图。图片来源:J. Am. Chem. Soc.
近日,四川大学和德克萨斯大学奥斯汀分校的研究人员报道了一种基于多肽中N末端甘氨酸的α-亚甲基碳与1,3-二酮的“双重活化”反应,实现了N末端为甘氨酸的多肽的特异性修饰(图1)。具体而言,末端氨基首先与其中一个羰基发生缩合生成亚胺(图2,Step A),接下来甘氨酸酰胺的羰基会发生烯醇式异构(Step B),并发生环化反应及脱水(Step C和D),进一步经过异构化可得到最终的吡咯(Step E)。作者最开始使用甘氨酸甲酰胺的盐酸盐与1,3-二苯基-1,3-丙二酮作为模板反应原料来测试反应的可行性,并通过核磁、质谱和X-射线单晶衍射等方法证实了吡咯的生成,且产物2,5-二苯基吡咯在367 nm处给出了强的荧光。由于生成吡咯依赖于α-亚甲基结构,因此该方法对于除了甘氨酸外的其它19种天然氨基酸(含有α-次甲基)并不适用,进而实现了其特有的选择性。
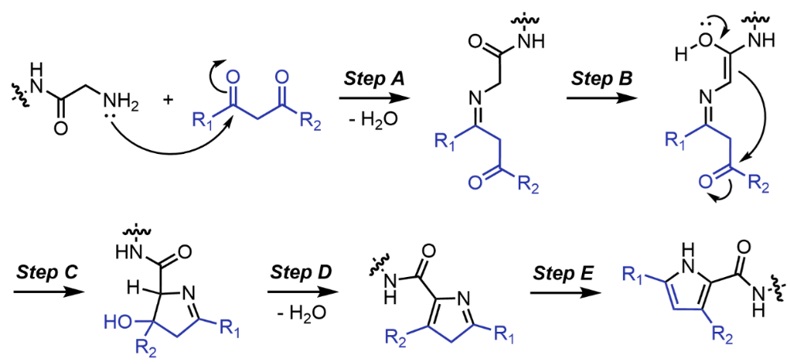
图2. 利用1,3-二酮对多肽N末端的甘氨酸进行修饰的反应机理。图片来源:J. Am. Chem. Soc.
作者接下来将该方法用于一系列末端含有甘氨酸的多肽的修饰(图3),证明了当肽链中含有酪氨酸(Y)、赖氨酸(K)、丝氨酸(S)、谷氨酸(E)、天冬氨酸(D)、甲硫氨酸(M)、谷氨酰胺(Q)等具有特殊侧链的氨基酸时,仍然可以取得良好的修饰效果。需要指出的是,含有半胱氨酸(Cys)的多肽可以在使用碘代乙酰胺对巯基进行保护后再参与反应,最终得到目标的吡咯产物;而赖氨酸(Lys)的侧链氨基虽然在一开始可以与1,3-二苯基-1,3-丙二酮反应生成亚胺,但该副产物可以在酸性介质中水解,最终转化为目标产物。此外,作者也使用了N末端为赖氨酸和缬氨酸的多肽对于该方法的选择性进行验证,最终只得到了相应的亚胺产物,进一步证明了该方法对于甘氨酸的特有修饰效果。
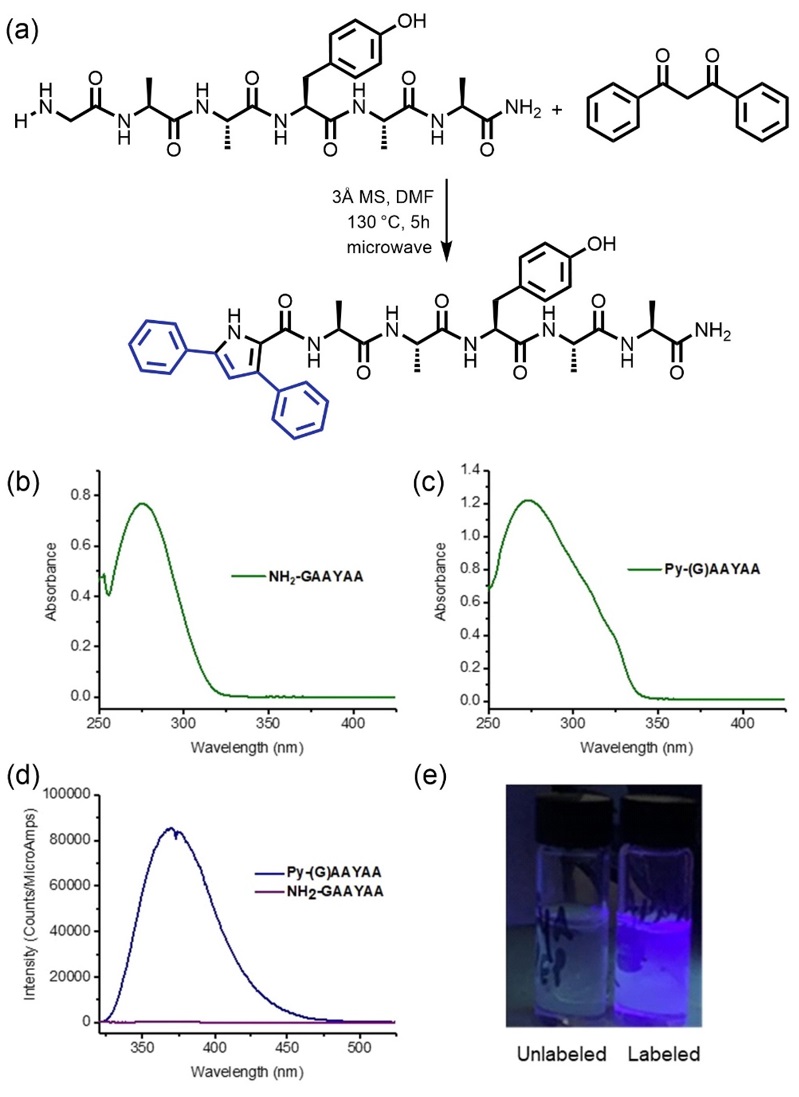
图3. 多肽H2N-GAAYAA的修饰反应及相关的吸收光谱和荧光测试。图片来源:J. Am. Chem. Soc.
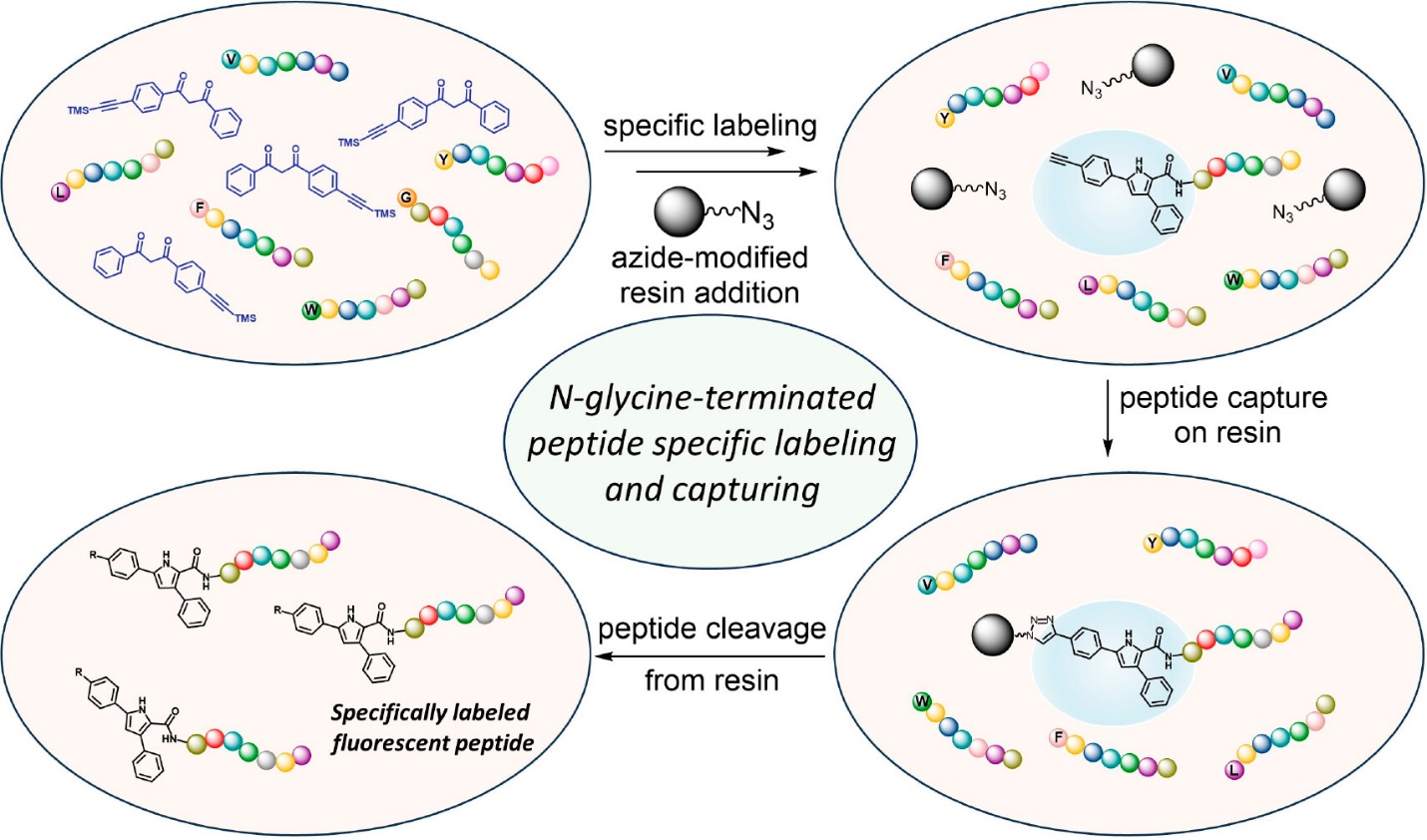
图4. 混合物中末端为甘氨酸的多肽的特异性修饰和捕获示意图。图片来源:J. Am. Chem. Soc.
最后,作者利用有炔基修饰的1,3-二酮与含氮末端为甘氨酸(G)、苯丙氨酸(F)、缬氨酸(V)、色氨酸(W)、亮氨酸(L)和酪氨酸(Y)的混合物进行反应(图4)。通过使生成的亚胺在酸性条件下水解后,再利用叠氮修饰的树脂珠粒进行“拉下实验”,可以将N末端为甘氨酸的多肽特异性地修饰和提取出来。该实验表明上述方法可以被用于混合物中N末端含有甘氨酸的多肽的特异性荧光修饰和捕获,为该类多肽的识别提供了一种有效的方法。
该成果于近期发表在J. Am. Chem. Soc.上。论文的第一作者为四川大学的刘洪煦副研究员和德克萨斯大学奥斯汀分校的Harnimarta Deol博士,通讯作者为美国艺术与科学院院士、德克萨斯大学奥斯汀分校的Eric V. Anslyn教授。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A Method for Rigorously Selective Capture and Simultaneous Fluorescent Labeling of N-Terminal Glycine Peptides
Hongxu Liu, Harnimarta Deol, Ava Raeisbahrami, Hadis Askari, Christopher D. Wight, Vincent M. Lynch, and Eric V. Anslyn*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c04141
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!

















































 京公网安备 11010802027423号
京公网安备 11010802027423号