JACS:光酶催化不对称合成高度立体选择性的α-三级氨基酸
非天然氨基酸(ncAA)在多个领域具有举足轻重的价值。例如,用作手性配体和有机小分子催化剂,作为研究生物催化反应机理的分子探针等等。蛋白来源的天然氨基酸均为α-二级氨基酸,是目前研究最为广泛的氨基酸类型。α-三级氨基酸具有一些α-二级氨基酸无法比拟的性质,例如,蛋白质中引入α-三级氨基酸通常可以增强代谢稳定性并提高结构的刚性,从而提高蛋白的稳定性等。不对称合成α-三级氨基酸一直是合成化学界关注的重点研究方向之一。在此前的报道中,过渡金属催化结合手性配体以及仿生催化等是常用的策略。然而,这些策略均不可避免对胺基或羧基进行保护和脱保护,从而增加了合成路径的工作量和难度。
普林斯顿大学的Todd Hyster(点击查看介绍)研究团队一直致力于发展新型不对称光酶催化反应,以解决有机合成中的重要挑战。在近期的研究中,Hyster团队报道了一例光催化剂和酶的协同催化反应,利用L-苏氨酸醛缩酶(L-Threonine Aldolases, LTAs)高度对映选择性地合成了一系列α-三级氨基酸(图1C)。机理研究表明,反应涉及酶-光催化剂-底物的三元复合物。
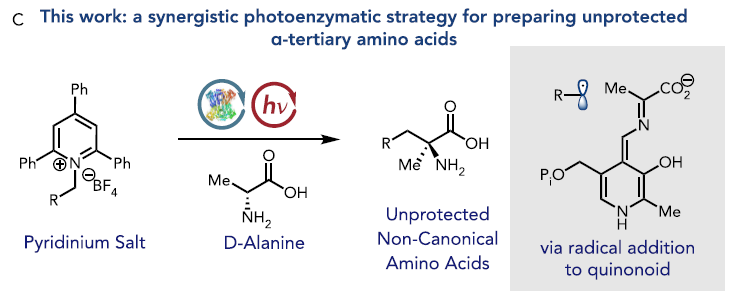
图1C. 反应设想。图片来源:JACS
酶作为一类天然的手性催化剂,在控制立体选择性方面有着独特的优势。近年来,随着定向进化技术的迅速发展,越来越多的生物催化手性合成方法学被报道。LTAs是一种5-磷酸吡哆醛(PLP)依赖的缩合酶,该类酶天然利用甘氨酸,丙氨酸和苏氨酸作为反应底物,通过与醛类底物缩合得到β-羟基-α-氨基酸类化合物。LTAs催化活性依赖于底物和酶口袋中的赖氨酸缩合反应,经过脱质子形成关键中间体Quinonoid,这是一个富电子的稳定中间体,在天然反应中作为亲核试剂。Hyster研究团队受到烯胺和烯醇反应性的启发,提出如下设想:Quinonoid中间体可以作为一个SOMOphile,当自由基在酶口袋附近生成,如果能够迅速被稳定的Quinonoid捕捉,就能介导形成碳碳键(图1C)。由于LTAs只有一个暴露在溶剂中的前手性面,另一面被酶的氨基酸残基屏蔽,因此,由LTAs介导形成的碳碳键会获得非常高的立体选择性。
首先,作者从LTAs 家族中选择了Thermotoga maritima来源的热稳定酶TmLTA作为反应的起始催化剂,以D-丙氨酸作为Quinonoid 供体,Rose Bengal(下文简称RB)作为外源光催化剂,基于设计的机理,作者首先考察了一系列还原活性的自由基前体化合物,最终发现以烷基胺来源的Katritzky吡啶盐(下文简称KS)作为自由基前体可以产生65% L-构型的氨基酸产物,并且可以得到近乎单一的立体选择性,er>99:1 (图2)。然而在反应优化过程中,作者发现反应的产率随酶储存时间变化较大。作者猜想这可能是由TmLTA四聚体的不稳定性导致。根据先前报道的对该酶结构的研究信息得知,第86号色氨酸(W86)位于酶两个单体的界面处,将其突变为谷氨酸(E)可以通过与另一个单体的第120号精氨酸(R120)形成盐桥作用,从而增强酶的稳定性。突变体TmLTA-W86E最终以稳定可重复的90%分析收率得到产物,er > 99:1。
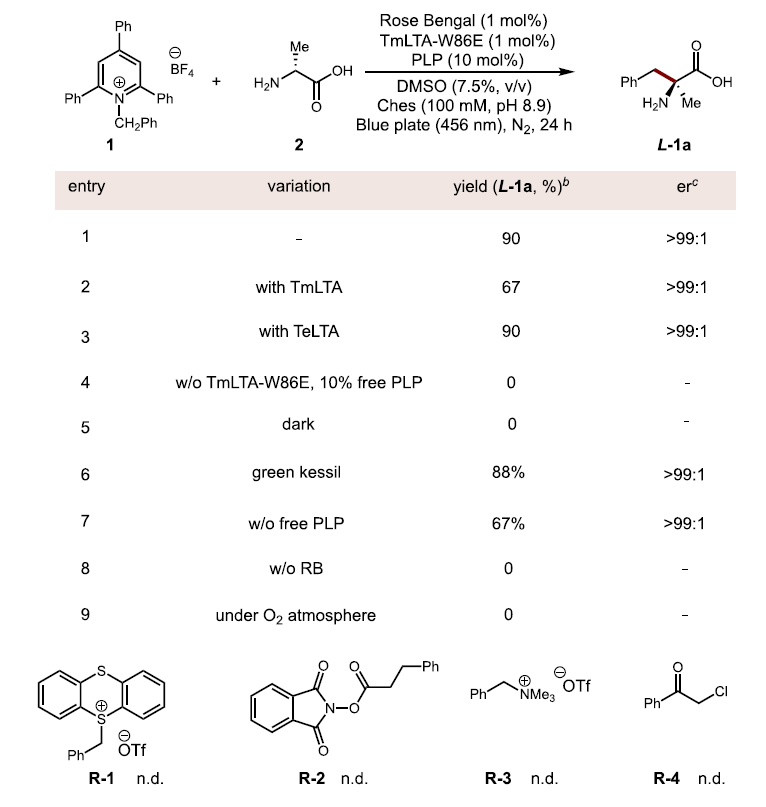
图2. 反应条件优化。图片来源:JACS
值得注意的是,作者发现由于Quinonoid 中间体在光照条件下不稳定,该反应需要添加10 mol% PLP。额外补充的PLP有利于反应持续高效进行,且PLP本身不催化背景反应,不影响反应的立体选择性。除了TmLTA-W86E,作者在筛选中发现Aeromonas tecta来源的TeLTA给出了与TmLTA-W86E相当的产率和选择性,并且该酶的表达量远高于TmLTA-W86E。因此,条件筛选最终得到TmLTA-W86E和TeLTA两种催化剂。

图3. α-三级氨基酸底物范围。图片来源:JACS
基于上述最优反应条件,作者考察了LTA催化ncAA合成反应的底物普适性(图3)。吡啶盐底物苯环上不同位置和不同电性的取代基 (2a-12a),例如p-OCF3、p-CF3、m-Cl、m-Me、o-F和萘环都可以很好的兼容,给出49-94%收率和单一的立体选择性(>99:1 er)。若将苯环替换为吡啶,尽管收率有所下降(13a, 18%),但是依旧获得了单一的立体选择性(>99:1 er)。除了苄基吡啶盐类底物,非苄基的吡啶盐自由基前体没有任何反应活性。经过筛选发现,当使用相应的硫鎓盐可以有效得到产物和高度的对映选择性(14a, 15a)。除了D-alanine,当使用甘氨酸作为氨基供体,相应的α-二级氨基酸也可以被高效率和高选择性地制备(图4)。更令人惊喜的是,以模板底物为例,作者使用TeLTA酶冻干粉进行大量实验进一步说明了该反应的潜在价值。2 mmol反应规模最终以46%分离收率和大于99:1 er得到高度光学纯的氨基酸产物。
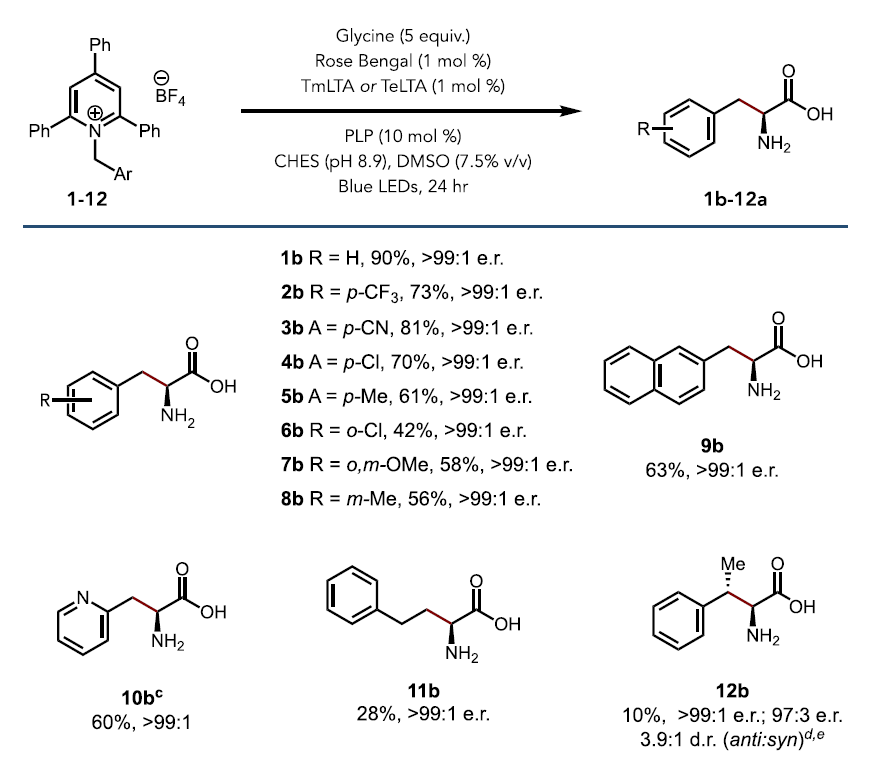
图4. α-二级氨基酸底物范围。图片来源:JACS
最后,作者对反应机理做了详细的探索(图5)。Stern-Volmer实验中发现,KS和RB之间存在非线性淬灭关系,表明这是一个静态淬灭机理而非扩散控制的淬灭过程,即KS和RB催化剂在溶液中先形成了复合物,再发生相应的电子转移从而引发自由基生成。单独将酶和光催化剂RB混合并没有观察到明显的淬灭现象。作者随后进行了深入的光谱学研究。当TmLTA-W86E或者底物KS加入到RB溶液时,均会引起RB的紫外吸收发生红移。将TmLTA-W86E-RB-KS三组分混合,可以观测到一个全新的紫外吸收信号。仅混合TmLTA-W86E和底物KS,并不会得到新的吸收信号。这些实验现象表明,酶-RB-KS形成了一个三元复合物。此外,荧光各相异性实验测得RB和TmLTA-W86E之间的解离常数KD为76 μM,表明酶和外源光催化剂具有弱相互作用。作者还结合分子对接考察了RB在酶口袋或者表面的可能结合区域。结果表明,RB结合在靠近口袋的正电荷区域具有最低结合能。综合上述机理实验,作者阐明了LTA参与的光酶协同催化中自由基引发和选择性碳碳键形成过程。光催化剂RB介导了酶和底物KS之间的相互作用,在反应中形成酶-RB-KS三元复合物,由此确保自由基在靠近活性中间体Quinonoid的区域生成,从而实现高度专一的碳碳键形成。
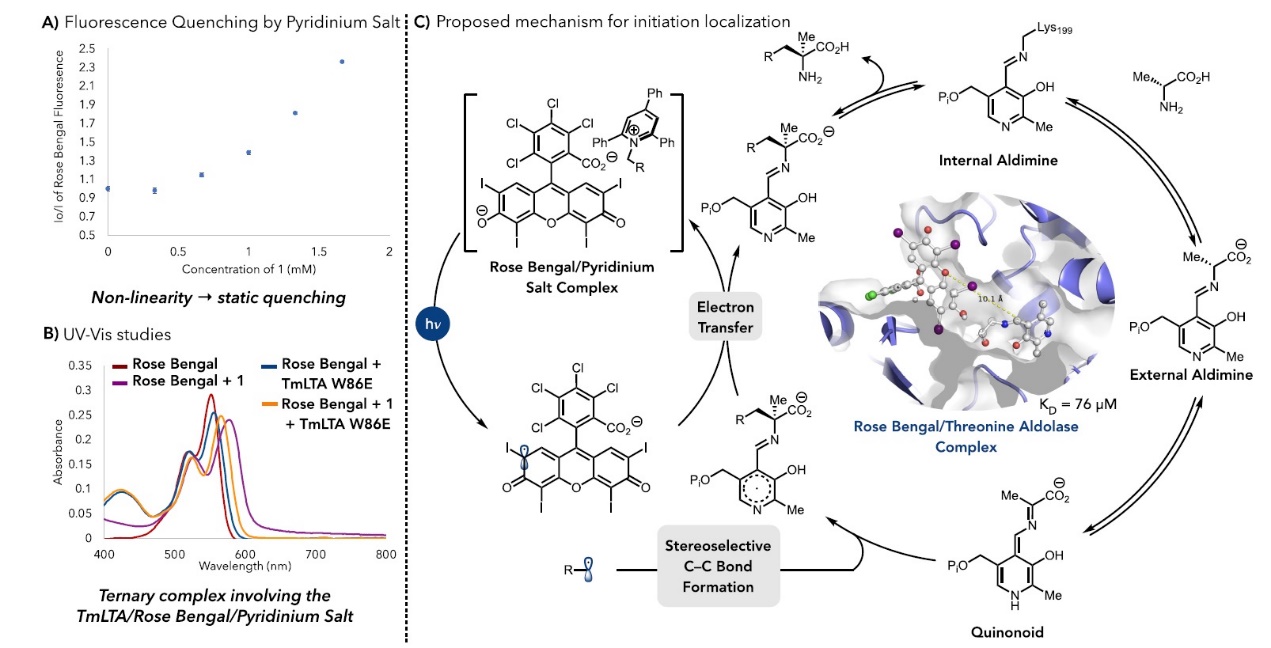
图5. 机理研究。图片来源:JACS
综上,Hyster团队报道了L-苏氨酸醛缩酶和光催化剂Rose Bengal之间的协同催化作用,从D-丙氨酸或甘氨酸和相应的Katritzky吡啶盐或硫鎓盐出发,高效和高选择性制备了一系列非天然氨基酸。作者结合光谱学,Stern-Volmer淬灭实验,荧光各向异性实验以及分子对接揭示了独特的酶-外源光催化剂-底物三元复合物的形成。该研究不仅为α-三级氨基酸的合成提供了新策略,也为其他光酶协同催化反应的设计和机理研究奠定了基础。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Synergistic Photoenzymatic Catalysis Enables Synthesis of a-Tertiary Amino Acids Using Threonine Aldolases
Yao Ouyang, Claire G. Page, Catherine Bilodeau, and Todd K. Hyster*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c04661
导师介绍
Todd Hyster
https://www.x-mol.com/university/faculty/379545
(供稿人:欧阳瑶)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
Science:光酶协同催化,选择性合成非天然氨基酸 2023-08-07
-
杨扬/刘鹏团队Nature:光酶催化氧化交叉偶联构建手性氨基酸 2024-05-08
-
Nat. Catal.:光酶协同催化的对映选择性脱羧烷基化 2024-01-06
-
Science:光照加持,烯还原酶“客串”催化不对称自由基环化 2019-07-03
-
Nat. Chem.:光酶催化控制氮自由基,酶催化的不对称自由基氢胺化反应 2022-11-15
-
Linkage-Specific Synthesis of Di-ubiquitin Probes Enabled by the Incorporation of Unnatural Amino Acid ThzKHan Zhou, Tomaya Carpenter, Xuan Fu, Bo Jin, Britton Ody, Mohammad Sazid Hassan, Savannah E. Jacobs, Jenny Cheung, Eve M. Nicholson, Mark Turlington, Bo Zhao, Sonja Lorenz, T. Ashton Cropp, Jun Yin


































 京公网安备 11010802027423号
京公网安备 11010802027423号