复旦大学侯军利课题组Nat. Chem.:构筑细胞间人工间隙连接通道
随着基因技术和合成生物学技术的快速发展,人工合成细胞已成为现实,为人工合成组织甚至人工合成生命提供了可能。在生物体内,细胞不仅可以与其周围环境进行细胞内外的交流,而且还可以与相邻细胞进行细胞间的物质和信号传递,从而维持同一组织内细胞环境的稳定及功能的一致性。由于细胞膜的隔离作用以及细胞间存在着4-20 nm的间隙,因此,物质和信号无法直接在相邻细胞间进行传递。经过长期的进化,生物体发展了一种被称为间隙连接通道 (Gap junctional channel) 的蛋白,这类蛋白可以将相邻的细胞连接起来,形成跨细胞间隙的通道,从而介导细胞间物质和信号的传递。在体外,这类蛋白的规模化制备以及与细胞膜的整合还存在很大的挑战,限制了它们在人工合成细胞方面的应用。
利用人工合成体系来仿生通道蛋白的结构与功能,不仅为人工合成细胞甚至人工合成生命提供新的模块和新的途径,而且还将为发展新型的药物分子及分离纯化膜材料提供了新策略和新基元。在过去四十年内,化学家通过仿生通道蛋白的结构与功能,构筑了人工跨膜通道、人工载体和人工信号传递体,已经实现了细胞内外物质和信号的传递。但是,目前还未能构筑人工间隙连接通道实现细胞间物质和信号的传递,其主要的难点在于如何构筑足够长的管状分子,使其能够跨越细胞间隙,形成稳定的通道结构。近日,复旦大学化学系侯军利(点击查看介绍)课题组通过仿生天然间隙连接通道蛋白的结构,采用“自下而上”的策略,结合共价合成与非共价组装,从头设计、合成了长度可达10.8 nm的人工间隙连接通道,实现了相邻细胞间的连接以及信号、物质通讯。相关论文发表于Nature Chemistry。
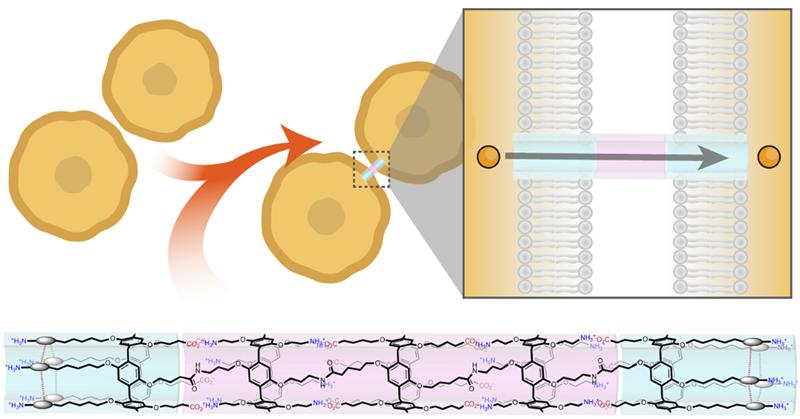
图1. 人工间隙连接通道形成示意图。图片来源: Nat. Chem.
他们以分别带有正、负电荷的柱[5]芳烃为基本构筑模块,合成了正、负电荷交替排列的柱[5]芳烃五聚体和三聚体。这类柱[5]芳烃寡聚体在静电作用的驱动下组装形成单分子管状结构,其结构具有两端疏水、中间亲水的特点。这类管状可以很好的与相邻细胞膜的亲疏水环境匹配,从而自发的嵌入至相邻的细胞膜。在该通道中,两端疏水的部分嵌入至细胞膜内,形成跨膜部分,而中间亲水的部分则位于细胞间隙,作为胞外部分。
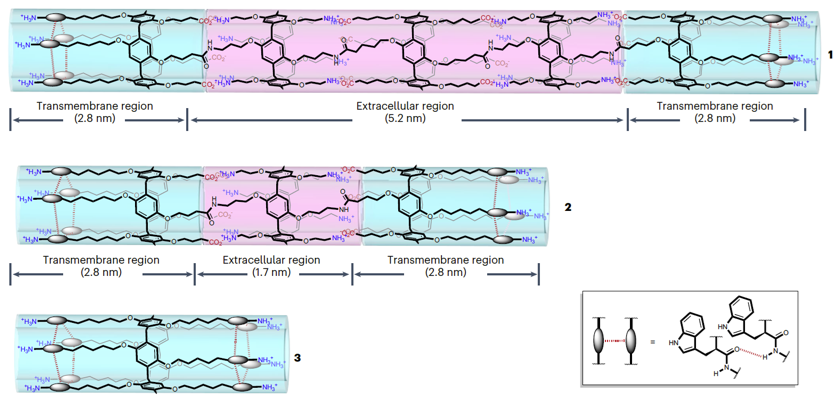
图2. 人工间隙连接通道的分子结构。图片来源: Nat. Chem.
将这些间隙连接通道与磷脂囊泡混合后,这些通道的两端通过嵌入至囊泡的脂双层膜内,从而诱导囊泡聚集。将这些通道分子进行荧光标记,荧光显微镜观察显示,这类间隙连接通道分子倾向于位于相邻囊泡间脂双层接触处,而对照化合物柱[5]芳烃单体分子则倾向于均匀分布于脂双层膜内,从而直观证实了人工间隙连接通道分子在相邻脂双层膜间的分布。
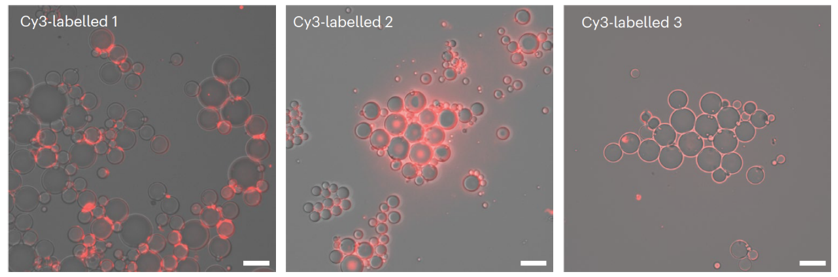
图3. 人工间隙连接通道在膜内分布图。图片来源: Nat. Chem.
进一步他们以磷脂囊泡为细胞模型,考察了这些人工通道分子介导囊泡-囊泡间以及囊泡-细胞间离子传输的性能。他们发现,在间隙连接通道分子存在的条件下,离子能够快速、高效的在囊泡-囊泡间以及囊泡-细胞间进行传输。他们发现,离子传输性能与囊泡的体积有关。当使用大体积的囊泡时,溶液中囊泡运动能力有限,长度更长的通道分子具有较大的几率与相邻较远的囊泡接触,因此展现出较高的离子输送性能。当使用小体积的囊泡时,囊泡运动自由度较大。在此情况下,长度小的分子具有更稳定的通道结构,从而展现出较高的输送性能。离子传输动力学研究还揭示,这类分子在相邻膜间形成的是单分子通道,从而证实了人工间隙连接通道形成的机理。另外,他们还通过基于平面脂双层的电流测试实验证实,在脂双层膜内,这类分子可以形成跨膜通道。通过电流信号强度计算出的通道分子长度与理论计算值可以很好的吻合,进一步证实了管状分子的形成。
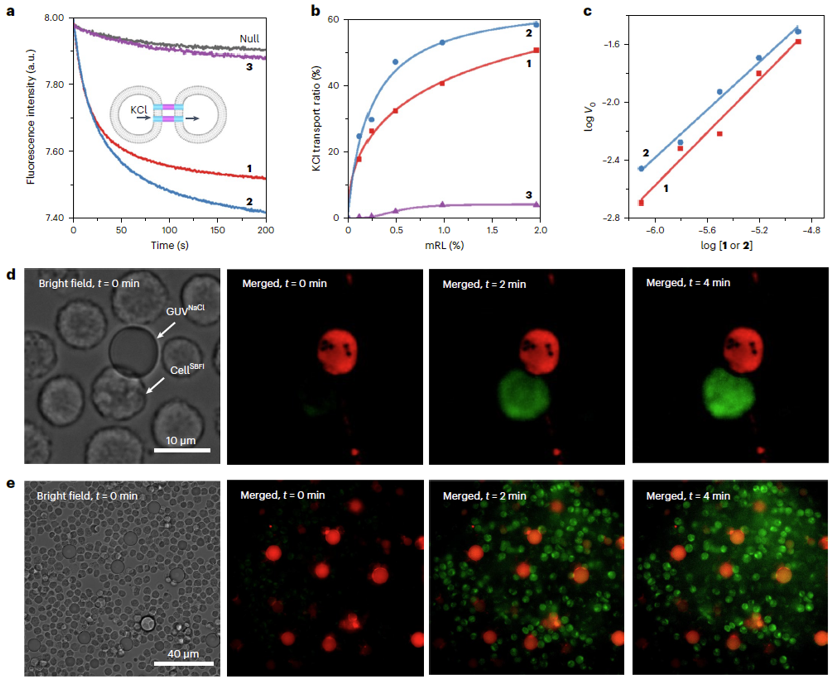
图4. 人工间隙连接通道介导囊泡-囊泡间以及囊泡-细胞间离子传输。图片来源: Nat. Chem.
更重要的是,他们还通过基于细胞对的全细胞膜片钳实验观察到了人工间隙连接通道介导的细胞间信号耦合。他们将不表达天然间隙连接通道的细胞与人工间隙连接通道共孵育,通过微电极在一个细胞内注入电流刺激信号,在另一相邻细胞内检测到了电信号,证实人工间隙连接通道介导了离子在这相邻两细胞间进行传输,从而为人工间隙连接通道的形成提供了直接证据。另外,他们还通过系统的细胞实验证实,这类利用人工间隙连接通道,还可以实现细胞间的活性氧 (ROS) 传输,从而增强抗肿瘤药物的活性,展现出了较好的生物活性。
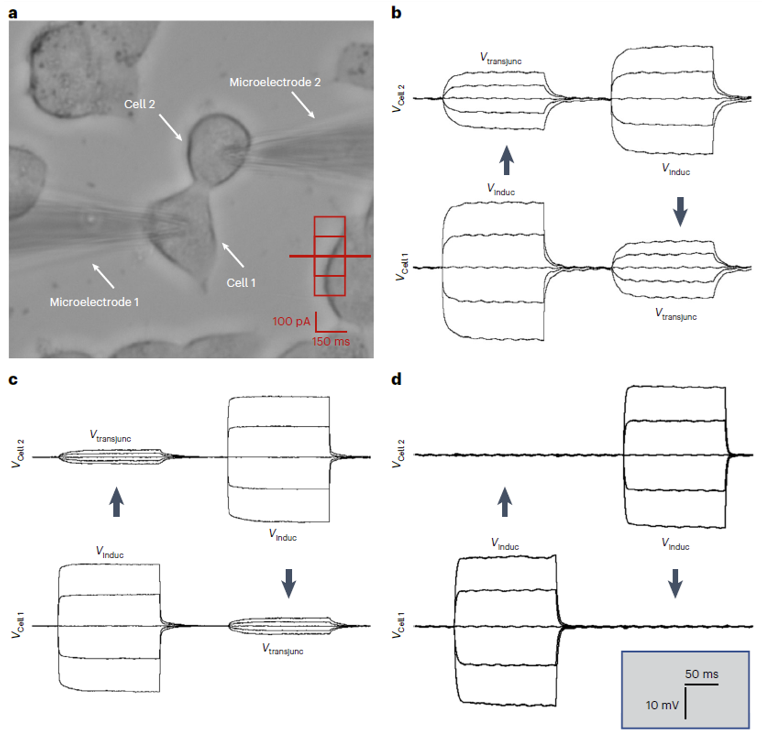
图5. 人工间隙连接通道介导细胞间信号耦合。图片来源: Nat. Chem.
小结
复旦大学侯军利课题组通过仿生天然间隙连接通道蛋白的结构,利用静电作用驱动组装构筑了具有“疏水-亲水-疏水”三嵌段结构的单分子管,这类管状分子可以自发嵌入相邻两细胞膜,形成人工间隙连接通道,从而介导细胞间信号传递和物质输送,表现出了良好的生物活性。
该工作为复旦大学化学系2018级直博生傅永鸿经过了研究生和博士后阶段的连续工作完成,并得到了课题组胡逸飞、林涛、庄国伟、王樱岚等同学以及陈文学老师和黎占亭老师的协助。该工作得到了科技部重点研发项目、国家基金委、上海市科委和复旦大学的经费资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Constructing artificial gap junctions to mediate intercellular signal and mass transport
Yong-Hong Fu, Yi-Fei Hu, Tao Lin, Guo-Wei Zhuang, Ying-Lan Wang, Wen-Xue Chen, Zhan-Ting Li, Jun-Li Hou*
Nat. Chem., 2024, DOI: 10.1038/s41557-024-01519-8
导师介绍
侯军利
https://www.x-mol.com/university/faculty/9717
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!

















































 京公网安备 11010802027423号
京公网安备 11010802027423号