口服多肽药物的前药策略
口服多肽药物的临床开发受制于其不利的一些理化性质,如分子大小、电荷、稳定性等,这些性质阻碍了它们通过肠粘膜等生物屏障。此外,口服多肽还面临酶降解的挑战,稳定性大受影响。天然多肽的许多结构特征,例如 N 端氨基和 C 端羧基、侧链羧基、氨基和羟基使其可以被生物体内的多种蛋白酶识别,在抵达系统循环之前便被降解,可谓“出师未捷身先死”。
针对这些不利于多肽口服制剂的内在问题,前体药物(prodrug)策略已成功地用于暂时性地改变药物的理化性质,改善其代谢不稳定性。前体药物也称前药、前驱药,是指在生物体内经化学反应或酶作用转化后才变为活性药物成分的药物代理分子,本身属于一种药理惰性物质。也就是说,前体药物本身没有生物活性或活性很低,经过体内代谢后变为有活性的物质。这一策略的目的在于增加药物的生物利用度,加强靶向性,降低药物的毒性和副作用。
去氨加压素desmopressin是抗利尿激素加压素vasopressin的合成类似物,主要用于治疗夜尿症和尿崩症等泌尿系统类疾病。去氨加压素的酯类前体药物通过酪氨酸侧链的酚羟基脂化产生。这些衍生物通过人血浆中的酶水解定量地转化为去氨加压素(图1)。[1] 与去氨加压素相比,其新戊酸前体药物跨 Caco-2 细胞单层的转运明显更高效。
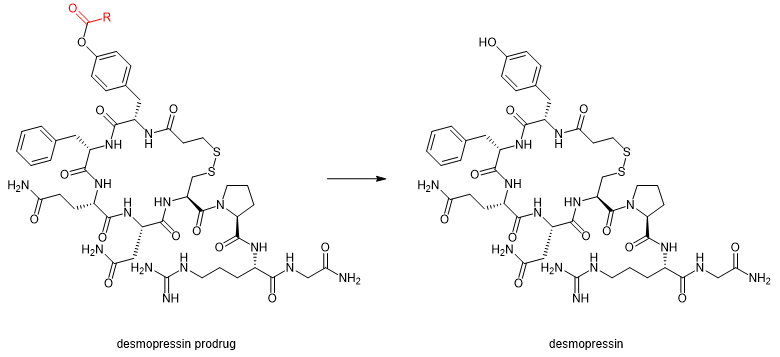
图1. 去氨加压素前体药物
多肽的生物可逆环化是肽前体药物开发中最有前途的新方法之一。肽骨架的环化减少了多肽分子的两个极性基团——N端氨基与C端羧基,增强了分子内氢键的程度,并降低了与水性溶剂形成的分子间氢键的可能性。潜在氢键的减少可能增加肽穿过肠粘膜的渗透性。[2]
在一项研究中,利用H-Trp-Ala-Gly-Gly-Asp-Ala-OH的环肽前体药物对于环状酯的酶敏感性,研究者开发了将 N 端氨基与 C 端羧基通过酰氧基烷氧基连接的前体药物1和 3-(2'-羧基-4',6' -二甲基苯基)-3,3-二甲基丙酸连接的前体药物2。这些环状前体药物对酯酶代谢敏感(缓慢步骤),会在体内开环,并释放线性多肽药物。[3] 在 37 °C 的 pH 7.4 缓冲液中,两种环状前体药物均定量降解为线性六肽。在人血浆中,环状前体药物 1 和 2 的水解速度明显比在缓冲液中更快。与线性六肽相比,两种环肽前体药物在生物环境(例如人血)中的代谢稳定性明显更高,而且两种环肽前体药物在体外细胞培养模型下的肠粘膜透过率比线性肽增强了70倍。

图2. H-Trp-Ala-Gly-Gly-Asp-Ala-OH的环肽前体药物作用机理。图片来源:Adv. Drug Delivery Rev. [3]
洛匹那韦(LVR, Lopinavir)是一种蛋白酶抑制剂类的抗逆转录病毒药物。洛匹那韦与另一种蛋白酶抑制剂利托那韦(洛匹那韦/利托那韦)以固定剂量的复方药配方用于抗HIV感染。
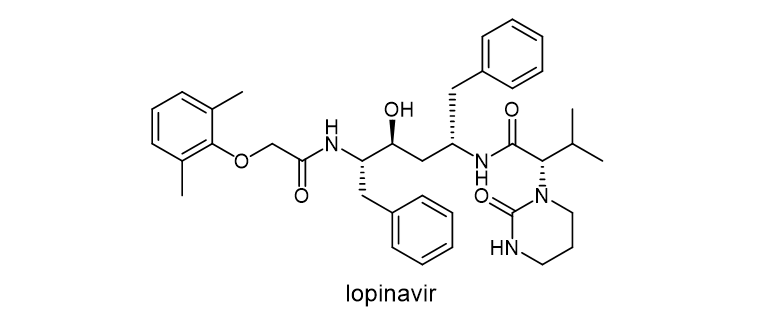
图3. 洛匹那韦化学结构
洛匹那韦在体内被细胞色素P450 3A4酶(CYP3A4)强力代谢,并受 P-gp 和 MRP2 等膜外排泵作用而被阻止进入细胞。为了避免洛匹那韦的首过代谢和外排,其两种衍生物,valine-valine-lopinavir (VVL) 和glycine-valine-lopinavir (GVL),作为多肽前体药物进行了对比试验。二肽Val-Val和Gly-Val分别被连接到洛匹那韦的侧链羟基,形成了VVL 和GVL多肽前体药物。[4]
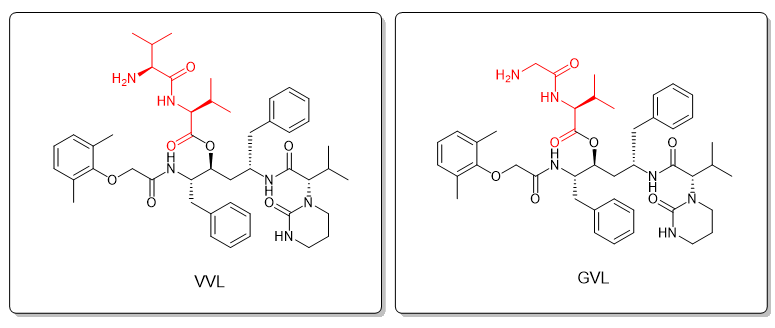
图4. 洛匹那韦 (LVR) 多肽前体药物VVL与GVL。
在 Caco-2 细胞匀浆中的酶稳定性研究表明,肽前体药物首先转化为酯中间体(氨基酸前体药物 VL),然后最终转化为母体药物LVR。与母体药物 LVR 相比,VVL 和 GVL 都表现出更好的溶解度、代谢和肠道渗透性特征。由于这些前体药物是肽转运蛋白的底物,它们可以绕过外排泵以提高口服生物利用度。这个优势也可能降低 LVR的慢性暴露而产生抗药性的几率。因此,LVR 的多肽前体药物介导的有效递送可以提高治疗效果,这在 HAART(高效抗逆转录病毒疗法)中具有很高的临床意义。采用 LVR 的肽衍生物的前体药物方法可能成为有效的策略,以优化LVR的药代动力学特征。
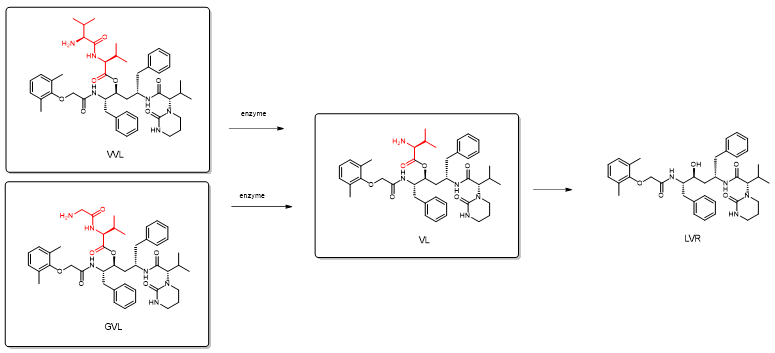
图5. 多肽前体药物VVL与GVL体内再生洛匹那韦 (LVR)的反应过程。
总结
相对于对多肽药物结构永久性的更改,多肽前体药物策略着重于暂时性地改变肽分子的结构,以此改变分子的理化性质和代谢表现,从而增加肠粘膜的渗透性以及提高分子的代谢稳定性。随着对多肽药物口服制剂研发的热情高涨,多肽前体药物策略也必将迎来新的发展阶段,以推动实现多肽药物口服制剂的终极目标。
参考资料:
[1] A.H. Kahns, A. Buur, H. Bundgaard. Prodrugs of peptides. 18. Synthesis and evaluation of various esters of desmopressin (dDAVP). Pharm. Res. 1993, 10, 68-74.
[2] R.A. Conradi, A.R. Hilgers, N.F.H. Ho, P.S. Burton. The influence of peptide structure on transport across Caco-2 cells. II. Peptide bond modification which results in improved permeability. Pharm. Res., 1992, 9, 435-439.
[3] Giovanni M.Pauletti et al. Improvement of oral peptide bioavailability: Peptidomimetics and prodrug strategies. Adv. Drug Delivery Rev. 1997, 27, 235-256.
[4] Sheetal Agarwal et al. Peptide prodrugs: Improved oral absorption of lopinavir, a HIV protease inhibitor. Int. J. Pharm. 2008, 359, 7-14.
(本文由北纬55°供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号