中山大学王红胜课题组Angew:小分子诱导及可光控的RNA m¹A编辑工具
N1-甲基腺苷(m1A)修饰是存在于多种RNA上的甲基化修饰,参与调控RNA的细胞定位、剪切、降解速率以及翻译活性等多项生物学功能。m1A修饰是动态可逆过程,由m1A甲基转移酶复合体(TRMT61A-TRMT6)和m1A去甲基化酶(如ALKBH3)共同调控。目前,研究m1A修饰生物学功能最常用的方法是直接在细胞内过表达m1A修饰相关酶,其会影响细胞内总m1A修饰水平,无法针对特定RNA的m1A修饰进行功能研究。为了实现靶向m1A编辑,已有研究将m1A去甲基化酶ALKBH3与dCas13b融合,得到可以针对特定mRNA m1A去甲基化的编辑工具。该工具虽然能够特异性靶向目标RNA,但无法实现对m1A修饰的实时调控。为了深入研究m1A修饰的生物学功能,开发可控可逆的特异性m1A编辑工具是亟待解决的重要科学问题。
近日,中山大学药学院王红胜课题组在国际知名期刊Angewandte Chemie International Edition 在线发表研究论文,综合利用了CRISPR/dCas13b系统和化学诱导临近(Chemically Induced Proximity, CIP)技术,开发了一款能够靶向特定RNA转录本进行实时调控m1A修饰的编辑工具(ABA-inducible demethylation tool, AI-dm1A)。
Cas13b是CRISPR的Type VI家族蛋白,能够与gRNA结合并靶向特定RNA。对Cas13b的酶切活性位点进行突变得到只有gRNA结合活性的dead Cas13b(dCas13b),从而获得RNA靶向元件。而CIP技术是利用小分子化合物调控特定基团的空间位置关系的方法,最为常见的就有ABA-PYL/ABI体系。植物蛋白PYL和ABI在脱落酸(abscisic acid, ABA)存在的情况下会形成二聚体,从而使其融合的蛋白相互接近并产生生物学作用。该研究分别构建dCas13b-PYL和ALKBH3-ABI融合蛋白表达质粒,得到了ABA诱导的m1A去甲基化工具AI-dm1A。使用AI-dm1A工具结合MALAT1的特异性gRNA,成功实现ABA调控MALAT1 m1A的去甲基化,并进一步揭示了m1A对MALAT1 RNA表达的负调控作用。而在ABA处理细胞后移除ABA处理,可以使得MALAT1的m1A修饰水平回升,说明了该工具诱导的m1A去甲基化具有可逆的特性。
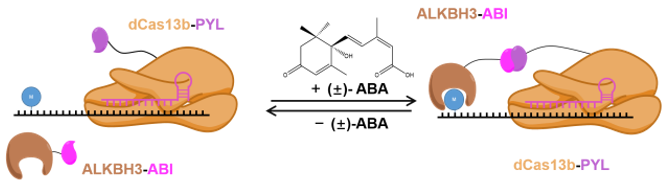
实时调控m1A修饰的编辑工具AI-dm1A示意图
研究人员进一步使用了AI-dm1A工具探讨了m1A对肿瘤细胞糖代谢行为的调控作用。AI-dm1A工具结合ATP5D的特异性gRNA能够靶向去除ATP5D mRNA上的m1A修饰,并进一步促进了ATP5D mRNA的翻译活性,导致ATP5D的蛋白表达水平升高。ATP5D是ATP合成酶的一个大亚基,其蛋白表达水平上调最终提高了肿瘤细胞的ATP生成水平,并促进了细胞的葡萄糖摄取以及乳酸生成。进一步将m1A去甲基化酶替换为m1A甲基转移酶,获得了可控可逆的特异性m1A甲基化工具。最后,研究人员将诱导剂ABA替换为脱落酸-4,5-二甲氧基-2-硝基苄基(ABA-DMNB)。ABA-DMNB只有在紫外照射的情况下才能释放具有活性的ABA,成功实现了该工具的光控化。
本研究为深入探讨m1A修饰的生物学功能提供了可控可逆的特异性m1A编辑工具。研究工作获得国家重点研发计划青年项目、广东省自然科学基金卓越青年团队、国家自然科学基金、广东省科技计划等多项基金的资助,并得到中山大学药学院熊小峰教授及中山大学中山医学院丁俊军教授课题组的支持和帮助。
近年来,王红胜课题组围绕RNA修饰在肿瘤中的作用及其靶向治疗策略取得系列进展。包括发现了新型RNA去甲基化酶并确认其可作为肿瘤治疗靶标(Natl Sci Rev,2024;NAR,2019),围绕mRNA修饰如m6A、m1A解析其促肿瘤作用机制(PNAS, 2022;Nat Commun, 2020;Cancer Res 2024/2023/2021)。为探索基于RNA去甲基化的肿瘤靶向诊疗策略探索,分别从甲基化定点编辑(Angew Chem, 2024; NAR, 2020)、小分子抑制剂开发(APSB, 2022;Small, 2021)、可视化检测技术(NAR,2023;Annal Chem, 2023)、血液学分子标志物检测(Genome Med, 2021; Clin Chem, 2020)等方面开展研究。受邀在STTT(2023)、Sci Bull(2024)等知名期刊发表相关综述。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Small molecule-inducible and photoactivatable cellular RNA N1-methyladenosine editing
Guoyou Xie, Yunqing Lu, Jiaxin He, Xianyuan Yang, Jiawang Zhou, Cheng Yi, Jian Li, Zigang Li, Gholamreza Asadikaram, Hongxin Niu, Xiaofeng Xiong, Jiexin Li, Hong-Sheng Wang
Angew. Chem. Int. Ed., 2024, DOI: 10.1002/anie.202320029
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!

















































 京公网安备 11010802027423号
京公网安备 11010802027423号