稀土金属催化α,β-不饱和醛亚胺烯丙基碳氢键选择性活化
α,β-不饱和醛亚胺是一类非常重要的有机合成中间体,被广泛应用于合成有机胺、氮杂环等化合物。从理论上讲,金属催化α,β-不饱和醛亚胺选择性碳氢键活化反应是快速构建结构复杂胺类化合物的原子和步骤经济性的合成策略。目前,过渡金属催化α,β-不饱和醛亚胺的烯基碳氢键催化转化已被广泛研究,但烯丙基碳氢键区域选择性活化与转化尚未实现。发展新型的金属催化剂是解决上述难题的关键抓手。
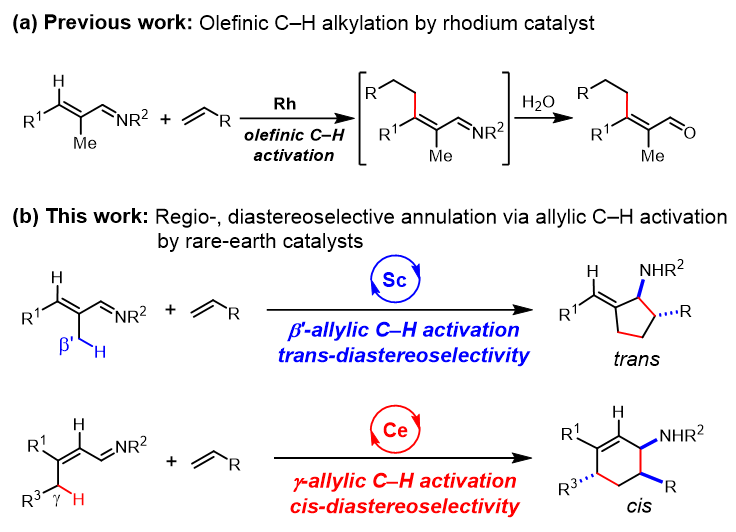
图1. 金属催化α,β-不饱和醛亚胺选择性碳氢键活化反应
日本理化学研究所(RIKEN)的侯召民(Zhaomin Hou)主任研究员(点击查看介绍)课题组一直致力于单茂稀土金属烷基化合物的合成及其催化C−H键活化反应的研究。近几年,该研究团队发展了一系列单茂稀土催化剂并成功应用于多种C−H键活化反应。鉴于单茂稀土金属烷基络合物催化剂在反应开发和立体控制等方面的独特优势,最近该课题组利用单茂稀土金属络合物为催化剂,实现了α,β-不饱和醛亚胺烯丙位C−H键(β' 和γ位)选择性活化,通过稀土金属-配体协同调控催化剂与烯烃的配位模式,发展了α,β-不饱和醛亚胺与烯烃的反式选择性[3+2]环化反应和顺式选择性[4+2]环化反应(图1)。采用大位阻的单茂钪金属催化剂,通过α,β-不饱和醛亚胺β'-C−H键选择性活化,实现了α,β-不饱和醛亚胺与苯乙烯和烷基烯烃的反式选择性[3+2]环化反应,以高的非对映选择性制备得到反式多取代环戊胺化合物。采用小位阻的单茂铈金属催化剂,通过α,β-不饱和醛亚胺γ-C−H键选择性活化,实现了α,β-不饱和醛亚胺与苯乙烯的顺式选择性[4+2]环化反应,以优异的非对映选择性得到顺式多取代2-环己烯胺化合物(图1)。该反应具有底物范围广、官能团兼容性好、非对映选择性优异等优点。
作者首先对钪催化α,β-不饱和醛亚胺与苯乙烯的反式选择性[3+2]环化反应开展了一系列机理实验研究,结果表明该反应先发生钪金属烷基物种与α,β-不饱和醛亚胺的1,4-加成反应得到活性钪金属胺基物种,随后该活性物种发生对另一分子α,β-不饱和醛亚胺的烯丙基碳氢键(β'-C−H)选择性活化生成π-烯丙基钪金属物种A,紧接着发生连续的苯乙烯的2,1-插入反应以及分子内亲核加成反应得到中间体C,中间体C发生对另一分子α,β-不饱和醛亚胺的烯丙基碳氢键(β'-C−H)选择性活化释放反式环化产物trans-3aa并再生π-烯丙基钪金属物种A。为了解决生成活性钪金属胺基物种过程中需要消耗催化量α,β-不饱和醛亚胺的问题,作者在反应中加入大位阻的金刚烷胺添加剂,通过原位生成钪金属胺基物种,不仅解决了钪金属烷基物种与α,β-不饱和醛亚胺的发生加成反应的问题,同时该钪金属胺基物种可以加速碳氢键活化(胺添加剂下的反应机理见支持信息;对胺添加剂作用的详细研究请参考Angew. Chem. Int. Ed., 2022, 61, e202115996)。
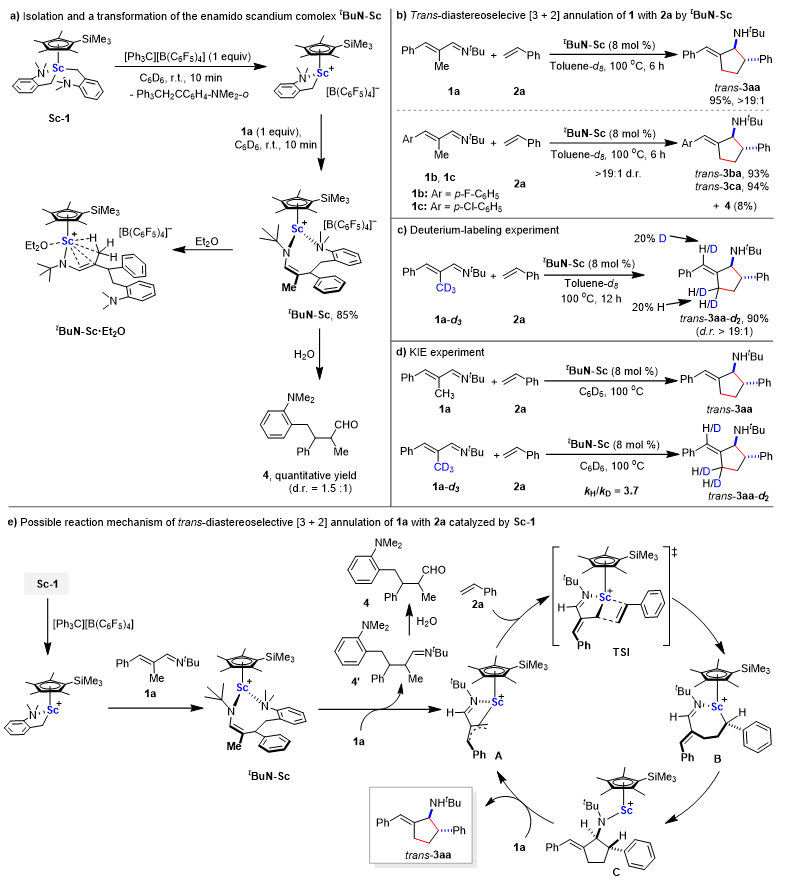
图2. 钪催化α,β-不饱和醛亚胺与苯乙烯的反式选择性[3+2]环化反应机理研究
如图3所示,钪催化α,β-不饱和醛亚胺与苯乙烯的反式选择性[3+2]环化反应显示了良好的底物普适性和官能团兼容性。值得一提的是,对于四取代α,β-不饱和醛亚胺的反应,无论是E-或Z-构型或是E-/Z-构型的混合物,均生成双键是E-/Z-构型混合物的环化产物。该结果再次印证反应过程中包含有π-烯丙基钪金属物种的生成。此外,该催化体系也可以很好的兼容非活化烷基烯烃。
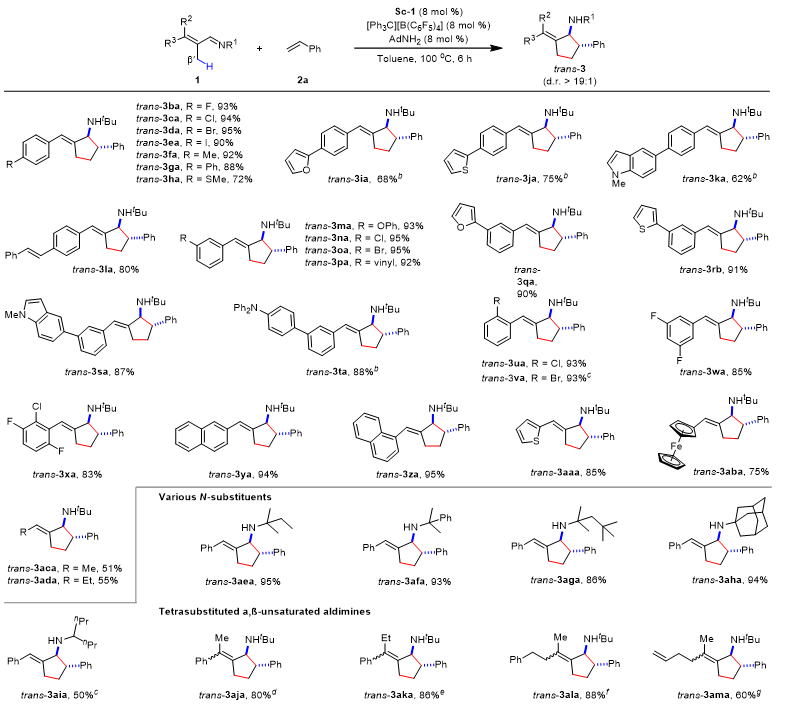
图3. 钪催化α,β-不饱和醛亚胺与苯乙烯的反式选择性[3+2]环化反应
随后,作者对铈催化α,β-不饱和醛亚胺与苯乙烯的顺式选择性[4+2]环化反应也进行了一系列机理实验研究(图4,原文将该部分研究放于支持信息),结果表明该反应先发生铈金属烷基物种与α,β-不饱和醛亚胺的1,4-加成反应得到活性铈金属胺基物种,随后该活性物种发生对另一分子α,β-不饱和醛亚胺的烯丙基碳氢键γ-C−H)选择性活化生成π-烯丙基铈金属物种I,紧接着发生连续的苯乙烯的2,1-插入反应以及分子内亲核加成反应得到顺式构型的中间体K,这是由于铈金属离子的半径较大,铈金属与苯乙烯的苯环存在相互作用。随后中间体K发生对另一分子α,β-不饱和醛亚胺的烯丙基碳氢键(γ-C−H)选择性活化释放顺式环化产物cis-6aa并再生π-烯丙基铈金属物种I。基于上述机理研究,作者在反应中加入二苄胺添加剂,通过原位生成铈金属胺基物种,解决了α,β-不饱和醛亚胺催化量消耗的问题,同时该铈金属胺基物种可以加速碳氢键活化,相应机理如图5所示。
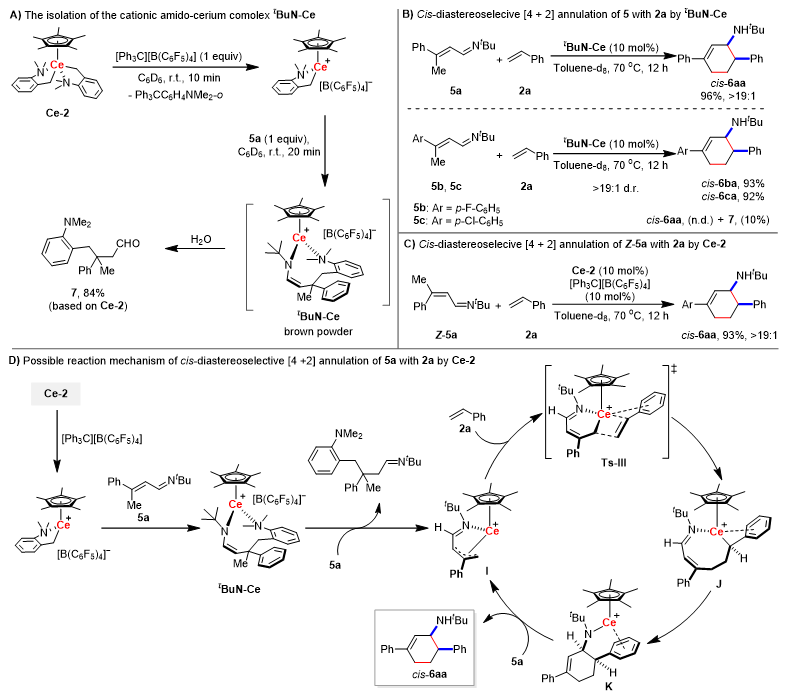
图4. 铈催化α,β-不饱和醛亚胺与苯乙烯的顺式选择性[4+2]环化反应机理研究
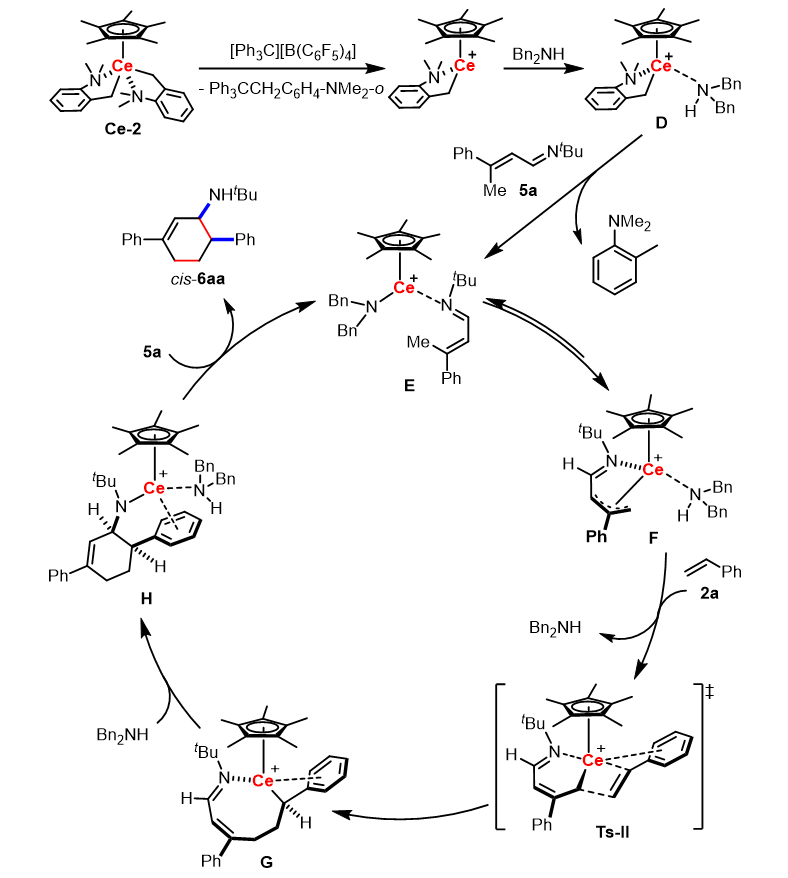
图5. 二苄胺添加剂存在下α,β-不饱和醛亚胺与苯乙烯的[4+2]环化反应机理
如图6所示,铈催化α,β-不饱和醛亚胺与苯乙烯的顺式选择性[4+2]环化反应显示了良好的底物普适性和官能团兼容性。更重要的是,二级的烯丙基碳氢键(secondary γ-C−H)也可以活化并且具有优异的非对映选择性。E-构型的四取代α,β-不饱和醛亚胺与苯乙烯反应单一生成顺式的[4+2]环化产物。需要指出的是,该催化体系不能兼容非活化烷基烯烃,归因于烷基烯烃很难接近催化剂的铈金属中心。随后,该团队开展了克级规模制备反应和对产物进行后修饰等研究,进一步验证了该反应的实用性与高效性。
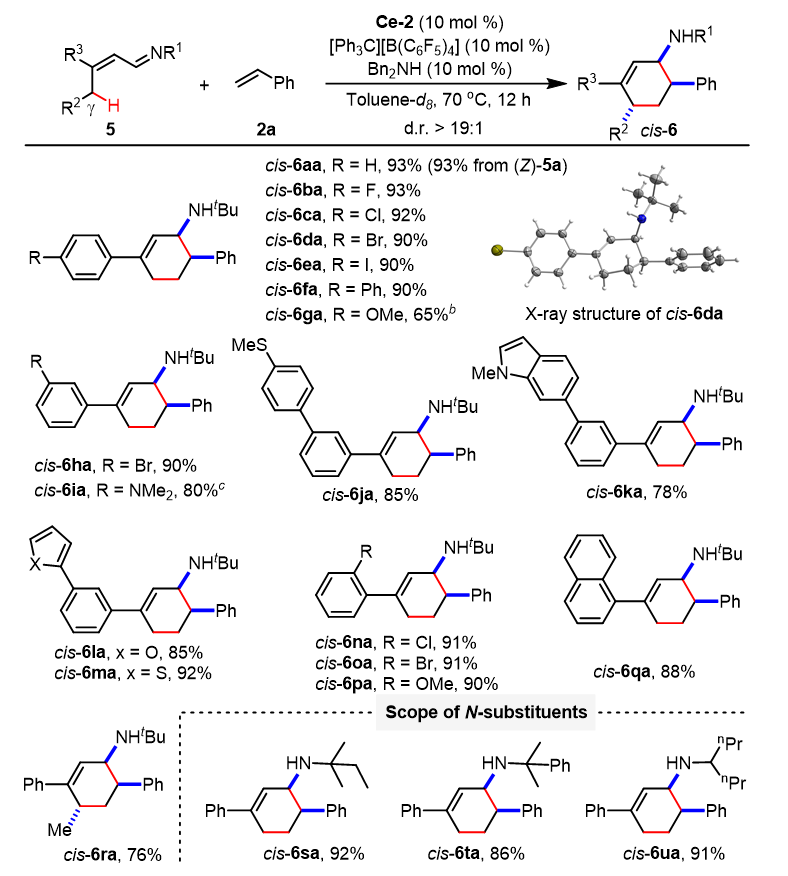
图6. 铈催化α,β-不饱和醛亚胺与苯乙烯的顺式选择性[4+2]环化反应
综上所述,侯召民课题组以单茂稀土金属烷基配合物为催化剂,采用稀土金属-配体协同调控催化剂与烯烃配位模式的策略,实现了α,β-不饱和醛亚胺烯丙基碳氢键区域选择性活化(β'-位、γ-位),通过稀土金属-配体协同调控催化剂与烯烃的配位模式,发展了α,β-不饱和醛亚胺与烯烃的立体选择性[3+2]和[4+2]环化反应,为高效、精准合成多取代环戊胺化合物和多取代2-环己烯胺化合物提供了新方法。该成果于近期发表于《美国化学会志》(J. Am. Chem. Soc.),通讯作者是日本理化学研究所侯召民主任研究员,第一作者是丛雪丰研究员(现为天津大学分子+研究院教授)。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Regio- and Diastereoselective Annulation of α,β-Unsaturated Aldimines with Alkenes via Allylic C(sp3)–H Activation by Rare-Earth Catalysts
Xuefeng Cong, Na Hao, Aniket Mishra, Qingde Zhuo, Kun An, Masayoshi Nishiura, and Zhaomin Hou*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.4c02144
导师介绍
侯召民
https://www.x-mol.com/university/faculty/31089
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
Angew. Chem.:半夹心型稀土金属络合物催化联烯与烯烃[2+2]环加成反应 2022-09-30
-
钪催化C(sp3)−H键活化:烷基醛亚胺与烯烃的非对映选择性的[3+2]环化反应 2022-01-02
-
半夹心型稀土络合物催化芳基醛亚胺C−H键活化与烯烃的非对映多样性的[3+2]环化反应 2020-04-22
































 京公网安备 11010802027423号
京公网安备 11010802027423号