MacMillan团队Science:Sʜ2自由基分选实现醇-醇交叉偶联
在过去的几十年里,过渡金属催化的交叉偶联反应取得了巨大进展,并广泛应用于药物分子、农用化学品和功能材料的构建中。然而,在过渡金属催化下两个官能团必须以正交的方式活化,使得每个偶联试剂通过不同的机理步骤(如:氧化加成、金属交换、还原消除)与金属催化剂结合,但因底物范围和活化模式等问题阻碍了该方法的通用性。为此,化学家利用两个具有相同官能团的片段进行单官能团交叉偶联来规避上述问题(图1A),其中最经典的要数烯烃交叉复分解反应,其通过单一催化平台将两种烯烃砌块连接并形成新的C(sp2)=C(sp2)键。随后,化学家还实现了两类化合物(即烷基溴和烷基羧酸)的单官能团交叉偶联反应,但是这两种底物有限的结构多样性限制了产物的多样性。相比之下,醇类化合物是一种富含C(sp3)的天然底物,若能实现两个醇片段之间的单官能团交叉偶联反应,那么就能从天然产物、生物分子、小分子治疗剂、生物质原料和市售化学品等出发构建C(sp3)-C(sp3)键,从而获得前所未有的化学空间。自2021年MacMillan教授课题组利用N-杂环卡宾(NHC)盐实现醇的光氧化还原原位脱氧后(Nature, 2021, 598, 451-456,点击阅读详细),该方法已被用于活化醇结构单元并将其转化为瞬态烷基自由基,进而与多种偶联试剂构建新的化学键。然而,利用NHC活化两种醇底物时可能会产生两种不同的自由基,并且其会通过自由基重组或歧化等过程产生难以分离的复杂混合物。
相比之下,自由基分选和双分子均裂取代(SH2)的结合可以成功介导两个瞬态烷基自由基之间的交叉选择性C(sp3)-C(sp3)键偶联(Science, 2021, 374, 1258-1263,点击阅读详细,图1B)。在此基础上,美国普林斯顿大学的David W. C. MacMillan教授课题组尝试将上述机制与NHC醇活化相结合以实现两个醇片段的交叉偶联。近日,他们在Science 上发表论文,利用光/镍催化的SH2自由基分选策略,成功地实现了两种醇之间的C(sp3)-C(sp3)键交叉偶联(图1C),而且对药物分子、生物活性分子以及多肽的后期修饰同样有效。其具体过程如下:首先,在含有两种醇片段的单一反应容器中加入NHC-1并生成两种NHC-醇加合物。随后,任一NHC-醇加合物与合适的光催化剂激发态结合并经氧化-去质子化和β-裂解形成相应的烷基自由基,同时温和的氧化剂可以快速氧化还原态光催化剂,使其恢复到Ir(III)基态并引发第二次光氧化事件以产生替代的烷基自由基。最后,烷基自由基通过合适的金属催化剂进行分选,接着进行C(sp3)-C(sp3)键交叉偶联便可获得所需产物。值得一提的是,就在前不久MacMillan教授团队在Nature 杂志上报道了通过三重自由基分选实现的烯烃区域选择性二烷基化反应(Nature, 2024, DOI: 10.1038/s41586-024-07165-x,点击阅读详细)。
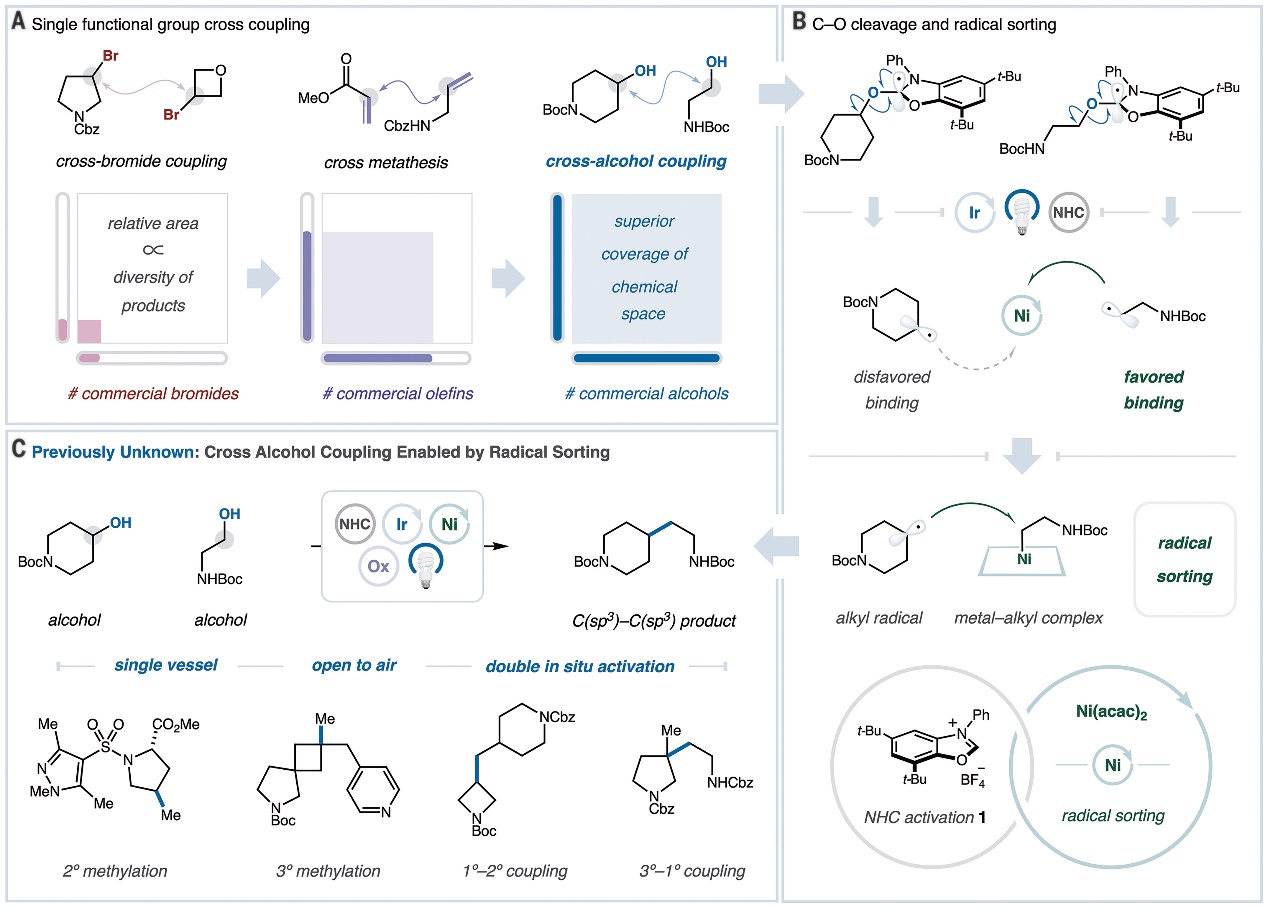
图1. 反应设计。图片来源:Science
首先,作者选择仲(2°)醇与甲醇为模板底物对反应条件进行优化,研究发现在温和的碱性条件下将两种醇底物与NHC盐1混合后,直接加入原位生成的SH2催化剂Tp*Ni(acac)、光催化剂Ir[dF(CF3)ppy]2(dtbbpy)PF6、奎宁、过氧化苯甲酰氧化剂和二甲基亚砜(DMSO)并用蓝色LED照射1 h后,可以较高的产率获得相应的甲基化产物。对照实验显示无[Tp*]配体时2°醇甲基化的效率略高,这表明Ni(acac)2自身就是一种有效的自由基分选催化剂,并且配体效应的大小取决于底物,SH2催化剂Tp*Ni(acac)可为叔醇偶联试剂带来更高的产率。进一步研究发现Ni(acac)2在促进交叉选择性和抑制背景自由基-自由基反应产生的副产物方面发挥着关键作用,即在Ni(acac)2的存在下交叉偶联产物的产率增加四倍以上(16%→70%),并且交叉偶联产物与2°-2°同二聚体的比例由2:1(无金属)增加至17.5:1(有金属)。值得一提的是,该反应无需过滤除去吡啶鎓盐并且醇类底物可在单个反应瓶中被活化、脱氧和交叉偶联,进而简化反应装置;同时无需采取任何预防措施来排除空气或水分即可保持反应效率。另外,醇交叉偶联仅需要1.0-1.5 equiv甲醇即可以高产率获得相应产物,而先前报道的单官能团交叉偶联反应通常需要大量过量的偶联试剂来实现高反应性。

图2. 底物拓展一。图片来源:Science
在最优条件下,作者以甲醇为模板底物探索了其它醇的底物适用性(图2),结果显示伯醇(2、3)、环状仲醇(4-11)、螺环仲醇(12-15)、高苄醇(18)和吡啶衍生的醇(19)均可以有效地与甲醇进行交叉偶联反应,并以51-71%的产率获得相应的甲基化产物。对反应条件进行稍加修改后(使用亲电性更强的NHC-CF3),作者成功地实现了3°醇砌块和甲醇的交叉偶联反应并构建了一系列结构多样化的脂肪族季碳中心,例如:螺环叔醇(20)、4-7元饱和杂环叔醇(21-25、27-29)和双环体系叔醇(26)均可以良好的产率(34%-71%)转化为相应的甲基化产物。
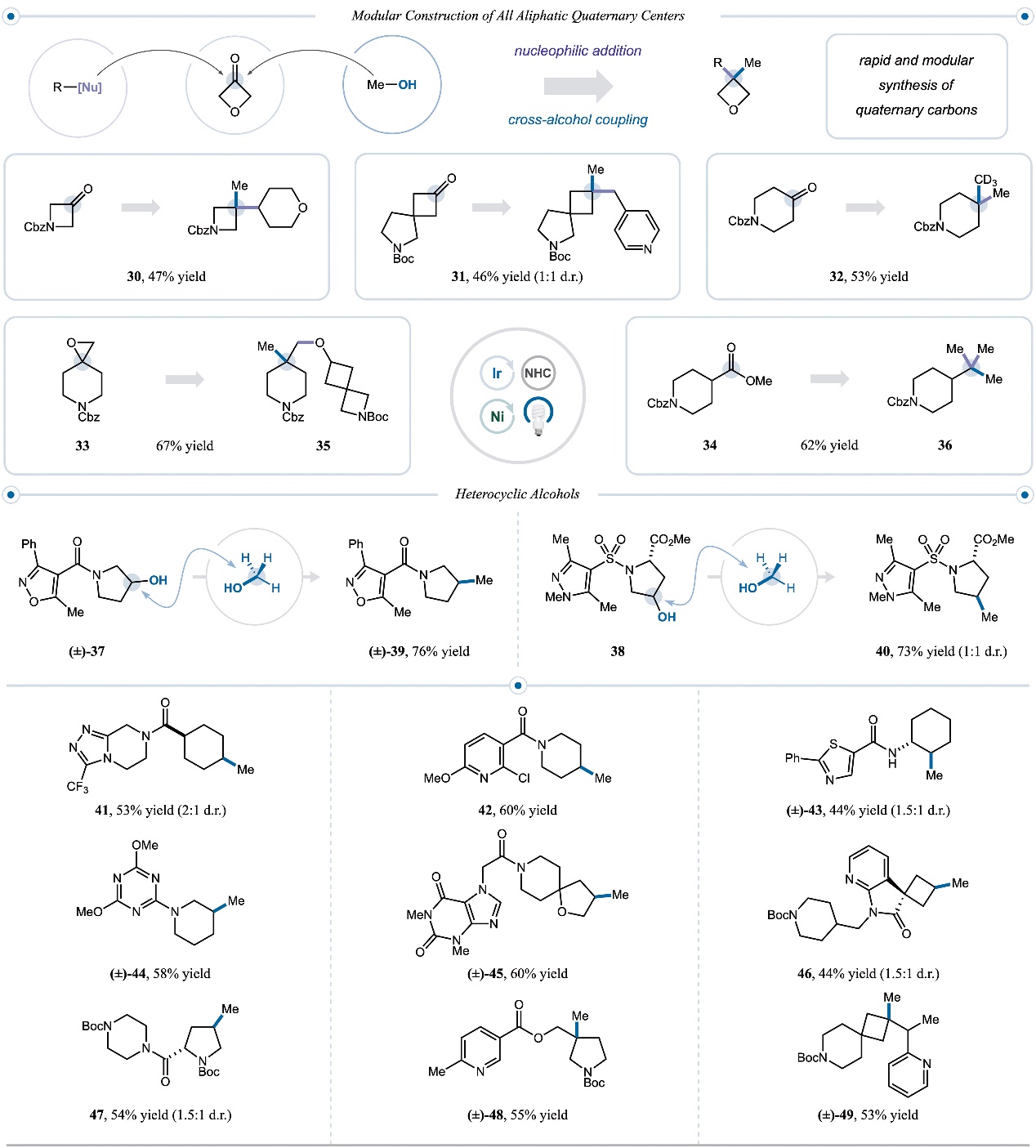
图3. 底物拓展二。图片来源:Science
鉴于叔醇可由天然亲电官能团的简单亲核加成获得,因此作者利用两步法策略将酮、酯和环氧化物转化为季碳产物(图3),具体而言:多种酮(30-32)、环氧化物(33)和甲酯(34)先与结构不同的有机金属亲核试剂进行反应制备相应的3°醇,再与甲醇或CD3OD进行交叉偶联便可以良好的产率获得季碳产物。其次,作者还探索了药用相关杂环衍生醇的底物范围,结果显示异恶唑(37)、吡唑磺酰胺(38)、三唑并哌嗪(41)、噻唑(43)、三嗪(44)、吡啶(42、48、49)、嘌呤(45)、氮杂吲哚(46)和哌嗪(47)衍生醇同样可以兼容该反应并获得相应的甲基化产物,特别是吡啶衍生物(48和49)还能构建季碳中心。
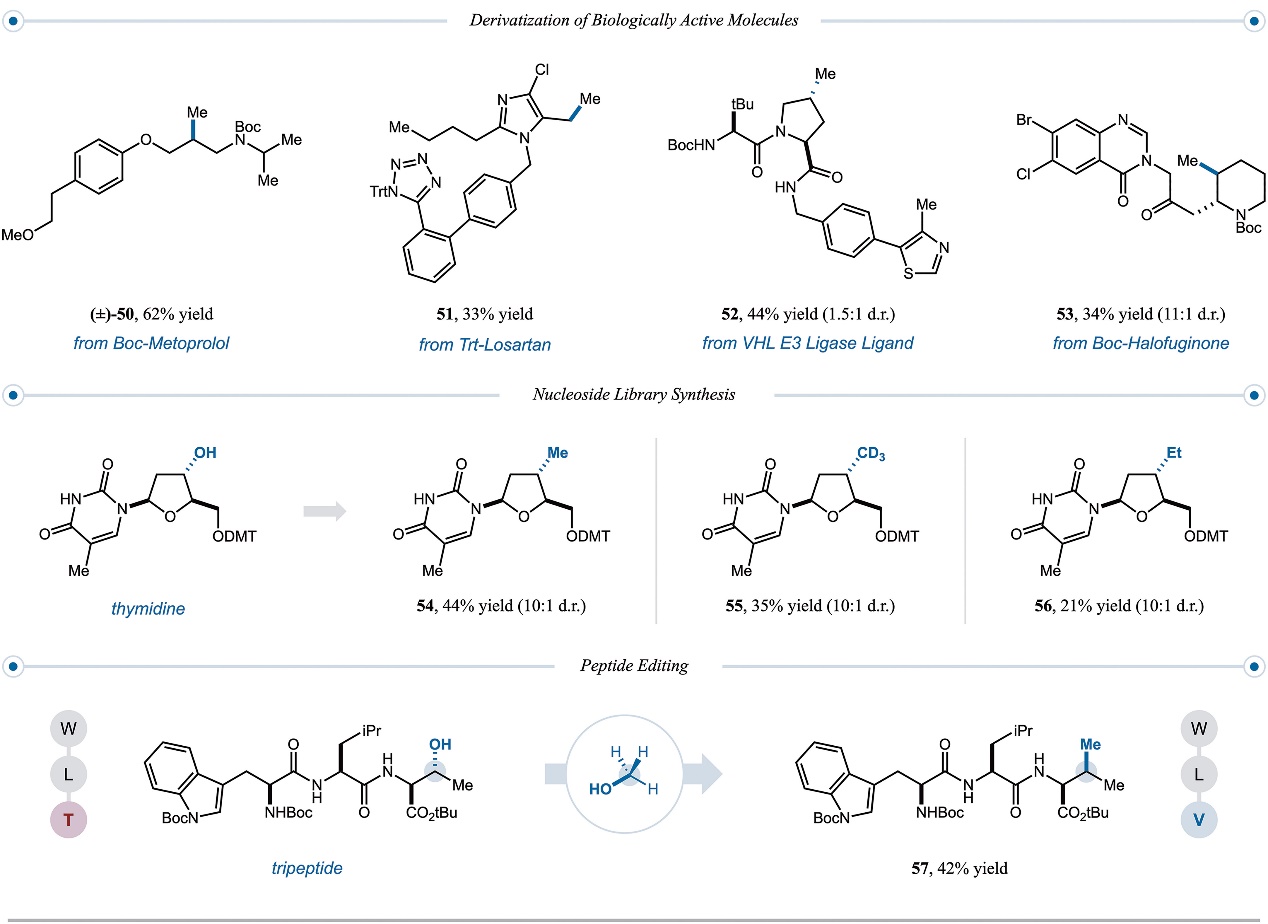
图4. 后期修饰。图片来源:Science
接下来,作者还利用该方法实现了生物活性分子(如:美托洛尔(50)、氯沙坦(51)、VHL E3连接酶结合物(52)、常山酮(53))的后期修饰,并以中等至良好(33-62%)的产率获得所需的甲基化产物,从而极大地简化了合成步骤。其次,胸苷分别与甲醇、CD3OD和乙醇进行交叉偶联反应后,以21-44%的产率获得相应的甲基(54)、CD3(55)和乙基类似物(56)。此外,将色氨酸-亮氨酸-苏氨酸三肽置于标准条件下进行反应时,苏氨酸侧链仲羟基与甲基的交换意味着苏氨酸向缬氨酸残基的互变(57,产率:42%),进而说明一步法将三肽从W-L-T编辑为W-L-V。
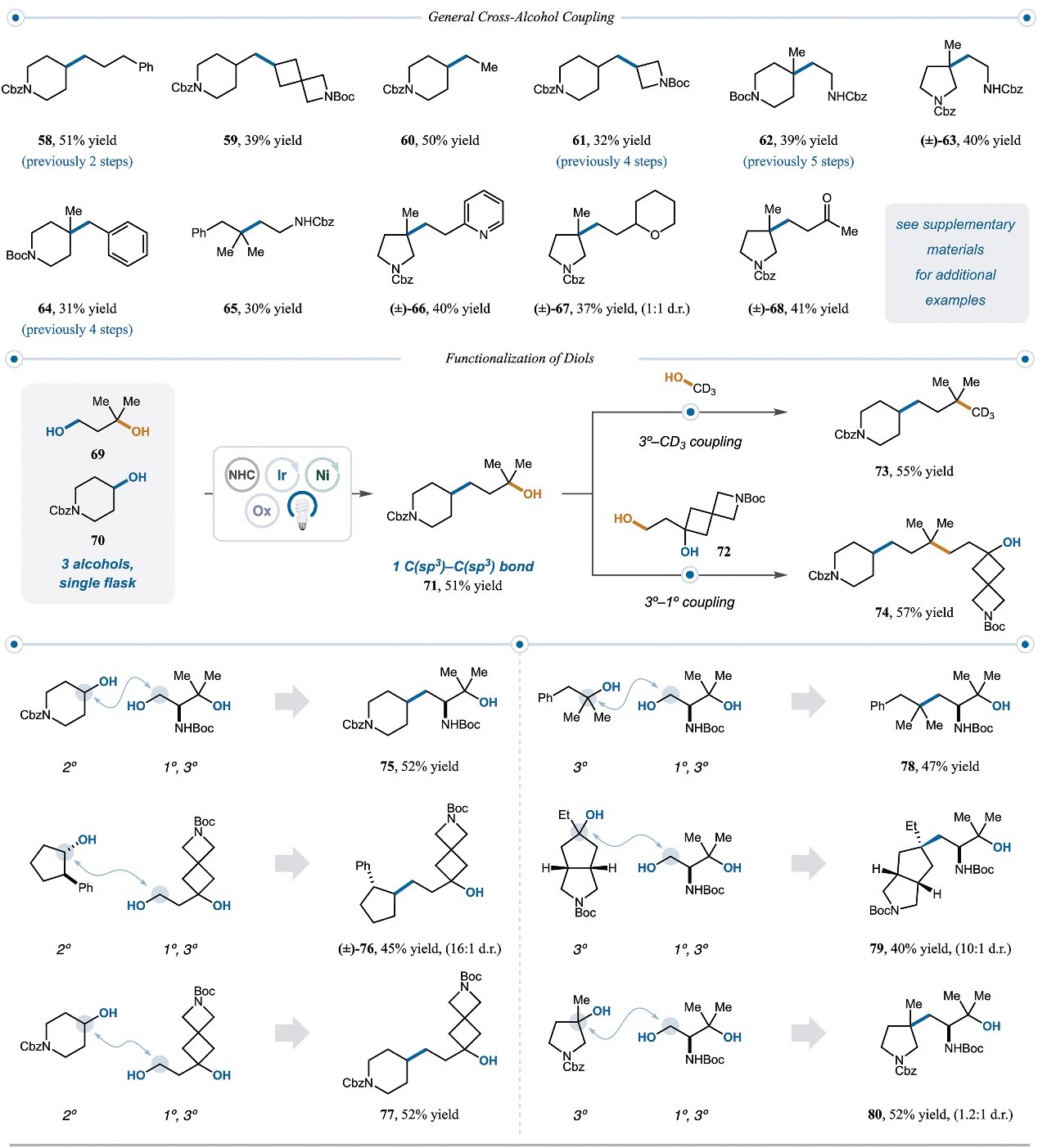
图5. 二醇的交叉偶联。图片来源:Science
如图5所示,作者还研究了两种不同取代醇之间的交叉偶联反应,结果显示不同环尺寸的2°和1°醇之间均可发生交叉偶联并以32%-51%的产率获得相应产物(58-61),同时环状/非环状3°醇与1°醇也能以30-41%的产率构建相应的季碳中心(62-68)。其次,作者对二醇的迭代官能团化进行了相关研究。由于醇和NHC盐之间的缩合速率由空间位阻决定(MeOH > 1° > 2° >> 3°),因此作者推测差异取代的二醇(如:1°、3°二醇(69)和2°醇(70))可作为交叉偶联的正交功能手柄。事实上,将69和70置于最优条件下,作者发现1°和2°醇发生选择性脱氧并以51%的产率获得含有3°醇的产物71(可单次合成>700 mg)。随后,71中的3°醇可以与CD3OD或72进行另一轮交叉偶联,并分别以55%和57%的产率得到复杂的季碳产物(73和74)。值得一提的是,1°、3°二醇的官能团化被证明非常成功,进而合成了一系列复杂的2°-1°偶联产物(75-77,产率:45%-52%)以及3°-1°偶联产物(78-80,产率:40%-52%)。
总结
David MacMillan教授课题组利用光/镍催化的SH2自由基分选策略,成功地实现了两种醇之间的C(sp3)-C(sp3)键交叉偶联,并以良好的产率构建了五种不同类别的C(sp3)-C(sp3)键,包括季碳中心。此外,该方法对药物分子、生物活性分子以及多肽的后期修饰同样有效。毫无疑问,该方法为醇交叉偶联技术的发展与应用奠定了良好的基础。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Alcohol-alcohol cross-coupling enabled by SH2 radical sorting
Ruizhe Chen, Nicholas E. Intermaggio, JiaxinXie, James A. Rossi-Ashton, Colin A. Gould, Robert T. Martin, Jesús Alcázar, David W. C. MacMillan
Science, 2024, 383, 1350-1357, DOI: 10.1126/science.adl5890
导师介绍
David W. C. MacMillan
https://www.x-mol.com/university/faculty/156328
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号