上海药物所黄永焯团队ACS Mater. Lett. | 双重阻断的工程化细胞外囊泡用于预防和治疗新冠的不同突变株
英文原题:Heparin-conjugated ACE2-bearing extracellular vesicles as engineered dual-decoy for combating SARS-CoV-2 Omicron variant via pulmonary delivery

通讯作者:黄永焯研究员、王慧媛副研究员(中国科学院上海药物研究所)
作者:Bin Tu+(涂斌),Zhenzhen Pan+(潘真真),Huiyuan Wang*(王慧媛), Jingkun Qu(屈景坤), Feifei Sun(孙菲菲), Mingjie Shi(施明杰), Yingyan Zhang(张颖妍),Han Wu(吴涵), Bahtiyor Muhitdinov, and Yongzhuo Huang*(黄永焯)
SARS-CoV-2仍在广泛传播,其传染性仍维持在较高水平。疫苗是预防SARS-CoV-2感染的主要手段之一,但随着突变株的不断出现,原有疫苗的预防作用明显减弱。为应对SARS-CoV-2不断出现的突变株及突破性感染的风险,开发可早期干预、方便使用的防治方法具有十分重要的意义。
硫酸乙酰肝素(HS)是细胞表面的一种多糖受体,能够与病毒表面的Spike蛋白结合,并介导Spike蛋白与宿主细胞表面ACE2的结合从而参与SARS-CoV-2感染宿主细胞的过程。同时,SARS-CoV-2的突变株与细胞表面的ACE2蛋白的结合能力展现出增强的趋势。肝素是HS的类似物,也具有与Spike蛋白结合的能力 [1]。因此,中国科学院上海药物研究所黄永焯研究员团队构建了一种共载肝素和ACE2蛋白的工程化细胞外囊泡作为纳米双诱饵(haEVs),可高效阻断SARS-CoV-2原始毒株、Delta、Delta plus及Omicron 等突变株的感染(图1)。
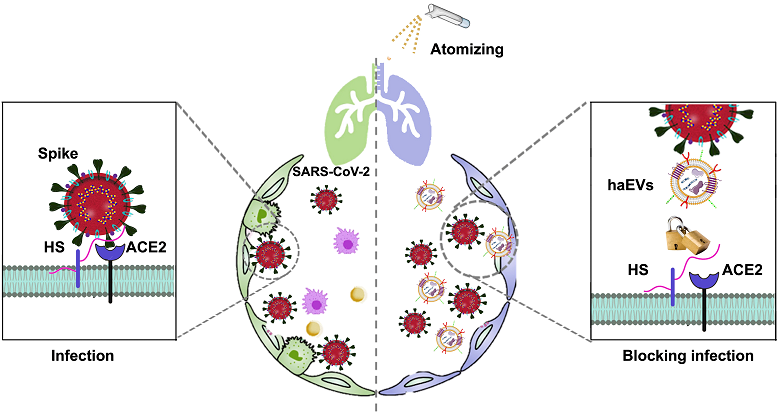
图1. 工程化细胞外囊泡(haEVs)作为纳米双诱饵阻断SARS-CoV-2感染的示意图
人体在感染SARS-CoV-2后,SARS-CoV-2除了存在于高表达ACE2的肺、心脏、鼻粘膜、肠等组织与器官外,也出现在包括大脑、肌肉、皮肤等多种低表达ACE2的组织与器官中 [2],这提示除ACE2外,宿主细胞表面其他病毒受体对于病毒入侵也起着重要的作用。
在细胞感染阻断实验中,haEVs可同时高效抑制SARS-CoV-2及突变株对ACE2低/高表达细胞株的感染(图2),展现出很强的抗感染能力。这表明,采用肝素和ACE2双重中和作用,可有效地抑制病毒对不同类型细胞的感染。
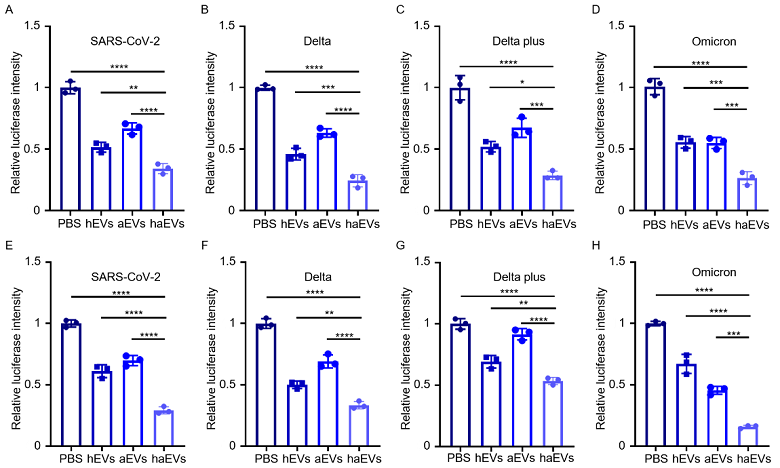
图2. 纳米双诱饵阻断SARS-CoV-2及突变株感染的效果。(A-D)AEC2低表达细胞株;(E-H)AEC2高表达细胞株。(hEVs: 肝素修饰EVs;aEVs: ACE2 EVs;haEVs: 肝素/ACE2 EVs)
通过吸入由打喷嚏、咳嗽或呼吸产生的病毒颗粒飞沫是最重要的传播途径,并且肺部是SARS-CoV-2攻击的主要部位,感染SARS-CoV-2后会引起不同程度的肺损伤。吸入给药可以直接到达被感染的部位,阻断病毒进一步的感染,可实现方便的自我用药,能够在高风险暴露的环境中使用,是用于预防和治疗病毒感染的理想给药形式 [3]。
该研究通过雾化和支气管给药的方式,考察了可吸入haEVs阻断Omicron突变株感染肺组织的效果。相比于其它对照组,haEVs可显著减弱Omicron突变株假病毒对肺组织的感染(图3A),并且haEVs与Omicron突变株的结合后可有效促进病毒在肺组织中的清除(图3B-C)。进一步研究显示,在吸入给药8 h后,haEVs在肺组织中仍有约50%保留,给药24 h后,haEVs在肺组织中还有存留,表明可吸入haEVs在肺部能维持较为长效的作用(图3D-E)。
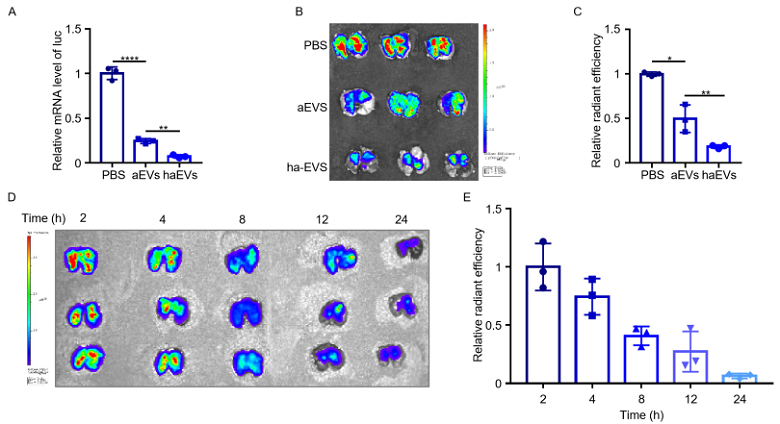
图3.(A)经过治疗后Omicron假病毒在肺组织的感染情况;(B)通过成像检测Omicron假病毒在肺组织中的治疗情况;(C)对图B的定量分析;(D)通过成像检测haEVs在肺组织中的滞留情况;(E)对图D的定量分析。
总结/展望
该研究基于硫酸乙酰肝素在介导SARS-CoV-2入胞中的重要作用及突变株Spike蛋白与ACE2结合增强的特点,制备了一种可自我用药、肝素/ACE2共修饰的工程化细胞外囊泡,用于肺部给药。haEVs作为一种纳米双诱饵在感染早期阶段可有效阻断高传播的SARS-CoV-2突变株对宿主细胞的感染,为应对仍在全球广泛传播的SARS-CoV-2提供了一种高效且方便使用的新方法。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Heparin-Conjugated ACE2-Bearing Extracellular Vesicles As Engineered Dual-Decoy for Combating the SARS-CoV-2 Omicron Variant via Pulmonary Delivery
Bin Tu, Zhenzhen Pan, Huiyuan Wang*, Jingkun Qu, Feifei Sun, Mingjie Shi, Yingyan Zhang, Han Wu, Bahtiyor Muhitdinov, and Yongzhuo Huang*
ACS Materials Lett. 2024, 6, 1247–1255
Publication Date: March 5, 2024
https://doi.org/10.1021/acsmaterialslett.3c01442
© 2024 American Chemical Society
参考文献
(1) Tu, B.; Wang, H.; An, X.; Qu, J.; Li, Q.; Gao, Y.; Shi, M.; Qiu, H.; Huang, Y. Inhaled heparin polysaccharide nanodecoy against SARS-CoV-2 and variants. Acta Pharm Sin B 2022, 12 (7), 3187-3194. DOI: 10.1016/j.apsb.2022.01.019.
(2) Stein, S. R.; Ramelli, S. C.; Grazioli, A.; Chung, J. Y.; Singh, M.; Yinda, C. K.; Winkler, C. W.; Sun, J.; Dickey, J. M.; Ylaya, K.; et al. SARS-CoV-2 infection and persistence in the human body and brain at autopsy. Nature 2022, 612 (7941), 758-763. DOI: 10.1038/s41586-022-05542-y.
(3) Tu, B.; Gao, Y.; An, X.; Wang, H.; Huang, Y. Localized delivery of nanomedicine and antibodies for combating COVID-19. Acta Pharm Sin B 2022, 13 (5), 1828-1846. DOI: 10.1016/j.apsb.2022.09.011.
通讯作者信息
黄永焯,中国科学院上海药物研究所,研究员,课题组长。分别于2014年和2019年入选优青和杰青,入选上海浦江人才计划,中国科学院特聘研究员计划及科技部中青年创新领军人才。研究方向:药物新剂型与递药新技术。
王慧媛,中国科学院上海药物研究所,副研究员。研究方向:基因治疗,药物的靶向递送。
(本稿件来自ACS Publications)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
基于ACE2棕榈酰化修饰设计高效中和新冠病毒的细胞外囊泡 2021-10-31
-
白蛋白结合蛋白通路介导的白蛋白纳米仿生药物递送系统治疗脑胶质瘤的研究 2017-03-03
-
厦大刘刚教授团队Angew:生物工程化纳米囊泡疫苗用于包虫病免疫治疗 2024-02-21
-
Heparin-azithromycin microparticles show anti-inflammatory effects and inhibit SARS-CoV-2 and bacterial pathogens associated to lung infectionsBrayan J. Anaya, Davide D'Angelo, Ruggero Bettini, Gracia Molina, Amadeo Sanz-Perez, María Auxiliadora Dea-Ayuela, Carolina Galiana, Carmina Rodríguez, Diego F. Tirado, Aikaterini Lalatsa, Elena González-Burgos, Dolores R. Serrano
-
Rapid and extensive SARS-CoV-2 Omicron variant infection wave revealed by wastewater surveillance in Shenzhen following the lifting of a strict COVID-19 strategyScience of the Total Environment (IF 8.2) Pub Date : 2024-08-03 ,DOI:10.1016/j.scitotenv.2024.175235Yinghui Li, Chen Du, Ziquan Lv, Fuxiang Wang, Liping Zhou, Yuejing Peng, Wending Li, Yulin Fu, Jiangteng Song, Chunyan Jia, Xin Zhang, Mujun Liu, Zimiao Wang, Bin Liu, Shulan Yan, Yuxiang Yang, Xueyun Li, Yong Zhang, Jianhui Yuan, Shikuan Xu, Miaoling Chen, Xiaolu Shi, Bo Peng, Qiongcheng Chen, Yaqun Qiu, Shuang Wu, Min Jiang, Miaomei Chen, Jinzhen Tang, Lei Wang, Lulu Hu, Bincai Wei, Yu Xia, John S. Ji, Chengsong Wan, Hongzhou Lu, Tong Zhang, Xuan Zou, Songzhe Fu, Qinghua Hu
-
Endothelium-Derived Engineered Extracellular Vesicles Protect the Pulmonary Endothelial Barrier in Acute Lung InjuryZhengyan Gu, Mingxue Sun, Jihao Liu, Qi Huang, Yunqin Wang, Jun Liao, Tingbin Shu, Min Tao, Guanchao Mao, Zhipeng Pei, Wenqi Meng, Xinkang Zhang, Youheng Wei, Shanshan Zhang, Songling Li, Kai Xiao, Ying Lu, Qingqiang Xu
-
Engineered Extracellular Vesicles Derived from Dermal Fibroblasts Attenuate Inflammation in a Murine Model of Acute Lung InjuryAna I. Salazar-Puerta, María A. Rincon-Benavides, Tatiana Z. Cuellar-Gaviria, Julian Aldana, Gabriela Vasquez Martinez, Lilibeth Ortega-Pineda, Devleena Das, Daniel Dodd, Charles A. Spencer, Binbin Deng, David W. McComb, Joshua A. Englert, Samir Ghadiali, Diana Zepeda-Orozco, Loren E. Wold, Daniel Gallego-Perez, Natalia Higuita-Castro
-
Advances of engineered extracellular vesicles-based therapeutics strategyScience and Technology of Advanced Materials (IF 7.4) Pub Date : 2022-10-20 ,DOI:10.1080/14686996.2022.2133342Hiroaki Komuro, Shakhlo Aminova, Katherine Lauro, Masako Harada
-
Delta SARS-CoV-2 variant is entirely substituted by the omicron variant during the fifth COVID-19 wave in Attica regionScience of the Total Environment (IF 8.2) Pub Date : 2022-09-29 ,DOI:10.1016/j.scitotenv.2022.159062Aikaterini Galani, Athina Markou, Lampros Dimitrakopoulos, Aikaterini Kontou, Marios Kostakis, Vasileios Kapes, Marios A. Diamantopoulos, Panagiotis G. Adamopoulos, Margaritis Avgeris, Evi Lianidou, Andreas Scorilas, Dimitrios Paraskevis, Sotirios Tsiodras, Meletios-Athanasios Dimopoulos, Nikolaos Thomaidis
































 京公网安备 11010802027423号
京公网安备 11010802027423号