成都中医药大学鲁军教授课题组JARE | 组合杂交:新型喹唑啉-2-吲哚酮衍生物—一种高选择性PI3Kα抑制剂
PI3Kα的异常激活促进癌细胞增殖、迁移、侵袭和血管生成;因此,PI3Kα已成为抗癌药物开发的关键靶点。多种结构多样的抑制剂已进入临床试验阶段,但大多数属于泛PI3K抑制剂,由于其对PI3Kα的亚型选择性抑制较差,通常会引起脱靶副作用,如高脂血症、贫血、血小板减少症、口腔炎和肝毒性。然而,目前只有Alpelisib被批准用于治疗实体瘤和PIK3CA相关的过度生长谱系(PROS)综合征。因此,开发具有有效亚型选择性的PI3Kα抑制剂以满足巨大的临床需求仍然是必要的。
喹唑啉衍生物和2-吲哚酮衍生物具有多样生物活性,迄今为止尚未有研究报道将喹唑啉和2-吲哚酮直接杂合以开发新型生物活性分子。成都中医药大学鲁军课题组团队采用分子杂交策略将两者核心骨架直接杂交获得一种新的“双核”式杂合分子,并将其作为新型喹唑啉-2-吲哚酮衍生物的母核结构(化合物3),构建了一系列新的杂合分子(QHIDs),QHIDs普遍具有较高的抗肿瘤活性和PI3Kα选择性,其中化合物8展现出PI3Kα高亲和力、高选择性以及优秀的抗肿瘤活性。
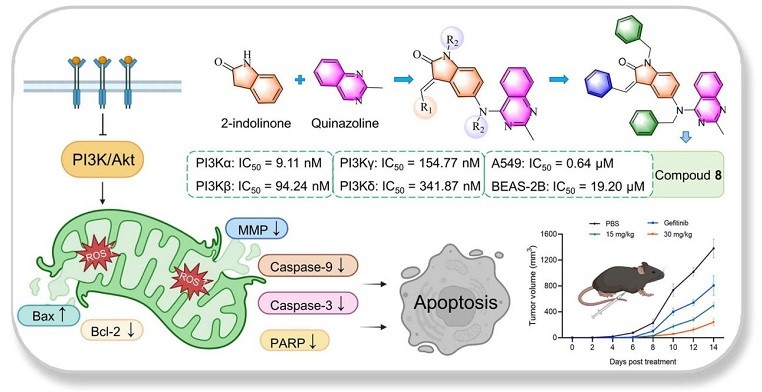
图1. QHIDs的合成及抗肿瘤机制
为了进一步探究喹唑啉-2-吲哚啉酮的母核结构与其修饰衍生物与PI3Ka的结合方式和结构活性之间的关系,分别选取化合物3和8与靶蛋白进行分子对接研究。化合物8中2-吲哚酮的羰基氧与His759呈氢键相互作用,3-取代苯环通过芳烃阳离子作用力与Arg852相互作用。而Arg852正是PI3Ka抑制剂Alpelisib对PI3K不同亚型产生差异选择性的重要氨基酸基团之一。

图2. 化合物3和8与PI3Ka蛋白相互作用的3D结构和局部放大图像及其与PI3Ka的二维图相互作用分析
此外,作者还就PI3Kα抑制能力最强和抗肿瘤活性提升最大的化合物8针对高表达PI3Kα的非小细胞肺癌的进行了进一步的机制研究。结果显示化合物8可在G2期阻断NSCLC细胞以抑制细胞增殖,并显着抑制细胞的迁移能力;通过与PI3Kα蛋白结合抑制PI3K通路,诱导细胞线粒体中ROS的产生并破坏线粒体膜电位,从而介导线粒体功能障碍并促进NSCLC细胞凋亡。化合物8还能够在体内显著抑制PI3Kα磷酸化,并对小鼠非小细胞肺癌的进展产生抑制作用,且无明显毒性。具有喹唑啉结构的吉非替尼是临床治疗非小细胞肺癌的一线用药,在体内外实验中化合物8均展现出比吉非替尼更好的抗肿瘤活性和较低的毒性,这为新型QHIDs作为治疗NSCLC的潜在未来疗法奠定了坚实的基础。

图3. 化合物8通过抑制PI3Ka诱导NSCLC细胞线粒体凋亡。
综上所述,成都中医药大学鲁军课题组团队将喹唑啉与2-吲哚啉酮共价杂交,构建出独特的母体结构,并对其进行结构修饰和药理学评价。通过这一策略,有望获得更有效的化合物作为PI3Kα抑制剂用于癌症治疗,并为PI3Kα抑制剂的开发和深入研究提供新的视角。
成都中医药大学药学院鲁军教授团队和深圳大学第一附属医院吴正治教授团队共同合作的这一成果近日发表在Journal of Advanced Research 上,成都中医药大学药学院硕士生刘昌群、曹悦宁和博士生左艺为共同一作。该研究得到了国家自然科学基金委员会和四川省科技厅的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Hybridization-based discovery of novel quinazoline-2-indolinone derivatives as potent and selective PI3Kα inhibitors
Changqun Liu, Yuening Cao, Yi Zuo, Chaozheng Zhang, Senmiao Ren, Xin Zhang, Chuanqi Wang, Yingjie Zeng, Jie Ling, Yilan Liu, Zixian Chen, Xiujun Cao, Zhengzhi Wu, Chuantao Zhang, Jun Lu
J. Adv. Res., 2024, DOI: 10.1016/j.jare.2024.03.002
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号