Science:从C1到N1,知名环加成反应50年来的“小”创新
副标题:光催化氮宾的Pauson-Khand型反应
环加成是有机合成化学中的基础反应,化学家可使用它在一步反应中高效、高原子经济性地构建复杂分子结构,例如:钴催化的[2+2+1]环加成、Pauson-Khand反应等。尽管Pauson-Khand反应已经发展了50多年,但目前应用仍是将两个不饱和键和C1片段进行环加成并形成相应的环戊烯酮(图1A),而且C1片段仅限于一氧化碳(CO)。数年前,Uyeda等人实现了双核镍催化剂催化亚乙烯基卡宾和1,3-丁二烯的[4+1]环加成反应以构建环戊烯骨架(Science, 2019, 363, 857-862,点击阅读详细)。此外,饱和N-杂环化合物是药物化学中最重要的结构组成之一,如果能将C1片段替换为N1片段,那么就能开辟一种新方法来合成吡咯烷型N-杂环。然而,由于竞争性[2+1]环加成反应会形成氮丙啶副产物,因此该策略的实现难度颇大。
近日,德国亚琛工业大学的Rene M. Koenigs教授课题组利用三重态氮宾的双自由基性质,在可见光催化下成功地实现了非共轭二烯与氮宾前体(N1片段)的类Pauson-Khand型环加成反应,并以良好的产率获得了一系列常见饱和杂环(如:哌啶、吗啉、哌嗪)的双环生物电子等排体。此外,计算和机理研究进一步支持三重态氮宾的双自由基可以传递到侧链烯烃的π-体系,从而在后期系间窜越时诱导[2+2+1]环加成反应,同时抑制需要(早期)系间窜越的[2+1]环加成过程(图1B)。相关成果发表在Science 上。
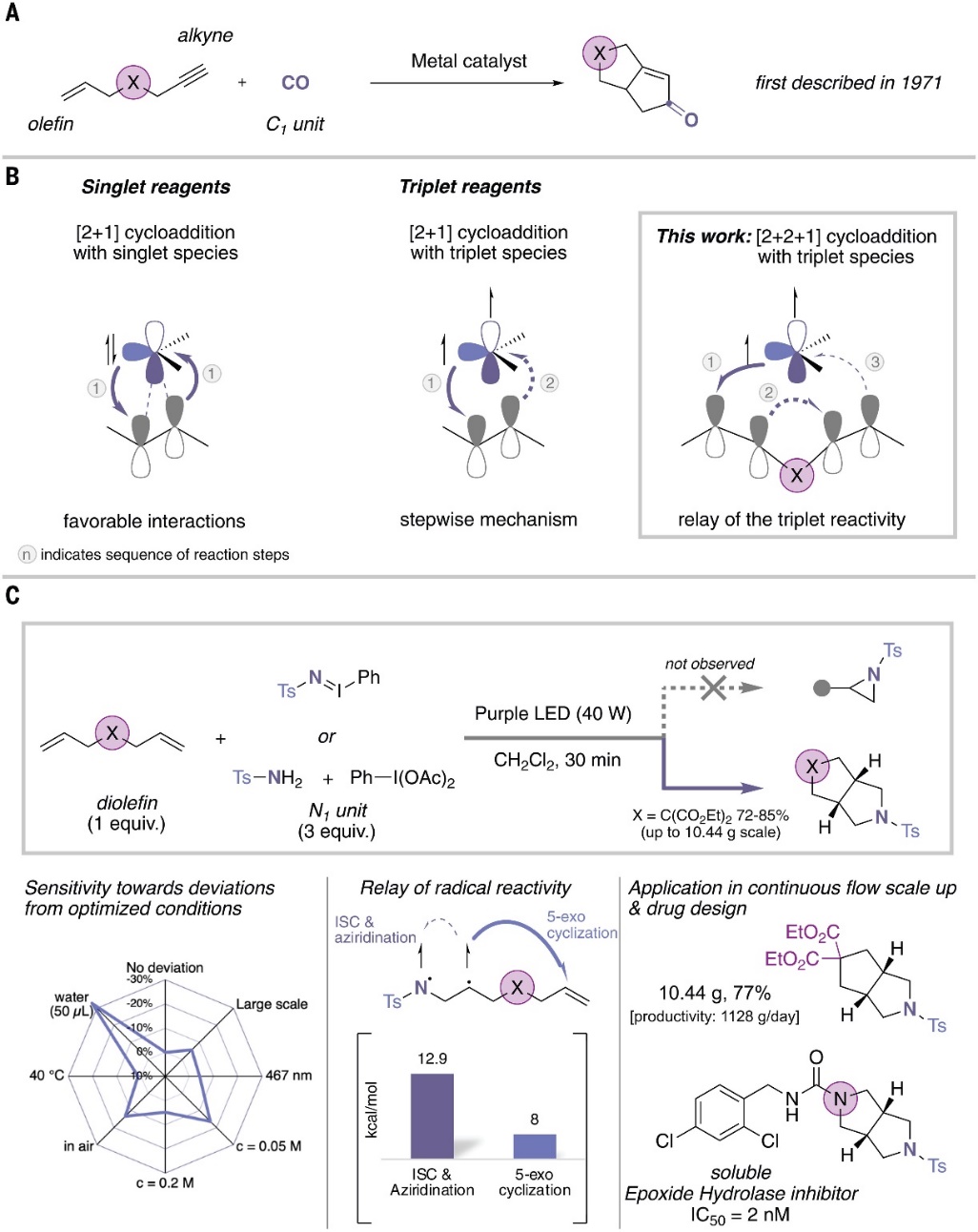
图1. [2+2+1]环加成反应。图片来源:Science
首先,作者选择二烯丙基丙二酸二乙酯1为模板底物、iminoiodinane 2为N1合成子、CH2Cl2为溶剂在紫光照射下进行反应(图1C),能以高产率获得单一的非对映异构体——3-杂氮-双环[3.3.0]-辛烷3,而且能够实现大规模反应(高达10 mmol)。值得一提的是,对粗反应混合物进行NMR分析后没有观察到氮丙啶化反应的副产物,进一步证实了三重态氮宾中间体的双自由基可以传递到侧链烯烃的π-体系。另外,该反应仅对水较为敏感,而空气、反应物浓度和温度变化对反应产率的影响很小。在最优条件下,作者对iodinane试剂的底物范围进行了考察(图2),结果显示不同基团取代的iodinane试剂与二烯丙基丙二酸二乙酯或3,3-二烯丙基戊二酮进行反应时,能以良好的产率(62-88%)获得芳基磺酰基保护的3-杂氮-双环[3.3.0]-辛烷衍生物(3-11)。此外,一系列环状双烯丙基化合物同样能兼容该反应,以65%-92%的产率获得2-杂氮-双环-[3.3.0]-辛烷的螺环衍生物(12-14),但是苯并环的引入会导致产率有所降低(15、16,均为45%)。值得一提的是,1,6-庚二烯、二烯丙基醚和Ts保护的二烯丙基胺也能顺利实现[2+2+1]环加成反应,并以58-71%的产率获得哌啶、吗啉和哌嗪的生物电子等排体(17-19)。尽管取代烯烃底物也能以45-51%的产率获得含有甲基骨架的2-氮杂-双环-[3.3.0]-辛烷(20-21),但是环化产物的dr值显著降低。
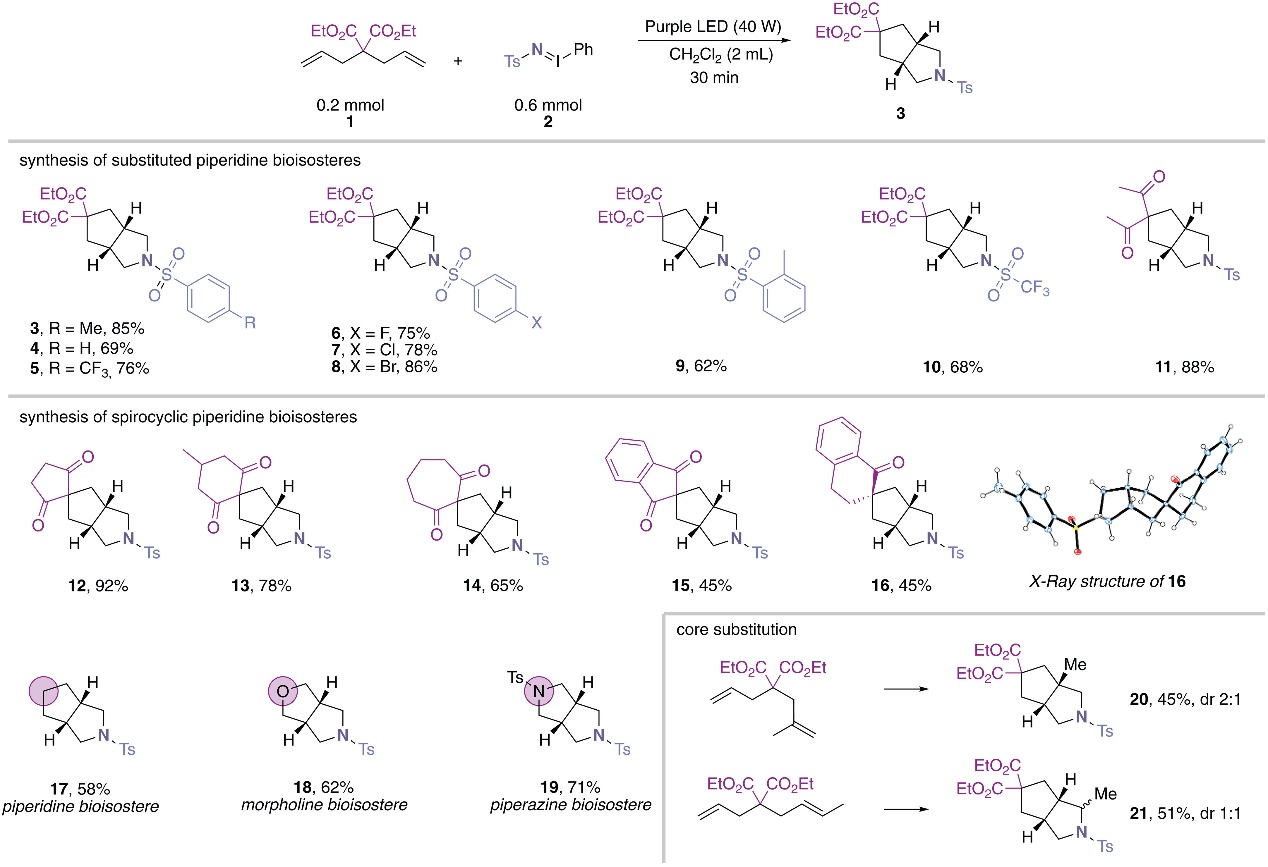
图2. 底物拓展6-元脂肪族N-杂环的生物电子等排体的底物范围。图片来源:Science
为了避免iodinane试剂的分离,作者尝试在光化学条件下原位生成磺酰基保护的iminoiodinane以实现一锅法合成策略,具体而言:磺酰胺(22)、二乙酰氧基碘苯(23)与二烯1在370 nm光照下能顺利进行三组分反应,并以95%的产率获得2-氮杂-双环-[3.3.0]-辛烷化合物3(图3)。随后,作者探索了一锅法反应的底物范围,结果显示硝基取代芳基磺酰胺、邻位/间位取代芳基磺酰胺、杂芳基取代磺酰胺甚至氨基磺酸盐均可兼容该反应,以48-95%的产率获得相应取代哌啶的生物电子等排体(22-30)。此外,该策略也可用于合成吗啉类和哌嗪类生物电子等排体(17-19,产率:61-75%),特别是带有两个正交N-保护基团的哌嗪也可以一步法获得相应产物(31-33,产率:46-55%)。值得一提的是,该方法不仅能一步法合成AZD-1446前体(34,产率:26%),而且还能实现药物分子塞来昔布和伐地昔布的后期修饰(35-42),从而一步在药物分子中高效引入氮杂环生物电子等排体。
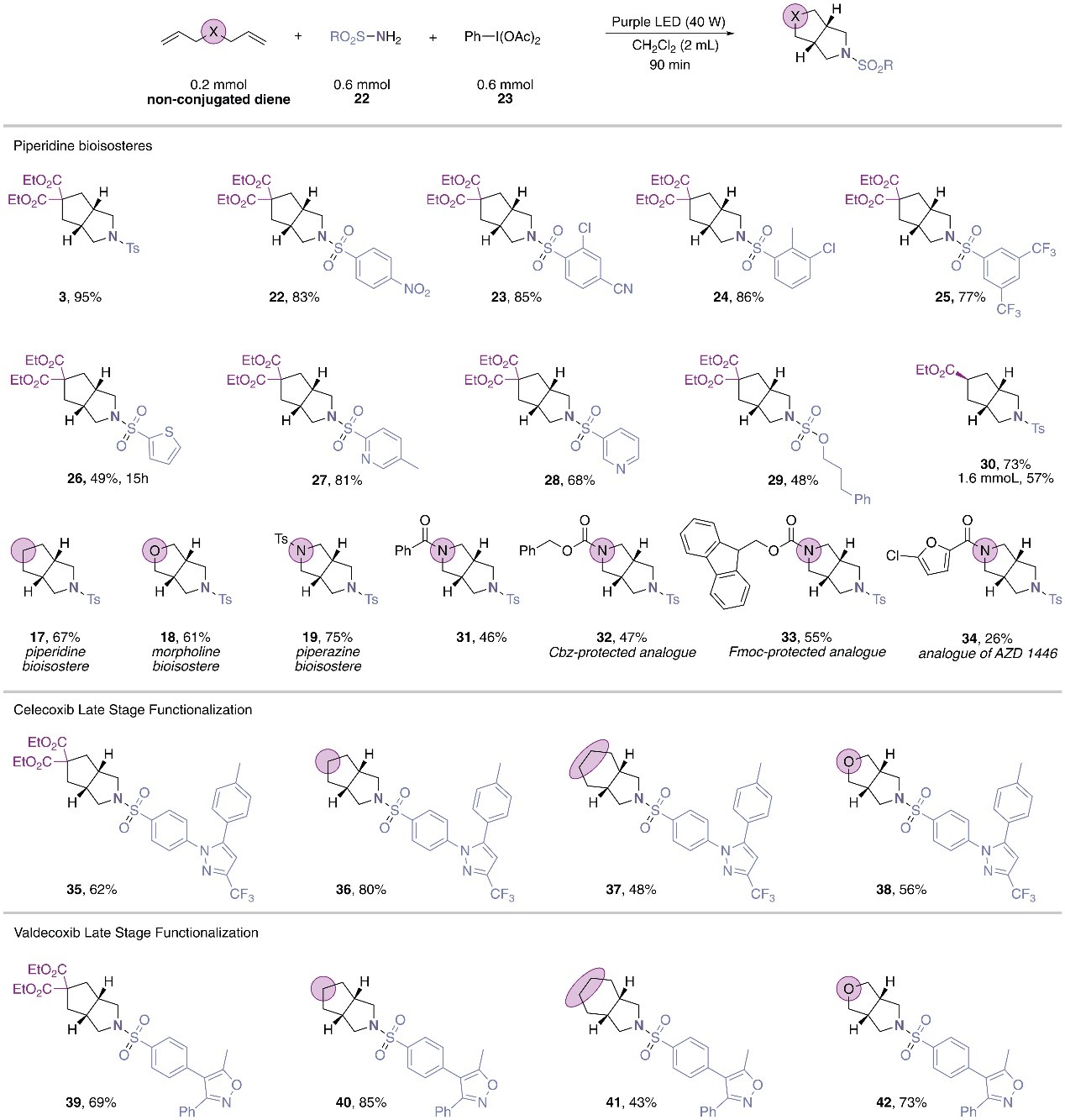
图3. 一锅法底物拓展。图片来源:Science
为了实现流动化学合成,作者以DCM和甲醇为二元混合溶剂并采用两个光反应器(每个体积160 mL、840 W LED、365 nm、流速30 mL min -1),而且每个光反应器都配备预冷装置以减少反应混合物的不必要加热。事实上,使用三种试剂的0.08 M预混溶液进行反应时能产生10.44 g(77%)的3-氮杂-双环-[3.3.0]-辛烷3,这相当于每天>1.1 kg的生产力(图4A)。其次,为了评估3-杂氮-双环-[3.3.0]-辛烷作为生物电子等排体的功效,作者将该结构引入两组可溶性环氧化物水解酶(sEH)抑制剂的药效团中(图4B),其中酯基取代的3-氮杂-双环-[3.3.0]-辛烷30经酯基水解、1-丙基膦酸酐介导的酰胺偶联获得酰胺类sEH抑制剂44和45;而不对称保护的3,7-二氮杂-双环-[3.3.0]-辛烷31经脱保护基、与烷基取代异氰酸酯的反应制备了脲基sEH抑制剂47和48。随后,作者对sEH抑制剂的生化性能进行了研究(图4C),具体而言:1)通过监测重组人sEH对荧光底物3-苯基氰基(6-甲氧基-2-萘基)甲酯-2-环氧乙烷乙酸的转化,发现四种化合物均在低纳摩尔浓度范围内显示出高活性和IC50值;2)在DPBS缓冲液(pH 7.0~7.3)中sEH抑制剂在浓度为20-100 μM时达到溶解度极限。在大鼠肝微粒体中,脲基衍生物被迅速降解,而酰胺衍生物的清除率明显较低;3)平行人工膜渗透性试验表明44、47和48的lgPe值较高(渗透性好),而45几乎不透水。由于参数在类药物范围内,上述实验结果共同证明3-杂氮-双环-[3.3.0]-辛烷骨架作为药物化学有用构建砌块的实用性。值得注意的是,作者还通过sEH与45和48的共晶结构来确认它们的结合模式,结果表明这两种配体都以完全占有的方式存在于晶体结构中并且二者位于活性位点内(图4D)。尽管1,3-二氯苯在两个配合物中占据相同的位置,但是45和48之间的碳氮转换似乎导致了tosyl基团的取向明显不同。
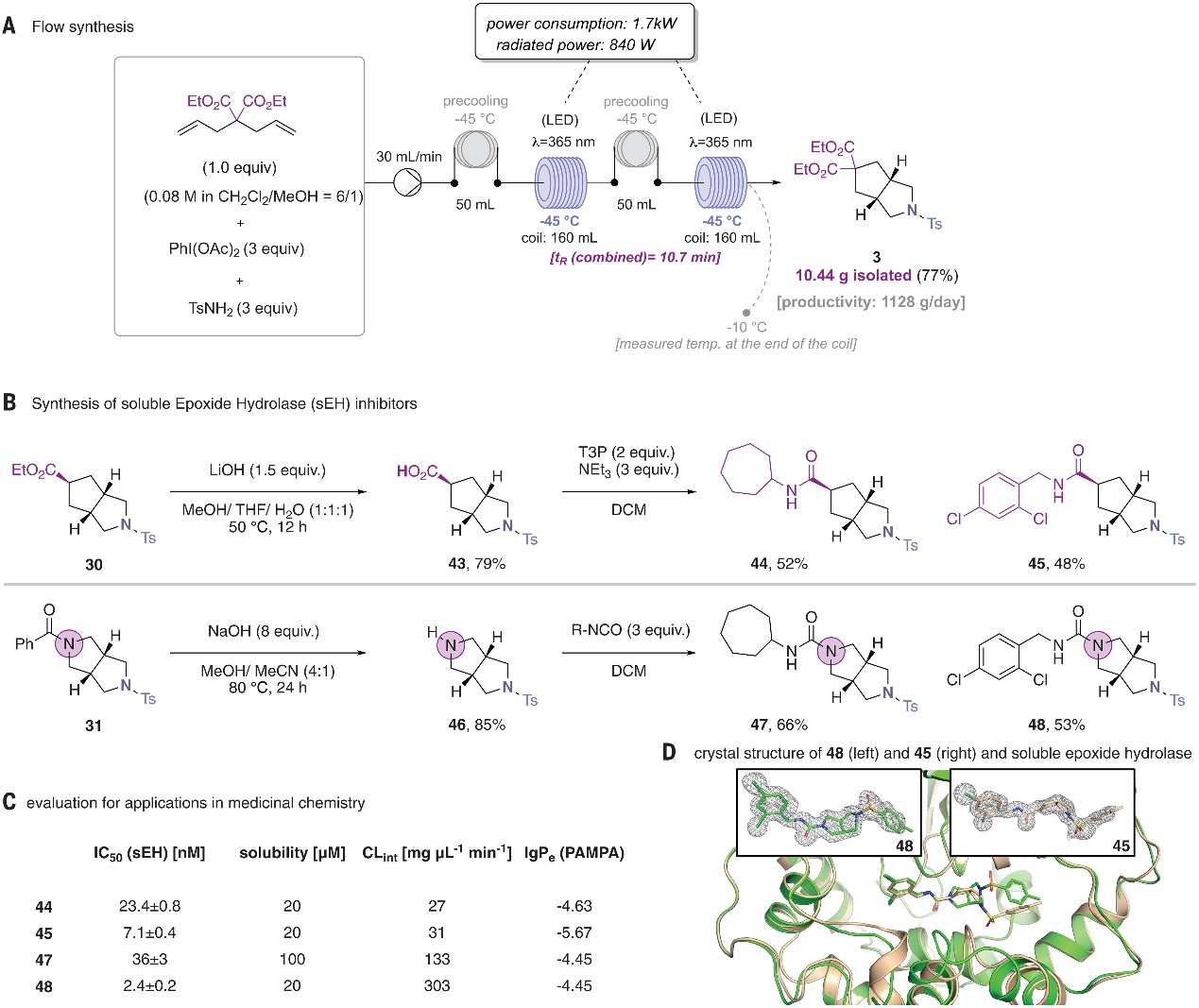
图4. 合成应用。图片来源:Science
最后,作者进行了一系列实验来探究反应机理,具体而言:1)以TEMPO或DMPO作为自由基捕获剂的自由基实验表明3-杂氮-双环-[3.3.0]-辛烷3的形成被完全抑制,并且仅观察到氮宾前体的分解反应;2)对不同光源的研究发现仅在370 nm光照下才能通过HR-MS分析观察到iodinane 2,这表明近紫外光才可引发三组分反应;3)氮杂环丙烷49在光化学条件下很稳定,并不发生开环反应,进而证明其不是该反应的主要中间体(图5A);4)密度泛函理论(DFT)计算显示从三线态氮宾INT1开始(图5B),单个烯烃单元末端碳的加成反应有利于得到INT2并且INT2仍处于三线态,此三线态中间体可以产生四个不同的基本反应步骤:1)通过系间窜越形成氮丙啶副产物49,但是该转变的最小能量交叉点为12.9 kcal mol-1;2)INT2可以发生5-exo-trig环化,其中碳中心自由基加成到相邻烯烃单元的近端碳原子上并得到一个三线态中间体,其可以通过TS2(8.0 kcal mol-1)得到cis-构型的INT-3,或者通过TS3(12.3 kcal mol-1)得到trans-构型中间体;3)经6-edno-环化生成六元环中间体;4)通过氢原子转移形成烯酰胺。由于后两种途径的活化自由能明显更高,因此这两种途径都被舍弃(TS4和TS5)。综上所述,初始加成产物INT2在系间窜越的高能垒导致了三线态反应性的传递,从而有利于5-exo-trig环化并导致[2+2+1]环加成反应和3-杂氮-双环-[3.3.0]-辛烷3骨架的形成。
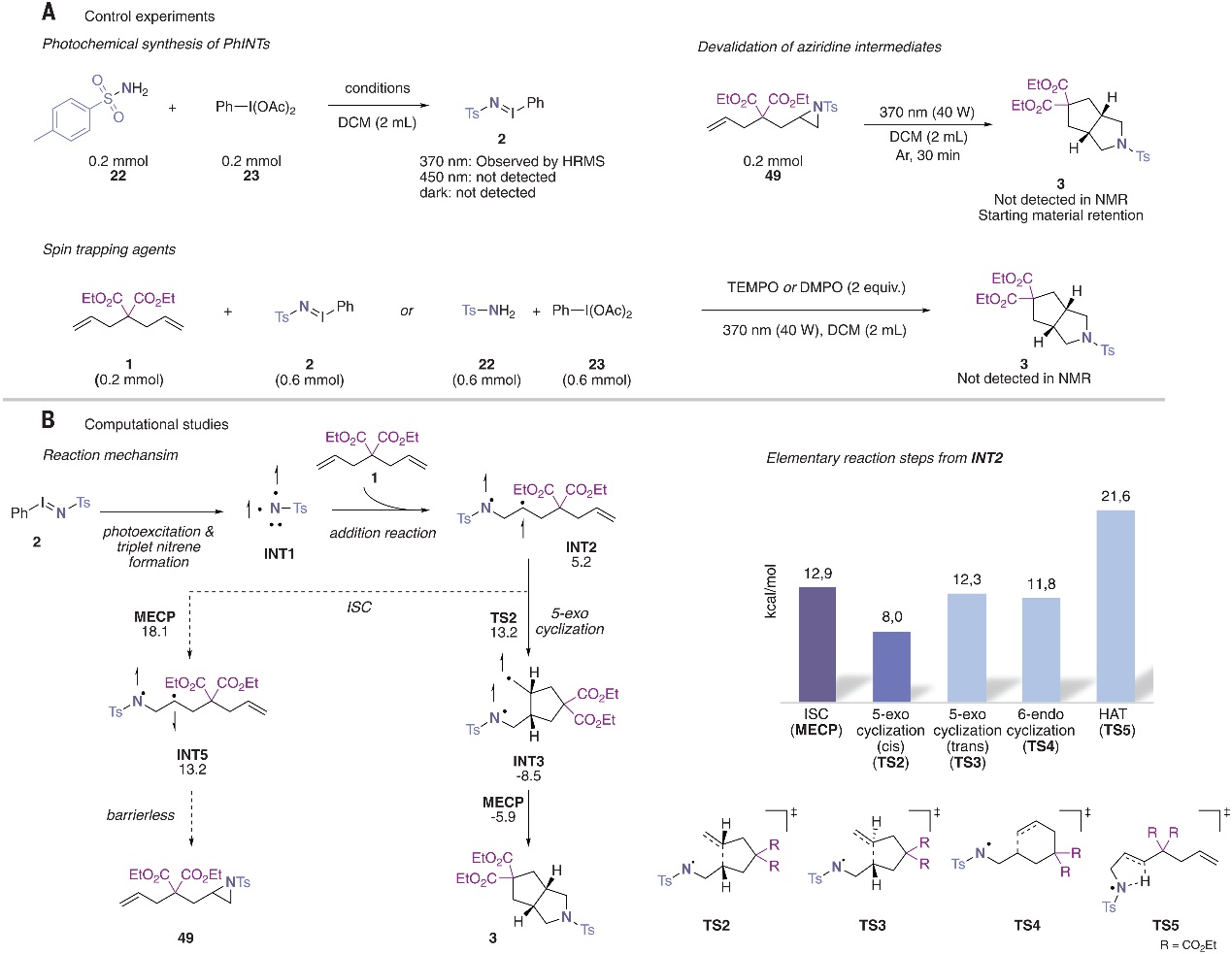
图5. 机理研究。图片来源于: Science
总结
Rene M. Koenigs教授课题组在可见光催化下,实现了氮宾作为N1单元的类Pauson-Khand型环加成反应,成功地构建了一系列常见饱和杂环(如:哌啶、吗啉和哌嗪)的双环生物电子等排体,进而克服了经典Pauson-Khand反应只能用一氧化碳作为C1单元的限制。此外,实验和计算机理研究表明具有三线态双自由基性质的氮宾是反应的关键中间体。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Photosensitization enables Pauson-Khand–type reactions with nitrenes
Fang Li, W. Felix Zhu, Claire Empe, Oleksandr Datsenko, Adarsh Kumar, Yameng Xu, Johanna H. M. Ehrler, Iuliana Atodiresei, Stefan Knapp, Pavel K. Mykhailiuk, Ewgenij Proschak, Rene M. Koenigs
Science, 2024, 383, 498-503, DOI: 10.1126/science.adm8095
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号