武汉大学沈晓课题组JACS:通过调控有机硼配合物的反应性发散合成氟烷基酮
氟是电负性最大的元素,而C-F键是与碳相连的键能最大的单键。由于氟和C-F键的独特性质,将氟原子引入有机分子中往往可以提高分子的亲脂性、代谢稳定性和生物利用度。因此,“氟引入”已成为药物开发中的常规策略。氟烷基酮类化合物广泛存在于生物活性分子中,如Zifrosilone、WT AgAChE 抑制剂 A、FKGK11类似物、Z-VAD-FMK和FKE (图1a)。在许多情况下,氟烷基中氟的个数会影响分子的活性。例如,WT AgAChE 抑制剂 A比它的CF3和CH2F类似物更有效。过渡金属催化有机硼化合物与氟化试剂之间的交叉偶联反应常常被应用于合成氟烷基酮类化合物。在这些反应中,有机硼配合物具有独特的性质。有机硼配合物与过渡金属催化剂之间的转金属化是获得诺贝尔奖的Suzuki-Miyaura偶联的关键步骤之一。但是通过这些方法只能产生一种类型的氟烷基酮,而合成其他类型的氟烷基酮需要重新合成新的氟化试剂。此外,这些过渡金属催化的反应通常不能容忍I、Br甚至Cl。然而筛选数以千计的分子以寻找潜在的化合物用于药物研究的需求促使化学家们开发更加有效的合成方法。在这种背景下,发散性合成反应引起了科学家们的极大关注,因为这种反应可以通过控制反应中间体和反应路径,从相同的底物选择性地制备多个产物。因此,开发从一种简单的氟化试剂应用于合成各种氟烷基酮的发散合成是非常必要的。
最近,武汉大学沈晓(点击查看介绍)课题组报道了一种可见光诱导的有机硼酸酯与氟烷基酰基硅烷的反应来发散性合成氟烷基酮化合物。控制原位生成的有机硼配合物的反应性是实现发散性转化的关键。在光照下,氟烷基酰基硅烷可以作为独特的供体-受体卡宾前体,与普通酰基硅烷衍生的亲核卡宾表现出不同的反应活性。在可见光照射或者可见光催化条件下,氟烷基酰基硅烷2生成供体-受体卡宾I,与有机硼酸酯底物1配位生成配合物II,R基发生1,2-迁移后生成有机硼中间体III。如果在碱性条件下处理中间体III,有机硼配合物发生脱硼氟消除反应,生成烯醇硅醚中间体IV,该中间体与各种亲电试剂反应生成氟消除的酮类化合物。此外,当中间体III与过氧化氢结合时,将产生配合物IV’;在此情况下,如果1,2-氟烷基迁移优于脱硼氟消除,可能会产生中间体V’,进而水解得到各种氟烷基酮类化合物4。这种无过渡金属参与的反应操作简单,芳基、杂芳基、烯基和烷基硼酸酯都是合适的底物。作者通过克级反应、生物活性分子及其氟烷基类似物的简便合成,证明了其合成潜力。
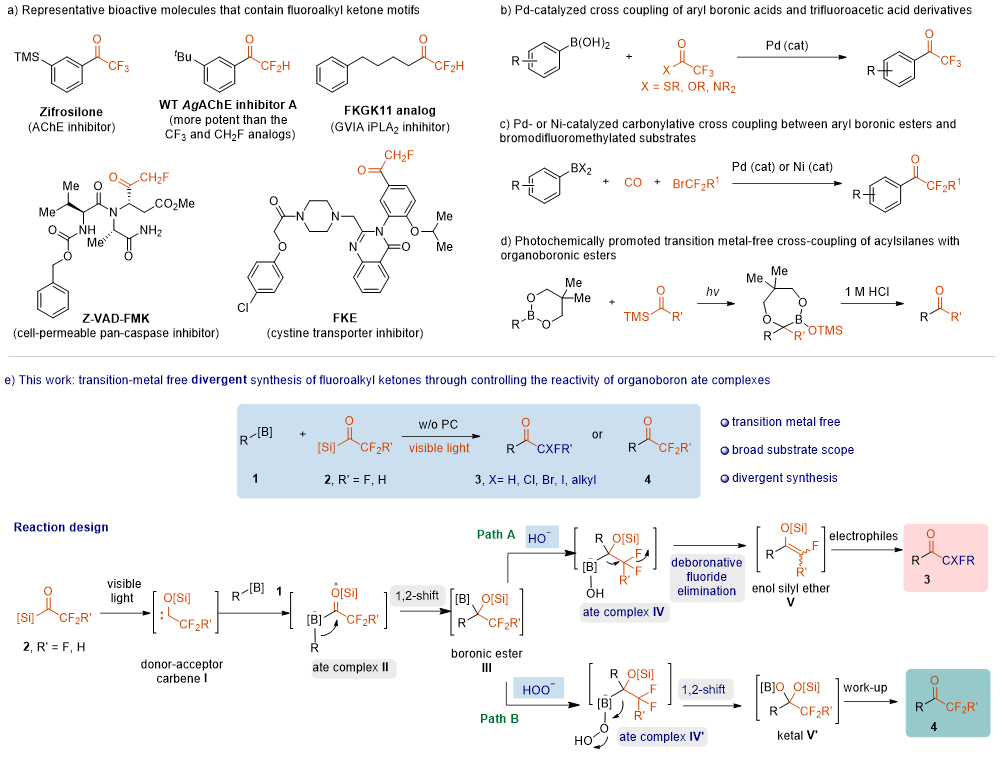
图1. 研究背景与合成策略
作者发现,当使用NaOH水溶液进行后处理时,从二氟甲基酰基硅烷出发可以高效的得到单氟甲基酮。在优化的条件下,作者考察了有机硼化合物的底物普适性(图2)。一系列具有中性、贫电子或富电子取代基的芳基硼酸酯与试剂2a均可顺利反应,得到单氟甲基酮3a~3r,产率为43%~82%。该反应也可以进行克级规模放大,以75%的产率获得3a。F、Cl、Br和I均可以兼容,给电子体和吸电子底物也是可以兼容的。当使用空间位阻的邻甲基取代芳基硼酸酯为底物时,3p的产率仅为35%,但当加入1.5mol%的4CzIPN为光催化剂时,3p的产率提高到69%。此外,该反应可以兼容芳香酮和脂肪酮,分别以59%的产率得到化合物3n和以51%的产率得到化合物3r。作者发现杂芳基硼酸酯也可以作为底物,以44%的产率得到化合物3s,以61%的产率得到化合物3t。不幸的是,当使用烯基硼酸酯作为底物时,由于光诱导形成硼酸盐络合物的效率较低,3u的产率不到2%。而当加入1.5 mol%的4CzIPN作为光催化剂时,生成硼酸盐络合物的效率大大提高,3u的产率为54%,E/Z比1/2。进一步的研究发现,光催化剂的加入有效的提高烷基硼酸酯参与反应的产率。在相同条件下,以53%~78%的产率合成了烷基单氟甲基酮3w~3ab。值得注意的是,产物3ac是合成BAY 1217224的关键中间体。
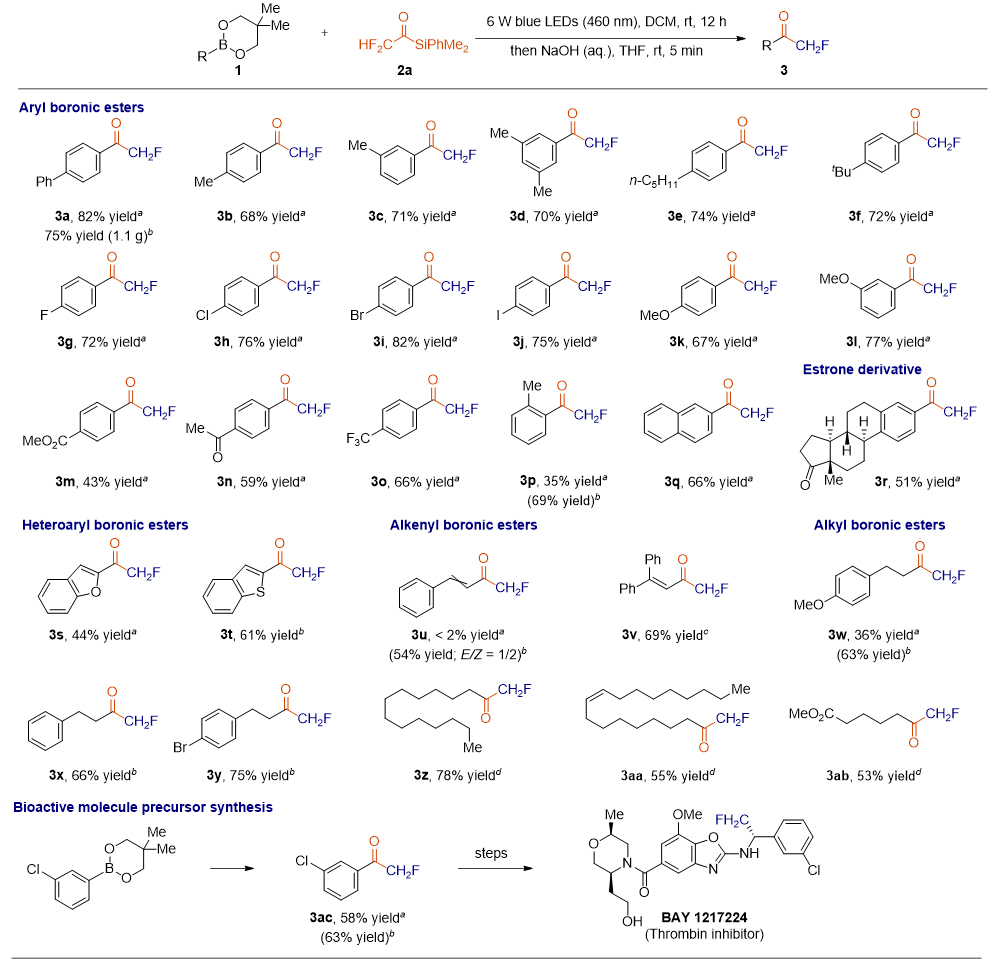
图2. 单氟甲基酮的底物拓展
作者又发现,当使用H2O2和NaOH的水溶液进行后处理时,从二氟甲基酰基硅烷出发可以高效的得到二氟甲基酮。在该反应的最佳条件下,作者对底物的普适性进行了考察。几种烷基取代芳基硼酸酯以60%~92%的产率得到了二氟甲基酮4b~4f。该反应可以兼容Cl、Br、I、OMe、COMe、COMe等官能团,以50%~79%的产率得到二氟甲基酮4g~4m。也能以75%的产率成功合成二氟乙酰萘4n。当以邻甲基取代芳基硼酸酯为底物时,加入1.5%的4CzIPN时,可使4o的产率从45%提高到71%。同时作者也对各种杂环化合物进行了考察,以53%~85%的产率得到二氟酰基化的苯并呋喃4p、二苯并呋喃4q、苯并噻吩4r、吲哚衍生物4s和4t以及吡咯衍生物4u。然而,该反应并不能兼容吡啶类化合物。值得注意的是,但使用生物活性的Cholonerton、Estrone和Fenofibrate衍生物时,也能以45%~58%的产率得到4w~4y,突出了该方法的合成潜力。此外,当4CzIPN被用作催化剂来促进光催化的有机硼酸络合物的形成时,烯基硼酸酯效果很好,化合物4z的产率为65%,E/Z为1/3。进一步增加试剂2a的用量,能以75%的产率合成4aa。进一步的研究表明,伯烷基硼酸酯、仲烷基硼酸酯和叔烷基硼酸酯都可以兼容该反应(4ab~4ak,产率57%~89%)。空间位阻较大的底物需要3当量的试剂2a才能获得以较高的产率得到4ae (产率为59%),而在空间位阻较小的底物中,仅1.5当量的试剂2a就能以75%的产率得到化合物4ab。
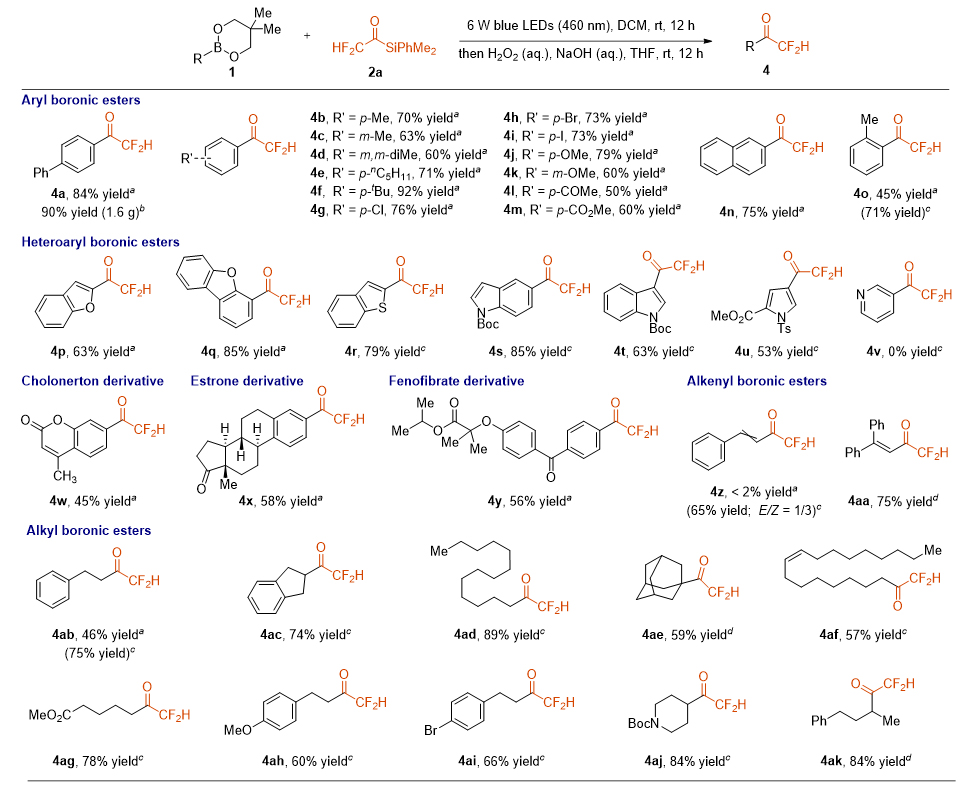
图3. 二氟甲基酮的底物拓展
在实现了由二氟甲基酰基硅烷发散合成单氟甲基酮和二氟甲基酮的基础上,作者也研究了以具有代表性的芳基、杂芳基、烯基和烷基硼酸酯为原料与三氟甲基酰基硅烷合成三氟甲基酮的方法。如图4所示,以4CzIPN为光催化剂,以较高的产率(5a~5f,71%~83%)合成了多种三氟甲基酮。此外,作者还尝试了一种光学纯的烷基硼酸酯,以53%的产率分离了相应的三氟甲基酮5g,ee为93%。ee值并没有明显下降,进一步证明了该方法的合成潜力。
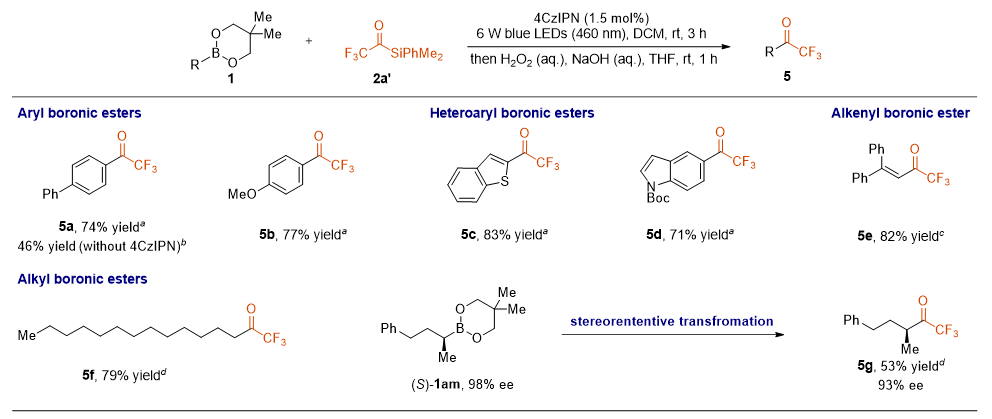
图4. 三氟甲基酮的底物拓展
作者接下来进行了实验探索可能的中间体(图5)。首先,当化合物1a和1.2当量的2a在室温下用蓝光照射12 h后,得到> 98%的卡宾插入化合物6a(图5a)。其次,用氢氧化钠处理光照的混合物后,分离得到单氟烯醇硅醚中间体7a(图5b)。在底物范围的探索过程中,作者发现在化合物4af的合成中可以耐受脂肪族的内烯烃(图3,产率为57%)。沈晓课题组2022年报道了由化合物2a生成的二氟甲基硅氧卡宾可以与末端烯烃反应生成环丙烷化产物(Angew. Chem. Int. Ed. 2022, 61, e202202175)。因此,作者研究了苯乙烯8和芳基硼酸酯1a之间的竞争反应,发现1a优于8,尽管6a的产量仅为18%(图5c)。当以1.5 mol%的4CzIPN作为催化剂,6a的产率提高到95%,环丙烷化产物9的含量小于1%(图5c)。化合物10在与2a反应中烯烃和硼酯位点的分子内竞争也支持硼酸酯的有利反应性(图5d,11,产率< 1%;12, 产率65%)。化合物13经后处理后分离得到,产率为60%。Studer课题组曾经报道中性亲核氨基自由基在某些烯烃存在时更倾向于攻击烷基硼酸频哪酯(J. Am. Chem. Soc. 2023, 145, 8770-8775)。由于4CzIPN是已知的三线态-三线态能量转移催化剂,4CzIPN的加入可能有利于三线态卡宾的形成,但不能排除单线态卡宾参与该反应的可能性。
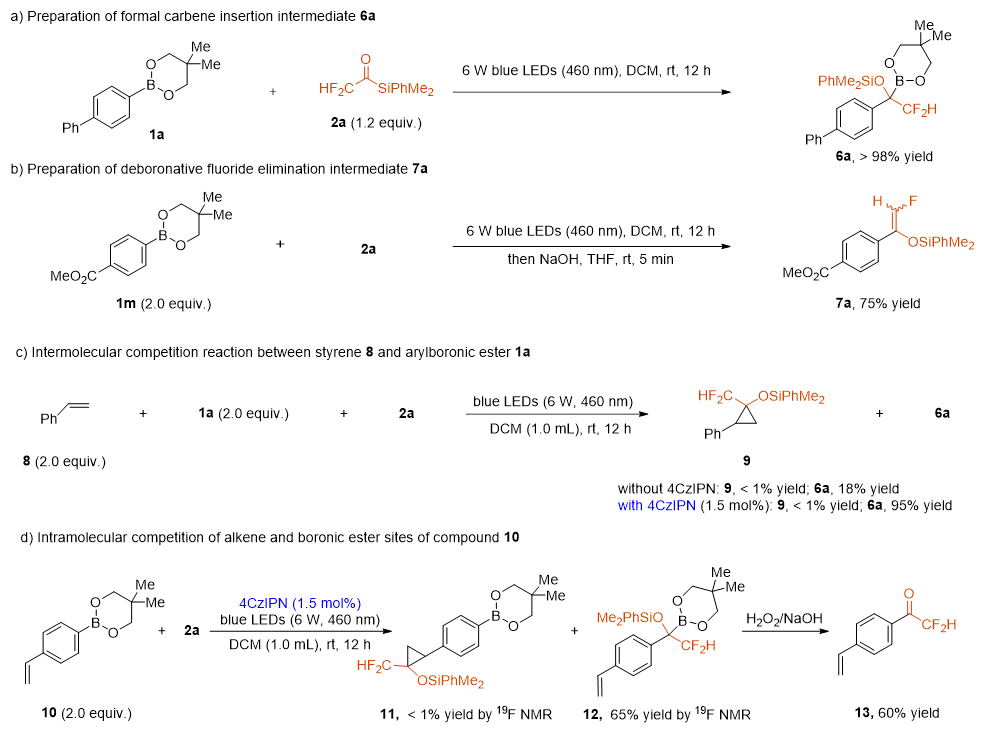
图5. 中间体6a和7a的分离及竞争反应
作者发现利用该反应过程中产生的中间体7a可以有效制备各种氟化烷基酮化合物,实现了氯代、溴代、碘代等卤化反应,以及与醛的Aldol反应(图6a)。同时,以氧杂蒽作为烷基自由基的前体时,也可以与化合物7a发生光催化烷基化反应。此外,利用1m和2a’的反应,得到二氟烯醇硅醚的中间体19,不需要分离,即可一锅法得到20~24二氟烷基化酮。该方法还可以应用于合成齐罗硅酮及其单氟和二氟衍生物的合成,展示了该方法的实用性。
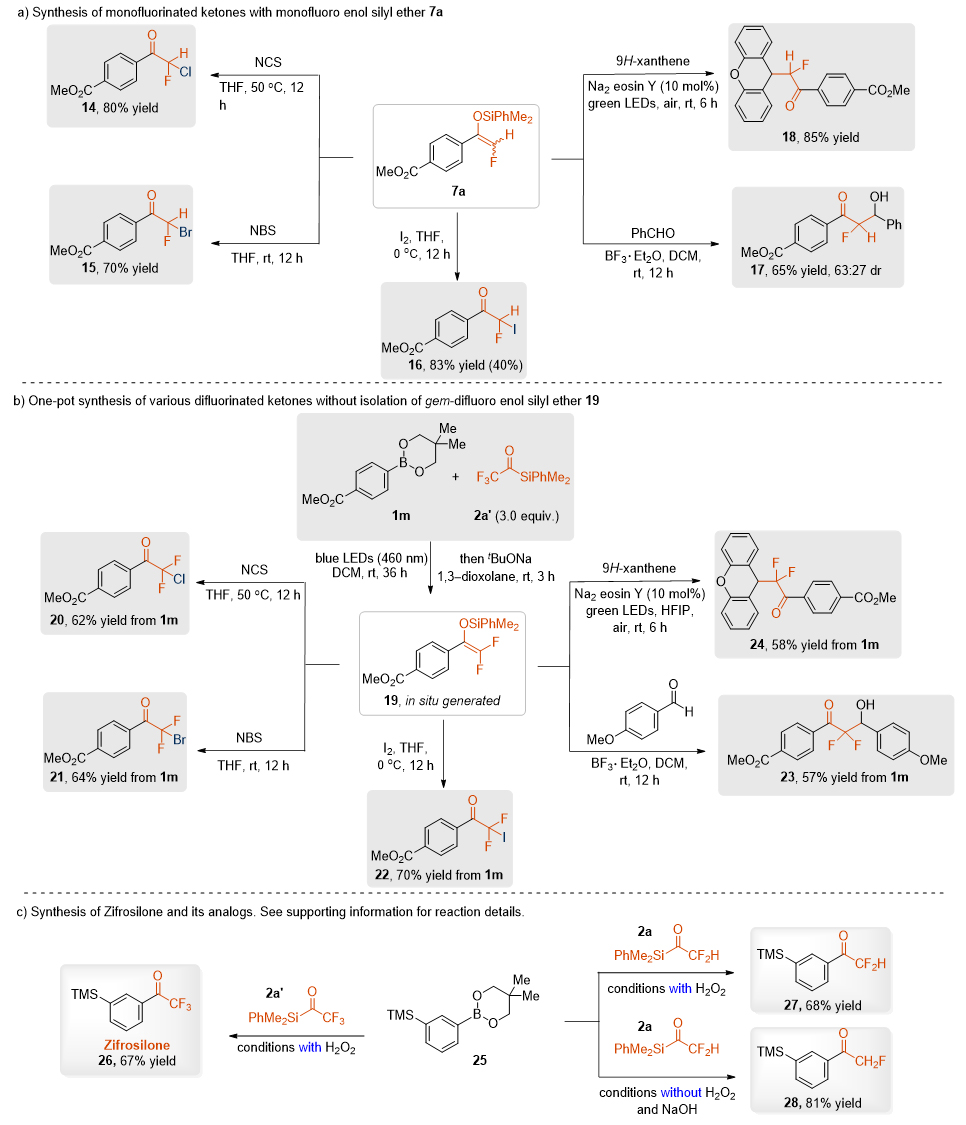
图6. 合成应用
小结
在该工作中,武汉大学沈晓教授团队开发了一种发散性合成方法,通过控制原位生成的有机硼配合物的反应性,利用单一的二氟甲基酰基硅烷试剂合成各种氟烷基酮。三氟甲基酰基硅烷也被用于合成三氟甲基酮。广泛的芳基、杂芳基、烯基和烷基硼酸酯在可见光诱导、无过渡金属参与的条件下都是兼容的,以良好的产率得到各种氟烷基酮。该反方法成功的应用于合成齐罗硅酮及其氟烷基类似物的生物活性分子,展示了其合成潜力。博士后周刚和硕士研究生郭传传为本文的共同第一作者。该研究得到了科技部、中央高校基本科研业务费和国家自然科学基金委的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Divergent Synthesis of Fluoroalkyl Ketones through Controlling the Reactivity of Organoboronate Complexes
Gang Zhou, Zhuanzhuan Guo, Shanshan Liu, and Xiao Shen*
J. Am. Chem. Soc., 2024, DOI: 10.1021/jacs.3c12150
沈晓课题组正在快速发展中,热招博士后、特聘副研究员,欢迎有志青年加入课题组,请感兴趣的同学请直接联系沈晓老师 (xiaoshen@whu.edu.cn) 课题组网页: https://xiaoshen.whu.edu.cn/index.php
沈晓
https://www.x-mol.com/university/faculty/45852
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号