Nature:烯烃1,3-双官能团化的“新概念”
副标题:通过“电荷迁移”实现烯烃的立体发散性1,3-双官能团化反应
烯烃是化学中不可缺少的原料,其官能团化反应是本科有机化学课程的主要内容之一,可大致分为以下两类:1)C=C双键短暂(如:烯烃复分解)或永久(如:臭氧分解)断裂的转化;2)反应产物保持原有C-C σ-键连接(如:1,2-双官能团化)的转化。迄今为止,化学家已经报道了许多过渡金属催化的烯烃1,3-双官能团化反应(图1a),但是这些方法往往需要向底物中引入导向基或限制基(“stopper”)来实现区域选择性,这主要是因为C(sp3)-M物种倾向于β-H消除,从而产生Heck产物。类似地,化学家对烯烃的Friedel-Crafts型反应也进行了广泛研究,并证明酰基阳离子参与的反应可以得到1,2-双官能团化产物,而且产物分布通常高度依赖于底物、试剂和溶剂的性质(图1b,顶部)。有趣的是,烯烃的Friedel-Crafts型反应也能实现烯烃的远程官能团化(图1b,底部),但是该转化的选择性难以控制并通常得到1,2-和1,3-双官能团化产物的混合物,除非在特定底物下才能实现高选择性。
近日,奥地利维也纳大学的Nuno Maulide教授(点击查看介绍)课题组利用电荷迁移(charge relocation)策略,成功地实现了未活化烯烃的立体发散性1,3-双官能团化反应(图1c),并以良好的产率获得相应的syn-或anti-羟基酰化产物,同时无需导向基。该策略能用于肺毒素4-ipomeanol及其衍生物的合成,进一步展现出其实用性。相关成果发表在Nature 上。
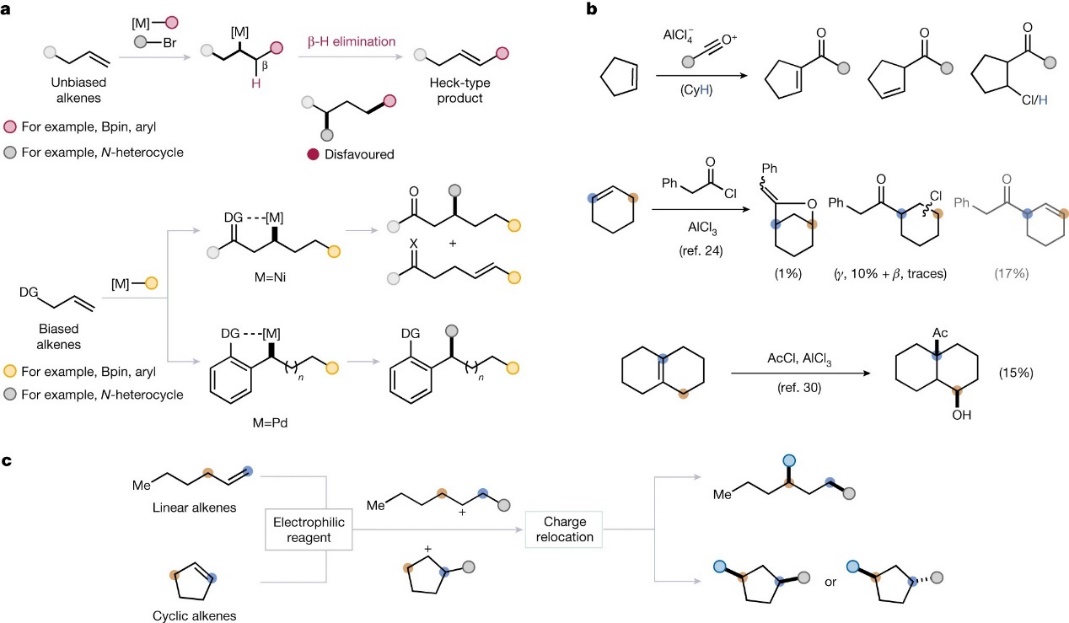
图1. 烯烃远程官能团化的实例。图片来源:Nature
首先,作者选择环己烯为模板底物对反应条件进行优化,结果显示在带有非亲核性六氟锑酸盐(抗衡阴离子)的酰基阳离子(由酰基氯化物和六氟锑酸银原位生成)作用下进行反应时,能够快速、选择性地形成syn-1,3-羟基酰化产物(图2a)。需要指出的是,该反应的成功很大程度上取决于halophilic试剂的性质,只有六氟锑酸银能以高产率获得产物19,而其它银盐或Lewis酸的转化率较低。在最优条件下,作者对未活化烯烃的底物范围进行了考察(图2b),结果显示一系列不同链长度的线性烯烃(1-5)以及环戊烯(18)均能兼容该反应,以良好的产率获得相应产物,而且还能耐受三氟乙酸酯(3)和邻苯二甲酰亚胺(4)。值得一提的是,含有苄基的4-苯基-1-丁烯进行反应时仅得到1,3-双官能团化产物5,而苄基位点保持不变。其次,作者探索了酰基阳离子的底物适用性,结果显示芳环上带有给/吸电子基团的芳香族酰基阳离子(7-17)、脂肪族酰基阳离子(19-24)、丙烯酰基阳离子(25)甚至杂芳族酰基阳离子(26、27)均能有效地实现这一转化并获得相应产物。有趣的是,当使用降冰片烯进行反应时以60%的产率得到产物28,作者推测其可能通过带正电物种的非经典碳正离子重排形成。如图2c所示,作者还将该方法与先前报道的烯烃1,3-双官能团化反应(依赖于底物而非试剂控制)进行比较,结果显示过渡金属(如:Ni、Pd)催化未活化1-壬烯时没有获得1,3-双官能团化产物,而是观察到Heck偶联或非特异性分解产物。相比之下,本文发展的方法却能以64%的分离产率获得1,3-双官能团化产物2。
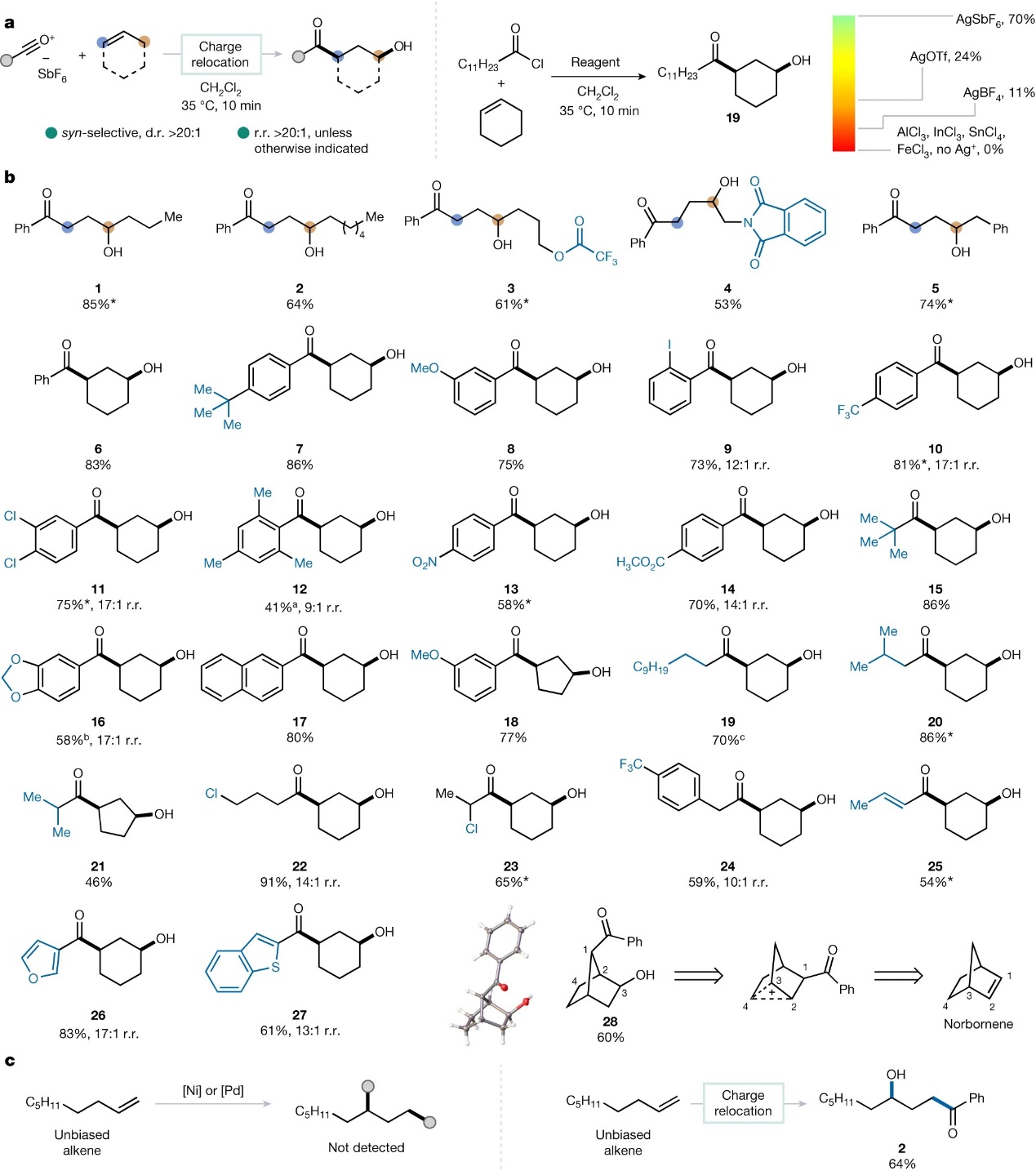
图2. 反应优化和底物筛选。图片来源:Nature
此外,作者发现在后处理前用二甲基亚砜(DMSO)处理反应混合物,就能以较好的产率(61-92%)和优异的立体选择性(>20:1 d.r.)获得anti-1,3-羟基酰化产物(29-37,图3b),从而实现了立体发散性合成。值得一提的是,通过添加其它亲核源(如:氯化物、溴化物、碘化物、N,N-二甲基乙酰胺、N,N-二甲基甲酰胺、氮氧自由基TEMPO)代替水解过程(图3c),可以中等至较好的产率(47-83%)得到相应的anti-卤化产物(38-40)、anti-酰氧基酰化产物(41和42)以及anti-OTMP产物(43)。如图3d所示,当加入DMSO后再用三乙胺处理反应混合物时,能以良好的产率转化为相应的1,3-酮酰化产物(44-49),这也是迄今首例将简单烯烃直接转化为1,4-二羰基化合物的反应。
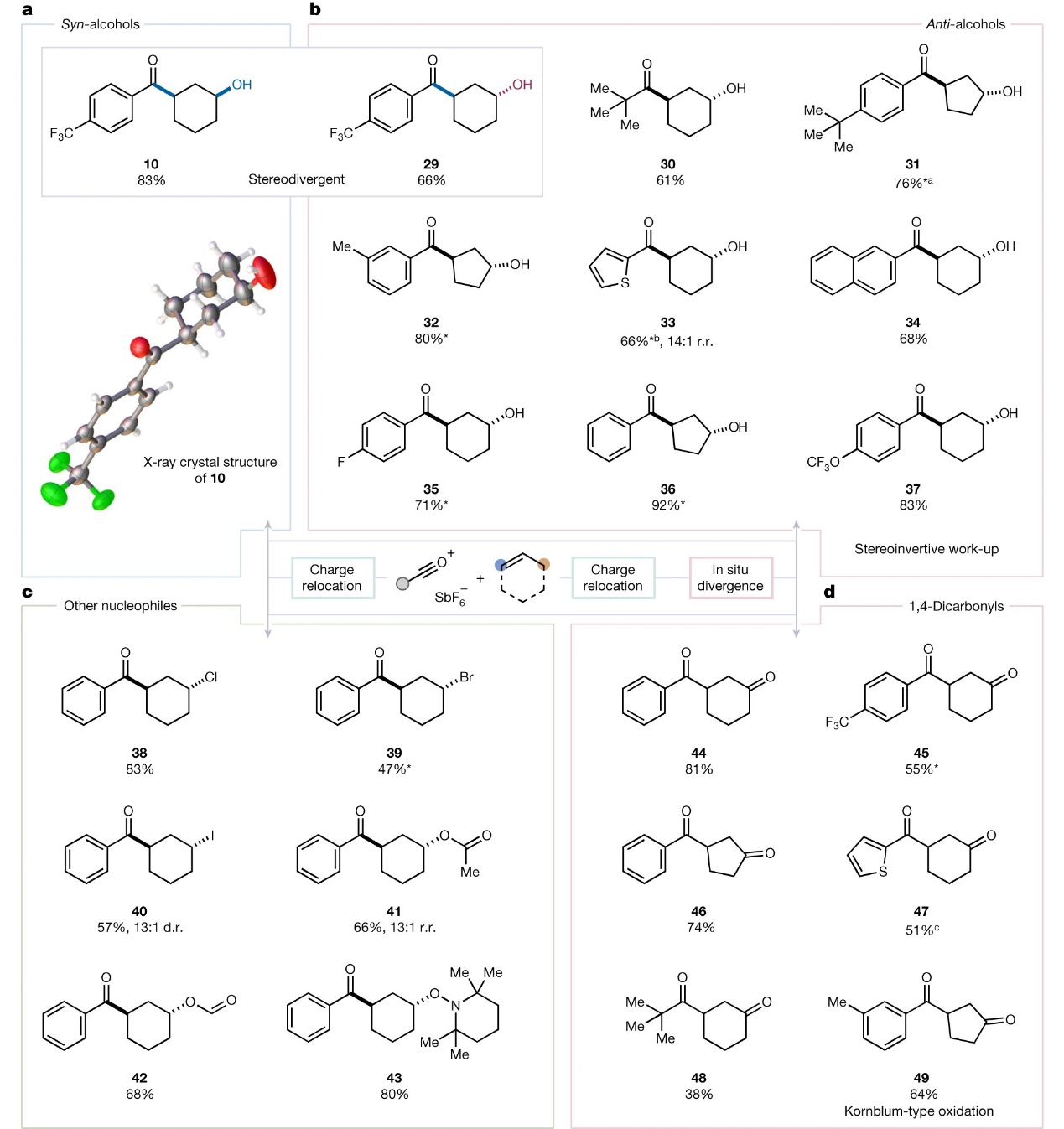
图3. 烯烃1,3-双官能团化反应的立体发散性合成和底物拓展。图片来源:Nature
为了展示该反应的合成潜力,作者以廉价易得的1-丁烯为原料,经烯烃1,3-双官能团化反应一步法合成了4-ipomeanol(50)及其衍生物(51-53),极大地简化了先前的合成步骤(图4a)。随后,作者对反应机理进行了研究,他们认为上述1,3-双官能团化反应主要依赖于快速异构化过程(图4b),即在热力学控制下,亲电加成的第一个中间体β-酮碳正离子转化为重排的环状羰基氧鎓离子rac-I,并且rac-I的形成构成一个锁定状态,进而阻止进一步异构化和非选择性产物的形成。然后,rac-I以水解方式在羰基处断裂并产生syn-构型产物,或者被其它亲核试剂在二级sp3中心(C3)上进行亲核取代以形成上述anti-构型产物。此外,电荷迁移概念可通过图4c所示的机理实验来说明,即无论碳正离子最初在哪里形成(通过溴化物攫取),绝大多数原料都会转化为预期的1,3-双官能团化产物。也就是说,碳正离子被迁移到γ位,而与其新生状态无关。值得一提的是,三取代烯烃1-甲基环己烯在标准条件下进行反应时也能以40%的产率获得单一的非对映体——全syn-羟基酮54(X-射线衍射分析证实其结构),这种立体化学结果可能是由于甲基取向所致(图4d)。
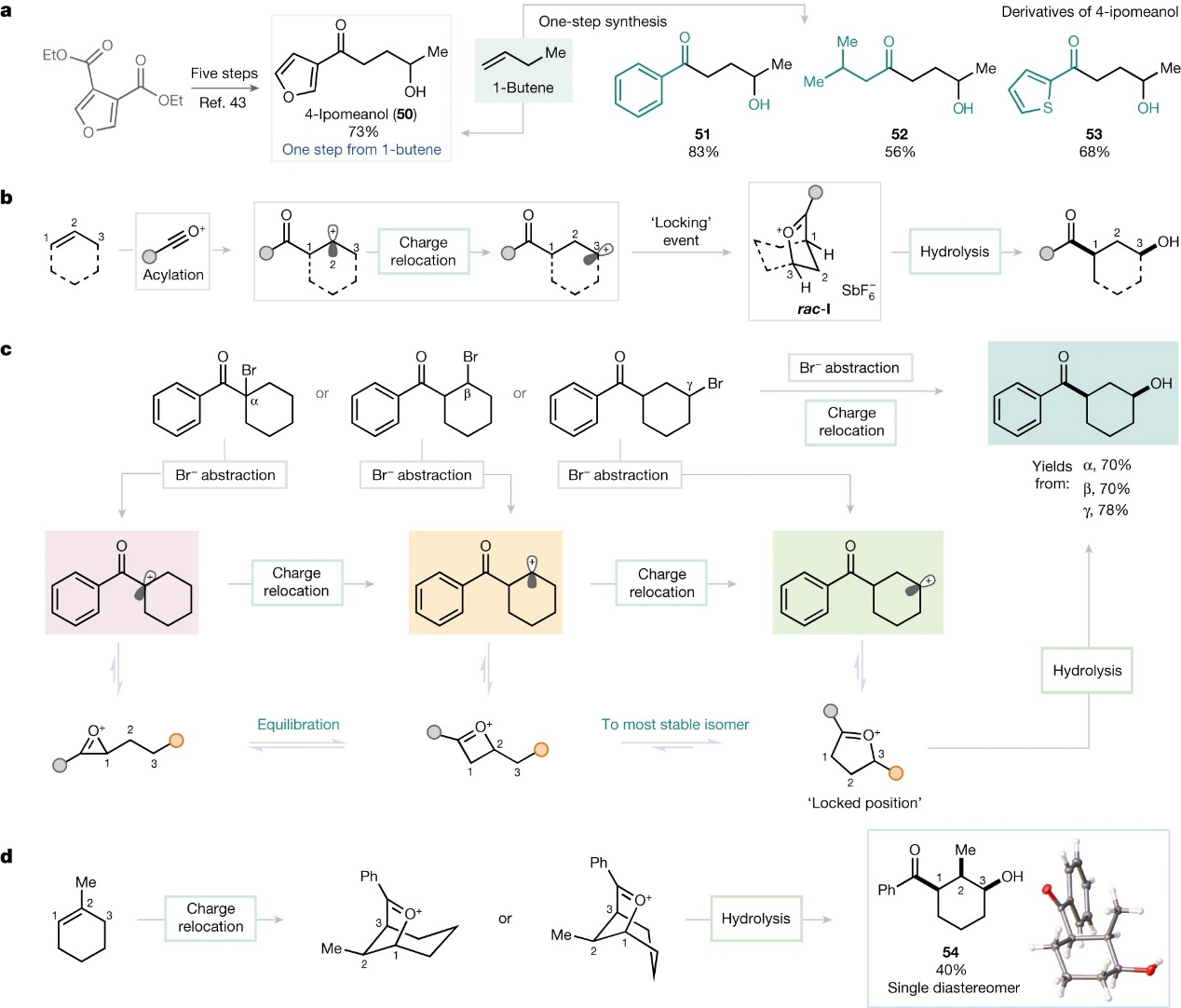
图4. 合成应用及反应机理研究。图片来源:Nature
总结
Nuno Maulide教授课题组利用电荷迁移策略,无需导向基成功地实现了未活化烯烃的立体发散性1,3-双官能团化反应,并以良好的产率获得相应的syn-或anti-产物。基于该策略,该课题组实现了肺毒素4-ipomeanol及其衍生物的合成,进一步展现出该策略的实用性。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Stereodivergent 1,3-difunctionalization of alkenes by charge relocation
Bogdan R. Brutiu, Giulia Iannelli, Margaux Riomet, Daniel Kaiser, Nuno Maulide
Nature, 2024, 626, 92–97., DOI: 10.1038/s41586-023-06938-0
导师介绍
Nuno Maulide
https://www.x-mol.com/university/faculty/44783
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号