CJC | 武汉大学刘文博课题组:镍催化对映选择性炔烃官能团化丙二腈去对称环化反应构建含季碳中心和亚胺的氮杂卓衍生物
本文来源于Chinese Journal of Chemistry,欢迎浏览!
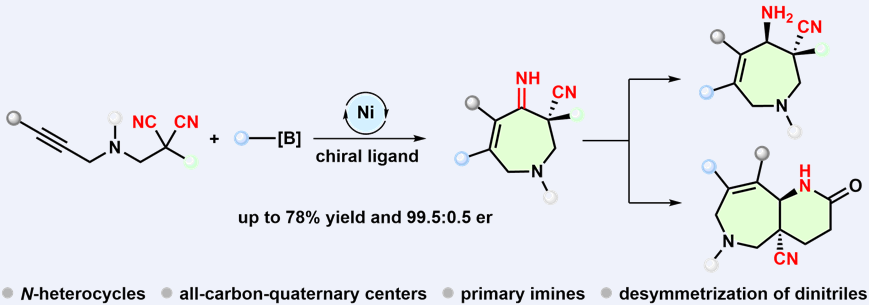
镍催化对映选择性炔烃官能团化丙二腈去对称环化反应构建含季碳中心和亚胺的氮杂卓衍生物
氮杂环化合物的合成方法学是有机化学研究的热点之一。其中,七元氮杂环是许多天然产物和药物活性分子的核心骨架(Chem. Soc. Rev. 2020, 49, 5810; J. Med. Chem. 2014, 57, 10257; Nat. Prod. Rep. 2018, 35, 1347; Eur. J. Clin. Pharmacol. 2022, 78, 1311)。尽管目前已经报道了多种合成氮杂卓衍生物的方法,但是从易得原料出发实现这类结构的对映选择性构筑,仍然具有较大的挑战。其中代表性的不对称催化合成方法主要包括:1) 过渡金属催化的环加成反应,例如,钯或者铱催化的包含π-烯丙基金属中间体的不对称[4+3]环加成反应(J. Am. Chem. Soc. 2016, 138, 7840; Angew. Chem. Int. Ed. 2019, 58, 15021; Angew. Chem. Int. Ed. 2020, 59, 1238; Angew. Chem. Int. Ed. 2020, 59, 1243; Chin. J. Chem. 2020, 38, 151; Angew. Chem. Int. Ed. 2019, 58, 5739);2) 铑催化的环丁酮和1,5-烯炔的对映选择性扩环反应(J. Am. Chem. Soc. 2022, 144, 22159);3) 过渡金属催化七元环状亚胺的不对称氢化反应(J. Am. Chem. Soc. 1994, 116, 8952; Org. Lett. 2012, 14, 3890; Angew. Chem. Int. Ed. 2012, 51, 5706; Chem. Sci. 2019, 10, 2473)。
氮杂卓衍生物骨架上的取代基结构、官能团以及手性中心对于相应化合物的活性具有重要影响,若能在构建氮杂卓骨架的过程中同时引入这些内容将具有应用潜力。炔烃的对映选择性官能团化环化反应是合成结构多样性环状化合物的最直接方法之一,但相关策略在合成氮杂卓衍生物中的应用尚未得到关注,目前仅有一例钯催化的炔烃环化的报道(J. Am. Chem. Soc. 2023, 145, 1973)。刘文博课题组最近实现了镍催化的炔丙基胺甲基取代的丙二腈和芳基硼酸的炔烃芳基化去对称环化反应,实现了手性氮杂卓衍生物的不对称构筑。该反应以易得的Ni(OTf)2和噁唑啉膦配体(Phox)作为催化剂前体,在环化过程实现了对两个对映异位腈基的手性识别,取得了良好的对映选择性,并且具有较好的底物普适性。除了引入季碳手性中心外,所构筑的七元氮杂环骨架上还有双键和未保护的亚胺(C=NH),这些官能团为后续的多样性转化提供了可能。作者也通过克级合成和产物衍生化进一步展示了该方法的应用潜力。该研究为官能团化七元氮杂环的合成提供了一种有效的方法。
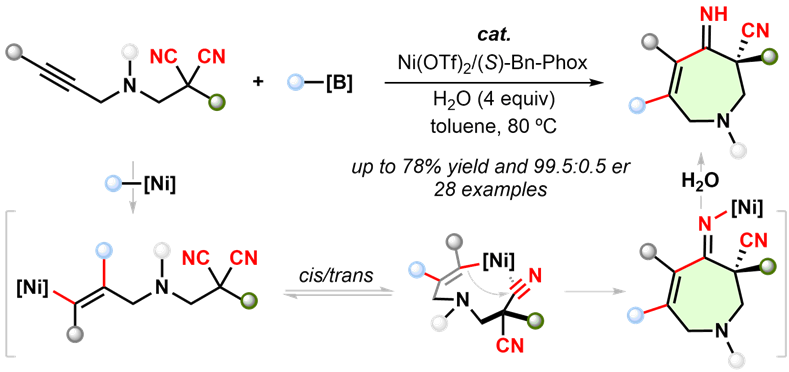
图1 镍催化对映选择性炔烃官能团化丙二腈去对称环化串联反应

《中国化学(英文)》(Chinese Journal of Chemistry)创刊于1983年,半月刊,由中国化学会、上海有机化学研究所联合Wiley共同主办。期刊覆盖化学全领域,发表有机化学、无机化学、物理化学、高分子化学、分析化学、材料化学、能源、催化等各学科领域的原始性、创新性成果,期刊历史悠久、审稿流程严格。2022年度影响因子为5.4,JCI指数0.92,5年影响因子4.4,2022年度CiteScore为7.5,SNIP指标为 0. 859。其中科院分区为化学综合2区。期刊先后收录于DOAJ、ESCI、SCIE等数据库。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号