闫建斌&雷晓光Science:破解紫杉醇生物合成难题
近日,中国农业科学院深圳农业基因组研究所闫建斌团队与北京大学雷晓光团队在国际权威期刊《科学》(Science)在线发表研究论文,成功鉴定了紫杉醇生物途径的关键缺失酶,揭示了红豆杉催化含氧四元环分子形成的全新机制,发现了紫杉醇异源生物合成的核心基因,实现了紫杉醇核心前体巴卡亭III在烟草中的异源合成。该研究成果解决了紫杉醇生物合成研究中的关键瓶颈问题,是植物天然产物生物合成领域中的重大突破,为通过合成生物学的手段实现紫杉醇的高效、可持续生产铺平了道路,具有极高的科学创新性与应用价值。
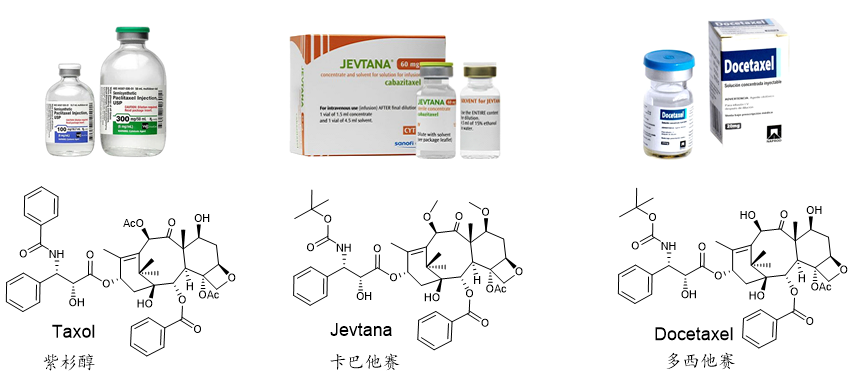
图1. 紫杉烷类抗癌药物
紫杉醇(Taxol)是医药市场上最优秀的天然抗肿瘤药物之一,同时也是全球销量第一的植物抗癌药。在临床上,紫杉醇及其衍生药物多西他赛和卡巴他赛是一种广谱的抗癌药物(图1),可用于乳腺癌、肺癌、前列腺癌和卵巢癌等多种癌症的治疗,在国际医药市场中需求巨大,挽救了全世界无数人的生命。在 20 世纪 90 年代末和 21 世纪初,紫杉醇每年的销售额超过15亿美元,在2001年的销售巅峰时期,年销售额达到20亿美元,成为当年重磅明星抗癌“神药”。
紫杉醇最早是由北卡罗来纳州三角研究所天然产物实验室的Wall博士及其团队核心成员Wani博士于1966年从短叶红豆杉树皮中分离出来的一种抗癌天然产物,其结构于1971年首次通过X射线衍射和核磁共振分析进行了确认。然而,由于紫杉醇在红豆杉中含量极低(仅有0.004%的收率),给紫杉醇的药物开发带来了巨大的挑战。据报道,为了获得足够量的紫杉醇用于临床研究,仅1989年就砍伐了大约6000棵红豆杉树,但仅仅能提取到1.9千克的紫杉醇。据统计,在那时要想满足全美国卵巢癌患者的需求,那么每年需要砍伐超过30万棵红豆杉树,这种获取紫杉醇的做法显然不可持续,且严重破坏生态环境,受到了环保者的猛烈批评和反对。
为了解决紫杉醇原料供应的问题,法国科学家Potier在1988年开发了一条半合成路线。他们先从欧洲红豆杉枝叶中提取含量更加丰富(约0.1%干重)的10-去乙酰基巴卡亭III(10-deacetylbaccatin III),然后利用四步化学合成的办法从10-去乙酰基巴卡亭III来合成紫杉醇。由于大量收割红豆杉枝叶并不会造成红豆杉植物的死亡,这种替代策略为紫杉醇的可持续生产奠定了基础。随后佛罗里达州立大学的Holton团队在1990年开发了一条更为高效的半合成路线,后经纽约州立大学石溪分校的I. Ojima团队优化,并最终被BMS公司所采用,成为当时紫杉醇工业化生产的主要路线(图2)。Holton教授也因该紫杉醇半合成专利获得了巨额财富,他和他所在工作单位佛罗里达州立大学获得了来自BMS公司超过3.5亿美元的收入。更值得一提的是,Potier团队在实现紫杉醇半合成的同时,意外发现其中的一个合成中间体展现出了更好的抗癌活性以及水溶性,该中间体最终由法国赛诺菲制药公司在1995年推向市场,成为了年销售额超过15亿欧元的紫杉烷类抗癌药物多西他赛。然而,由于红豆杉的生长不仅十分缓慢,且易受到自然灾害的影响,再加上枝叶中的合成前体含量低,提取纯化困难,因此该半合成路线也无法满足紫杉醇日益增长的临床需求。
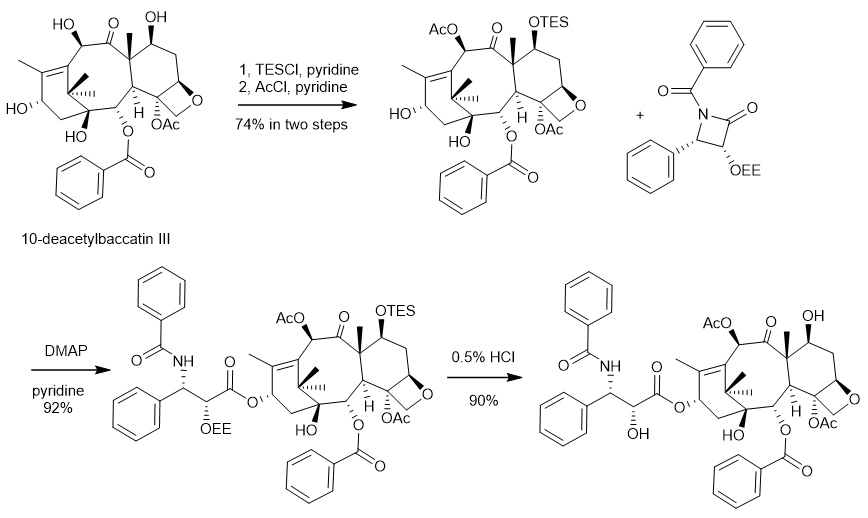
图2. 紫杉醇的工业化合成路线
考虑到紫杉醇复杂的分子结构、良好抗癌活性以及供不应求的市场需求,紫杉醇成为了最受有机合成化学家们关注的合成目标之一。但由于其结构过于复杂,不仅具有高度氧化的、复杂的桥环体系,还具有11个立体中心,紫杉醇也被化学界公认为有机合成难度最大的天然产物分子之一。紫杉醇的首次全合成是由Nicolaou课题组(北京大学的杨震教授为主要完成人)和Holton课题组在1994年首次报导,距离紫杉醇结构鉴定(1971年)已经过去23年。到目前为止,超过40个研究组曾从事紫杉醇全合成研究工作,报道了超过10条全合成路线(图3)。目前最短的全合成路线是由南方科技大学的李闯创教授所报导,然而即使在至今最短的化学合成路线当中,紫杉醇的总收率也才0.118%,远远不能达到工业化生产的要求。
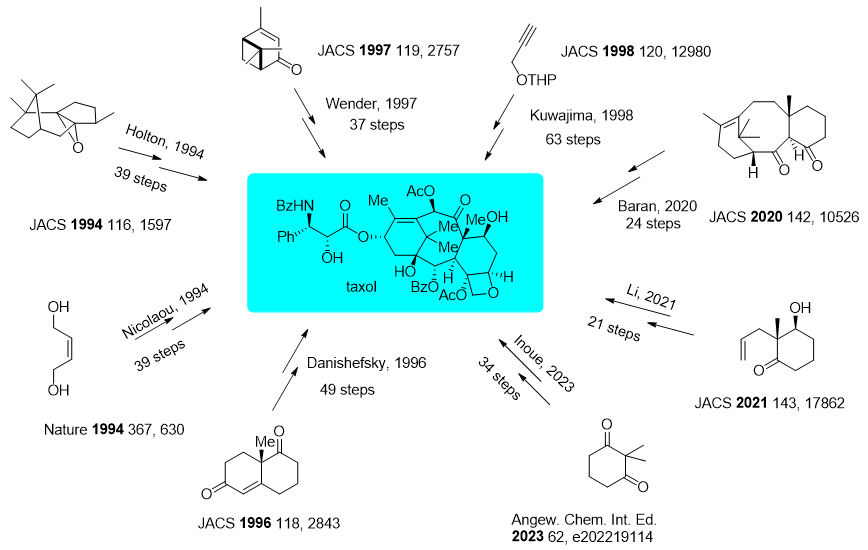
图3. 代表性紫杉醇全合成路线
随着生物技术的快速发展,基于合成生物学的异源合成策略已发展成为解决复杂植物天然产物高效制备的有力手段,因此通过合成生物学的手段实现紫杉醇的高效、绿色和可持续生产受到了广泛的关注。然而,要实现紫杉醇在异源体系中的从头合成,必须要鉴定紫杉醇生物合成通路中所缺失的关键酶,打通紫杉醇完整的生物合成途径。从1995年Croteau课题组发现紫杉醇生物合成途径中首个基因Taxa-4(5),11(12)-diene synthase(TS)以来,到目前为止共鉴定了11个紫杉醇生物合成酶,包括6个负责不同位置C-H键羟基化的P450(T5αH、T10βH、T2αH、T7βH、T13αH和T2’αH)以及五个酰基转移酶(TAT、TBT、DBAT、BAPT、DBTNBT)。然而,到目前为止紫杉醇生物合成途径中多个生物合成酶还未鉴定,其中就包含了负责合成氧杂环丁烷结构的酶以及9号位的氧化酶。这些关键酶的缺失,使得紫杉醇生物合成途径上下游处于脱节状态,因此无法在异源宿主中实现紫杉醇生物合成途径的重构,极大限制了合成生物学在紫杉醇工业化生产中的应用。
在前期的研究中,中国农业科学院深圳基因组研究所(以下简称“基因组所”)的闫建斌团队于2021年率先绘制国际首张染色体级别的南方红豆杉高质量参考基因组图谱,为紫杉醇生物合成途径的解析提供了基因组学蓝图和关键候选基因(Nature Plants, 2021, 7, 1026, 封面论文),而北京大学雷晓光课题组长期从事植物天然产物生物合成酶的鉴定和机制研究,在桑科植物中D-A类型天然产物的生物合成研究中取得了一系列成果(Nature Chemistry, 2020, 12, 620–628, 点击阅读详细;Nature Catalysis, 2021, 4, 1059–1069, 点击阅读详细) 。为解决上述困扰人类半个多世纪的难题,闫建斌团队与雷晓光团队联合清华大学等国内外五家单位,利用多组学分析和基因功能研究等手段,鉴定了紫杉醇合成途径中缺失的关键酶,揭示了紫杉醇氧杂环丁烷的形成机制,实现了紫杉烷类抗癌药物关键合成前体巴卡亭III在烟草中的异源合成,为规模化高效制造紫杉烷类抗癌药物奠定基础,有望打破临床应用中紫杉烷类抗癌药物供应不足的窘境。
在前期研究中研究人员发现CYP725A基因家族特异性地存在于红豆杉植物中,考虑到氧杂环丁烷骨架结构主要存在于紫杉烷类天然产物中,而紫杉烷类天然产物也主要存在于红豆杉植物中,研究员推断参与紫杉醇生物合成的基因,包括负责氧杂环丁烷合成的基因以及C9位的氧化基因,属于红豆杉特异的CYP725A基因家族。为了找到合适的底物用于功能筛选,研究人员还对红豆杉提取物进行了系统性的分离和鉴定,建立了紫杉醇合成前体化合物库,其中包含了紫杉烷化合物1。研究人员通过在烟草异源表达体系中进行底物和基因的共注射,对红豆杉植物中CYP725A亚家族基因进行了大量活性筛选,鉴定了一个参与紫杉醇合成的双功能酶——紫杉烷氧杂环丁烷合成酶(taxane oxetanase, TOT)。TOT除了可以催化底物1产生1-dehydroxybaccatin IV外,还可以催化少量baccatin I的生成(图4)。在红豆杉细胞中敲低该基因的表达量,能够显著降低巴卡亭III和紫杉醇的生物合成。
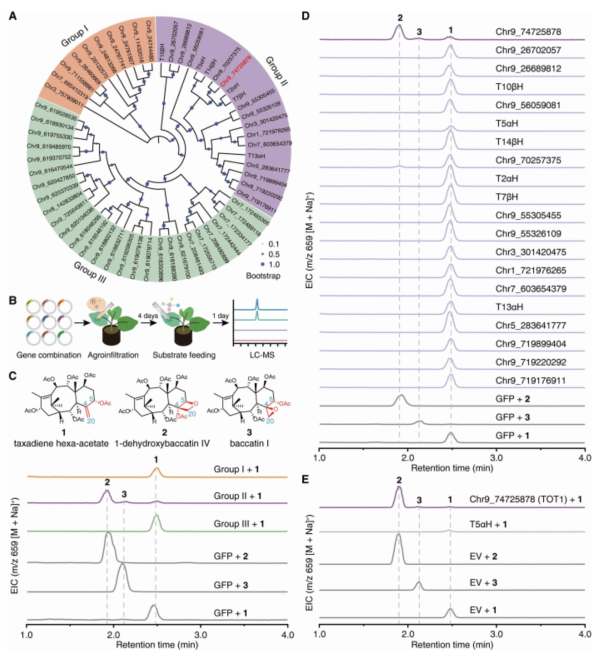
图4. TOT1催化形成独特的四元环分子结构单元
为了揭示TOT催化氧杂环丁烷环形成的反应机制,作者还进行了分子动力学模拟和密度泛函理论(DFT)计算。通过分子对接和动力学模拟,作者发现TOT能够使得底物1中二面角∠C4-C5-O1(Ac)-C1(Ac)主要以-60度的构象存在。以这样一个构象进行密度泛函理论(DFT)计算,作者发现底物1先被[Fe=O]IV氧化形成自由基中间体int0,随后发生邻位乙酰基参与的氧化环化形成中间体int1。中间体int1可以经历两种不同的过渡态TS2和TS3分别形成环氧产物3和四元环产物2(图5)。通过以上计算作者发现,四元环产物2的形成不管在热力学还是动力学上都是相对更有利的,很好地解释TOT为什么主要催化四元环产生这一实验现象。过去四十年间化学家们普遍认为氧杂环丁烷是由对应的环氧前体通过重排反应而形成的,这一全新反应机制的发现,不仅完全颠覆了紫杉醇中氧杂环丁烷形成的传统观念,还进一步丰富了人们对于P450催化功能多样性的认知(图5)。

图5. TOT1催化环氧和氧杂四元环结构形成的反应机制
为了鉴定紫杉醇C9位的氧化酶,研究人员以结构更加简单的紫杉素为突破口,通过与已知基因的共表达分析和紫杉素含量分析,筛选出17个紫杉烷C9位氧化酶候选基因,通过在烟草中重构紫杉素生物合成的方式对这些候选基因进行活性筛选,从中发现了负责紫杉烷 C9 位氧化的酶(T9αH)(图6)。该基因位于红豆杉的9号染色体上,介于T2αH和T7βH两个已知的紫杉醇合成基因之间。
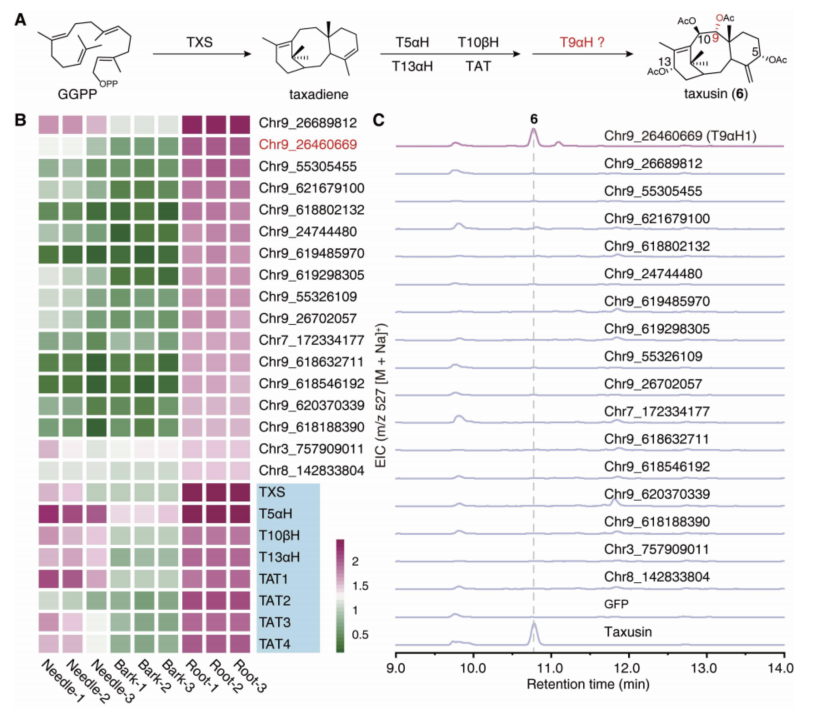
图6. C9位氧化酶的筛选与鉴定
在此基础上,研究人员通过将新鉴定的TOT和T9αH与其他7个已知合成基因(TXS、T5αH、T13αH、T2αH、T7βH、TAT和 TBT)在烟草中共表达后,在烟草中检测到了巴卡亭III的生成,并确定这9个基因是巴卡亭III合成途径的核心基因。进一步的生化研究显示,这些核心基因存在密切的功能协同性,而且受到植物激素茉莉素的共表达调控,显示了相似的诱导表达曲线和强的表达相关性,说明这些基因的表达在细胞中受到协同的控制。结合亚细胞定位分析等实验结果,这些研究结果绘制出了巴卡亭III的完整生物合成过程,即起始底物GGPP在叶绿体中被TXS酶催化形成紫杉二烯,随后,紫杉二烯通过质体-内质网的接触点转移到细胞质之后,受到内质网锚定的六个氧化酶(T2αH、T5αH、T7βH、T9αH、T13αH 和 TOT)与两个细胞质定位的酰基转移酶(TAT和TBT)的协同催化,最终形成了巴卡亭III(图7)。
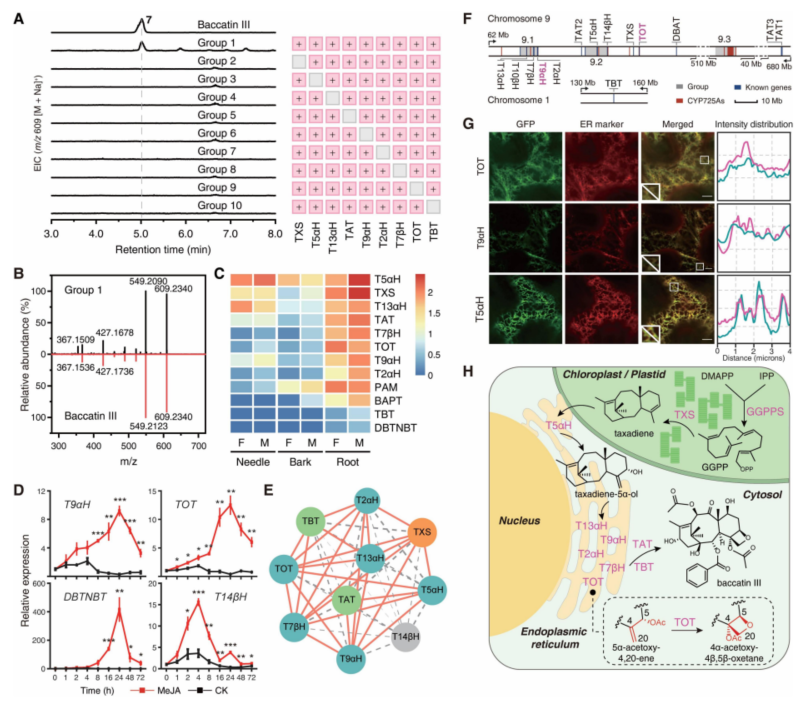
图7. 紫杉醇生产前体巴卡亭III生物合成路线重构
总之,本研究结合多组学分析和大量功能验证,成功鉴定了紫杉醇生物合成途径的关键缺失酶,揭示了植物细胞催化氧杂环丁烷结构形成的全新机制,发现了紫杉醇异源生物合成的最短路线,并通过9个酶在烟草中实现了紫杉醇前体巴卡亭III的生物合成,为紫杉醇的大规模生产奠定了基础,也为上百种紫杉烷类天然产物的生物合成通路解析提供了理论指导,标志着我国在复杂天然产物合成通路解析方面的理论和技术站在了世界前沿位置。该研究成果解决了紫杉醇生物合成的世纪难题,成为合成生物学领域的又一重大突破。
基因组所研究员闫建斌和北京大学雷晓光教授为论文的共同通讯作者,基因组所硕士毕业生蒋彬、北京大学高磊特聘副研究员、北京大学博士生王海军、基因组所博士生孙亚平为该论文的共同第一作者。基因组所张晓林助理研究员、北京大学博士生柯翰、基因组所博士后刘圣超、加利福尼亚大学洛杉矶分校博士后马鹏琛、基因组所廖庆刚助理研究员、基因组所科研助理王跃、基因组所博士生汪欢、基因组所博士生刘煜耿、基因组所杜然副研究员、加利福尼亚大学洛杉矶分校博士后Torben Rogge、基因组所李伟研究员、云南师范大学尚轶教授、加利福尼亚大学洛杉矶分校K. N. Houk教授、基因组所熊兴耀研究员提供了重要帮助。清华大学谢道昕教授以及基因组所黄三文研究员为该研究提出了重要指导。
该研究得到了中华人民共和国科学技术部、国家自然科学基金委员会、美国国立卫生研究院、中国农业科学院、北京分子科学国家实验室、北大-清华生命科学联合研究中心、广东省、深圳市及大鹏新区的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Characterization and heterologous reconstitution of Taxus biosynthetic enzymes leading to baccatin III
Bin Jiang†, Lei Gao†, Haijun Wang†, Yaping Sun†, Xiaolin Zhang, Han Ke, Shengchao Liu, Pengchen Ma, Qinggang Liao, Yue Wang, Huan Wang, Yugeng Liu, Ran Du,, Torben Rogge, Wei Li, Yi Shang, K. N. Houk, Xingyao Xiong, Daoxin Xie, Sanwen Huang, Xiaoguang Lei*, Jianbin Yan*
Science, 2024, DOI: 10.1126/science.adj3484
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号