深度丨Science:揭示Enhancer对基因表达调控的新机制
本文获得“BioArt”授权转载
BioArt按:真核生物中多数基因的表达受到远端调控元件(比如enhancers)的调控。这些远端调控元件的突变或导致基因表达的紊乱,与各种疾病相关;然而,人们对这些远程调控元件如何影响基因表达的机制却不清楚。另外,真核生物中,多数基因的转录延伸中,RNA聚合酶II(RNAPII)会暂停在启动子附近,是基因表达的重要限速步骤。8月31日,美国西北大学Feinberg医学院Ali Shilatifard课题组在Science杂志上在线发表了题为“PAF1 regulation of promoter-proximal pause release via enhancer activation”的研究论文,首次报道了转录延伸/暂停因子PAF1能够结合并且抑制enhancer的活性,从而进一步调节对应基因上RNAPII的暂停和释放,建立起了enhancer活性和基因转录延伸的直接联系。这项研究揭示了enhancer对基因表达调控的新机制,为研究和治疗enhancer突变、缺失导致的疾病提供了新的思路。

论文解读:
真核生物中信使RNA(mRNA)的合成依赖于以基因组为模板的RNA聚合酶II(RNAPII)的转录(transcription)。RNAPII的转录过程主要分为转录起始(initiation)、延伸(elongation)和终止(termination)三个步骤。其中每个步骤都涉及到RNAPII与对应的转录起始因子、延伸因子或者终止因子之间的相互作用和相互调控。近十几年,随着基因组测序的发展,越来越多的证据表明转录延伸的调控是基因表达的一个重要环节【1,2】。真核生物中,多数表达基因在转录起始之后,RNAPII延伸20-60个核苷酸后暂停在启动子(promoter)下游,这种现象被称为启动子近端RNAPII暂停(promoter-proximal Pol II pausing)。暂停的RNAPII,可能被转录延伸因子激活而继续转录延伸过程并合成RNA(productive elongation),也可能通过启动子近端终止(promoter-proximal termination)的方式直接从染色质上的启动子附近解离。
此前,Adelman、Shilatifard和Zeitlinger课题组利用小分子药物Triptolide进行了暂停RNAPII的动态学研究,揭示了暂停RNAPII在很多基因上的稳定存在(5min-1h)【3-5】。暂停RNAPII在启动子近端的稳定主要依赖于negative elongation factor (NELF),DRB sensitivity-inducing factor (DSIF)和Pol-II-associated factor 1 (PAF1)。其中,NELF和DSIF主要是通过阻止promoter-proximal termination来维持暂停RNAPII在启动子上的富集【3,6】;而PAF1则调控了暂停RNAPII的释放(release)和进一步的有效延伸(productive elongation)【7,8】。
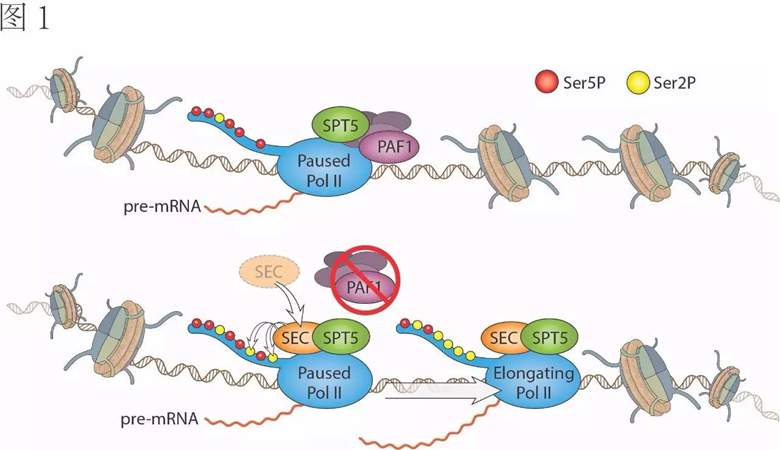
Shilatifard课题组之前在Cell上报道了PAF1可以通过抑制super elongation complex(SEC)的招募来控制暂停RNAPII的释放【7】。PAF1的敲减(knockdown)会导致SEC在很多暂停基因上的富集。SEC会进一步催化RNAPII的CTD结构域第二位的丝氨酸(Ser2)的磷酸化,从而促进暂停RNAPII的释放(图1)。
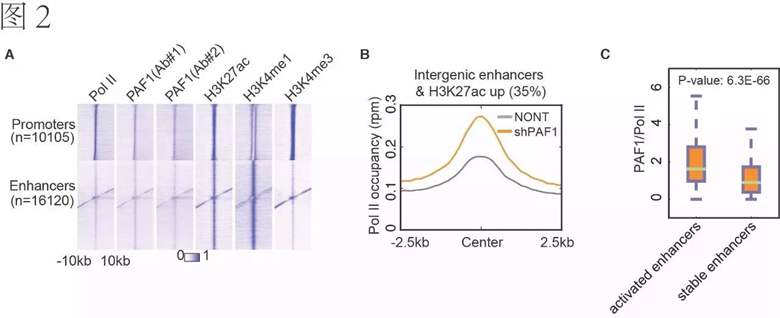
在这项研究中,Shilatifard课题组首次报道了PAF1蛋白不仅仅结合在表达基因上,还可以结合在增强子(enhancers)上。相对promoter而言,PAF1在enhancer上有显著的富集(图2A)。而PAF1的沉默会导致近1/3的有活性的enhancer的进一步显著激活(图2B)。相对不被PAF1调控的稳定enhancer,被PAF1抑制的enhancer上有更高的PAF1蛋白的富集(图2C)。
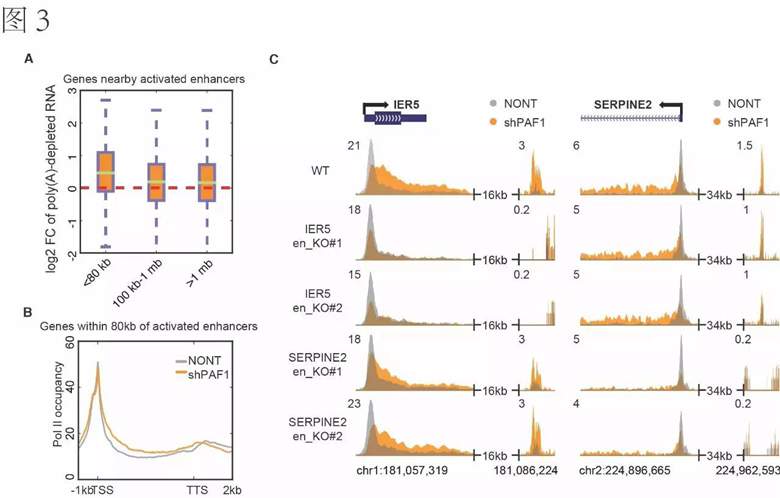
文章进一步通过分析新生成的RNA(nascent RNA)和成熟的RNA(mature RNA),发现PAF1敲减导致的enhancer激活与enhancer附近(~ 80 kb)的基因表达上调之间有紧密联系(图3A)。有趣的是,enhancer附近基因的激活主要是通过暂停RNAPII的释放,而非转录起始的增强(图3B),从而揭示了enhancer活性和基因转录延伸的直接联系。通过利用CRISPR/Cas9敲除enhancer,作者发现enhancer的缺失能够特异性的阻止附近基因上暂停RNAPII的释放,而对暂停RNAPII的形成没有显著影响(图3C)。这说明了PAF1通过抑制enhancer的活性来减弱附近基因上暂停RNAPII的释放;而暂停RNAII的形成主要依赖于promoter本身的特性【9】,而非对应enhancer的活性。
最后,作者检测了PAF1在热休克反应(heat shock response)中对暂停RNAPII的调控。热休克反应会导致几千个基因上暂停RNAPII的增加和表达的下调。而PAF1的敲低则会扭转热休克反应导致的暂停RNAPII的增加。另外,在PAF1敲低之后,这些释放的基因附近对应的enhancer也被激活,从而进一步证明了enhancer激活与对应基因上暂停RNAPII的释放之间紧密联系。最后,作者利用生长素诱导系统(auxin-inducible degron,AID)快速降解PAF1,进一步证实PAF1对暂停RNAPII的直接调控。
领导这一项工作的Ali Shilatifard教授是转录调控领域的杰出学者,早年在H3K4me领域做了许多奠基性的重要工作,发现了酵母中的H3K4甲基转移酶复合物COMPASS,并且研究了MLL融合蛋白在白血病发生过程中的重要作用。值得一提的是,这篇论文的第一作者陈飞早年硕士毕业于复旦大学生物医学研究院徐彦辉课题组(硕士期间以第一作者或共同第一作者发表了Mol Cell和Cell Research,相关工作揭示了组蛋白甲基化修饰新的调控机制),博士期间加入Ali Shilatifard课题组后主要集中在转录延伸尤其是RNAPII暂停的动态学和机制研究上,较短的时间内做出了一些列重要的工作,以第一作者身份在Science、Cell、Genes Dev杂志上发表了3篇研究论文,期间还获得国家优秀自费留学生奖学金(特别优秀奖),现担任Oncogene、Tumor biology 和 Medicine 杂志审稿人。
参考文献:
1.I. Jonkers, J. T. Lis, Getting up to speed with transcription elongation by RNA polymerase II. Nat Rev Mol Cell Biol 16, 167-177 (2015).
2.E. Smith, A. Shilatifard, Transcriptional elongation checkpoint control in development and disease.Genes Dev 27, 1079-1088 (2013).
3.T. Henriques et al., Stable pausing by RNA polymerase II provides an opportunity to target and integrate regulatory signals. Mol Cell 52, 517-528 (2013).
4.W. Shao, J. Zeitlinger, Paused RNA polymerase II inhibits new transcriptional initiation. Nat Genet49, 1045-1051 (2017).
5.F. Chen, X. Gao, A. Shilatifard, Stably paused genes revealed through inhibition of transcription initiation by the TFIIH inhibitor triptolide. Genes Dev 29, 39-47 (2015).
6.L. J. Core et al., Defining the status of RNA polymerase at promoters. Cell Rep 2, 1025-1035 (2012).
7.F. X. Chen et al., PAF1, a Molecular Regulator of Promoter-Proximal Pausing by RNA Polymerase II. Cell 162, 1003-1015 (2015).
8.M. Yu et al., RNA polymerase II-associated factor 1 regulates the release and phosphorylation of paused RNA polymerase II. Science 350, 1383-1386 (2015).
9.M. Lagha et al., Paused Pol II coordinates tissue morphogenesis in the Drosophila embryo. Cell153, 976-987 (2013).
陈飞博士代表性论文:
1、Chen FX, Xie P, Collings CK, Cao K, Aoi Y, Marshall SA, Rendleman EJ, Ugarenko M, Ozark PA, Zhang A, Shiekhattar R, Smith ER, Zhang MQ, Shilatifard A. PAF1 regulation of promoter-proximal pause release via enhancer activation. Science. 2017 Aug 31. DOI: 10.1126/science.aan3269
2、Chen FX, Woodfin AR, Gardini A, Rickels RA, Marshall SA, Smith ER, Shiekhattar R, Shilatifard A. PAF1, a molecular regulator of promoter-proximal pausing by RNA polymerase II. Cell. 2015 Aug 27;162(5):1003-15. (Highlighted by Nature Reviews Molecular Cell Biology, “PAF1 regulates promoter-proximal pausing”)
3、Chen F, Gao X, Shilatifard A. Stably paused genes revealed through inhibition of transcription initiation by the TFIIH inhibitor triptolide. Genes & Development. 2015 Jan 1;29(1):39-47.
4、Chen F*, Yang H*, Dong Z*, Fang J, Wang P, Zhu T, Gong W, Fang R, Shi YG, Li Z#, Xu Y#. Structural insight into substrate recognition by histone demethylase LSD2/KDM1b. Cell research. 2013 Feb;23(2):306.
5、Fang R*, Chen F*, Dong Z, Hu D, Barbera AJ, Clark EA, Fang J, Yang Y, Mei P, Rutenberg M, Li Z, Zhang Y, Xu Y, Yang H, Wang P, Simon MD, Zhou Q, Li J, Marynick MP, Li X, Lu H, Kaiser UB, Kingston RE, Xu Y#, Shi YG#. LSD2/KDM1B and its cofactor NPAC/GLYR1 endow a structural and molecular model for regulation of H3K4 demethylation. Molecular Cell. 2013 Feb 7;49(3):558-70.
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号