Nat. Catal.:光酶协同催化的对映选择性脱羧烷基化
酶作为生物催化剂,能大大加快各种生命过程中反应速率,其重要性不言而喻,地球上每一种生物的生命过程(如:消化、呼吸、运动、生长、发育、繁殖等)都和酶有关。由于氨基酸序列可通过各种诱变技术进行修饰,因此酶的多肽骨架常常作为科学家们的优化目标。然而还要看到,与蛋白质结合的辅因子通常负责反应中的成键反应,例如:黄素这种辅因子就可根据其氧化态实现不同的作用机制。在过去的六年里,不少课题组的工作表明无论氢醌态黄素(FMNhq)和半醌态黄素(FMNsq)处于基态还是激发态,均可通过烯酮还原酶(EREDs)和Baeyer-Villiger单加氧酶(BVMO)活性位点内底物的单电子还原引发自由基反应。由于激发态黄素可被氧化氨基酸侧链(如:酪氨酸或色氨酸)淬灭,因此光酶催化氧化自由基的形成极具挑战性。脂肪酸光脱羧酶(FAP)是目前唯一已知利用其激发态氧化产生以底物为中心的自由基的黄素蛋白,并且其黄素辅因子附近很少有酪氨酸和色氨酸(Y156 8.55 Å,Y466 8.62 Å),因此其具有较长寿命的激发态和荧光。然而,该酶催化的反应目前仅限于加氢脱羧反应。
由于蛋白质骨架的还原淬灭会导致老黄酶1(OYE1)中FMN的激发态寿命较短(24 ps),美国普林斯顿大学的Todd K. Hyster教授课题组尝试添加外源光氧化剂来引发蛋白质活性位点内的自由基形成,这样就不会依赖FMN进行底物氧化。此外,外加氧化辅因子不会位于富含酪氨酸和色氨酸的蛋白质活性位点内,进而导致激发态可以持续足够长的时间促使底物氧化产生活性自由基。近日,他们通过在黄素依赖烯酮还原酶中添加外源性Ru(bpy)32+辅因子(图1b),成功地实现了氨基酸与乙烯基吡啶的对映选择性脱羧烷基化反应(产率高达92%,e.r.值高达99:1),并且立体互补酶可获得产物的两种对映异构体(图1c)。此外,机理研究表明Ru(bpy)32+与蛋白质结合有助于将自由基的形成定位于酶的活性位点。相关成果发表在Nature Catalysis 上。
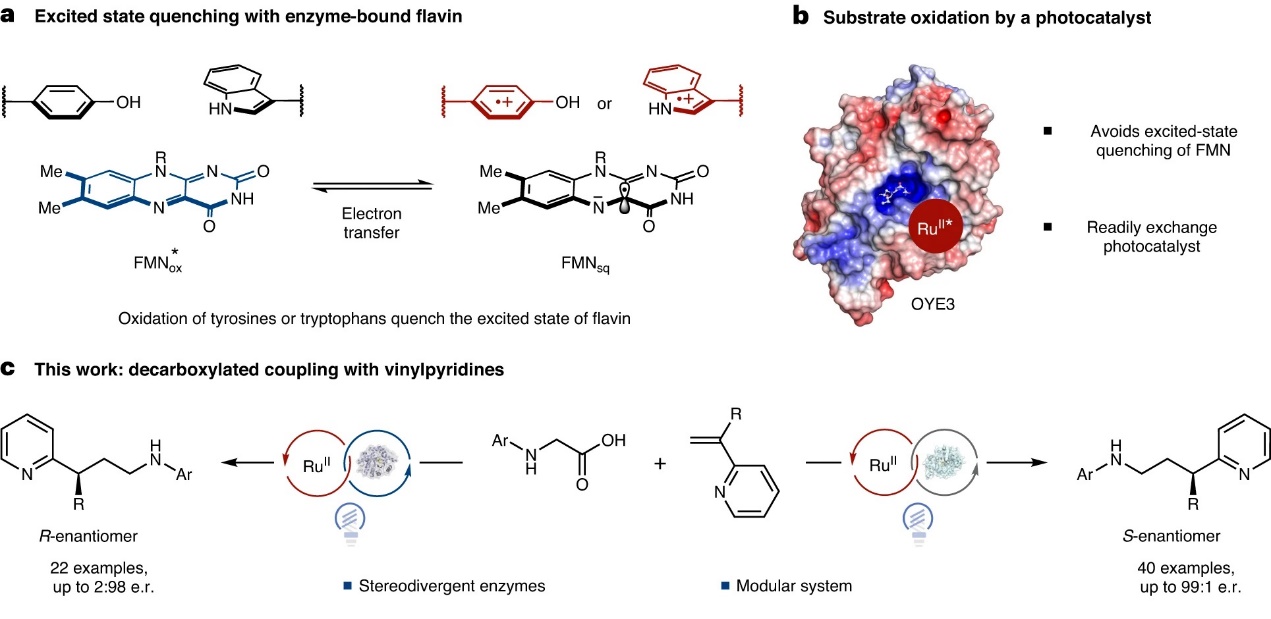
图1. 光酶催化分子间偶联反应。图片来源:Nat. Catal.
首先,作者选择N-苯基甘氨酸1a和乙烯基吡啶2a为模板底物对反应条件进行优化(图2),结果显示在ERED(源自Nostoc punctiforme(NostocER))与光还原剂Ru(bpy)3Cl2催化的乙烯基吡啶不对称还原条件下,可以83%的产率和80:20 e.r.值获得相应产物。随后,作者筛选了一系列ERED同源酶,结果显示老黄酶3(OYE3)能以90%的产率和93:7 e.r.值获得(S)-3,而GluER-T36A则可以70:30 e.r.值生成(R)-3。对先前编译的突变体进行测试后,作者发现GluER-T36A-Y343D可以44%的产率和89:11 e.r.值获得(R)-3。另外,作者还进行了一系列对照实验:1)无OYE3时可以71%的产率获得外消旋产物3,这表明光催化剂可以在没有酶的情况下促进自由基的引发和终止;2)无光催化剂时可以3%的产率和97:3 e.r.值获得产物,进而表明酶负责自由基终止;3)无辅因子循环混合物时对映选择性降低(65:35 e.r.),这可能是由于FMNsq终止自由基而非FMNhq。由于FMNsq的N5-H键(59.5 kcal mol−1)弱于FMNhq(79.3 kcal mol−1),因此自由基终止应该具有更早的过渡态,从而导致对映选择性降低,这意味着必须添加辅因子再生体系以确保反应在FMN的半醌氧化态下引发;4)为了避免外消旋背景反应,需要精确控制Ru(bpy)3Cl2的负载量(与OYE3的比例为1:1)。
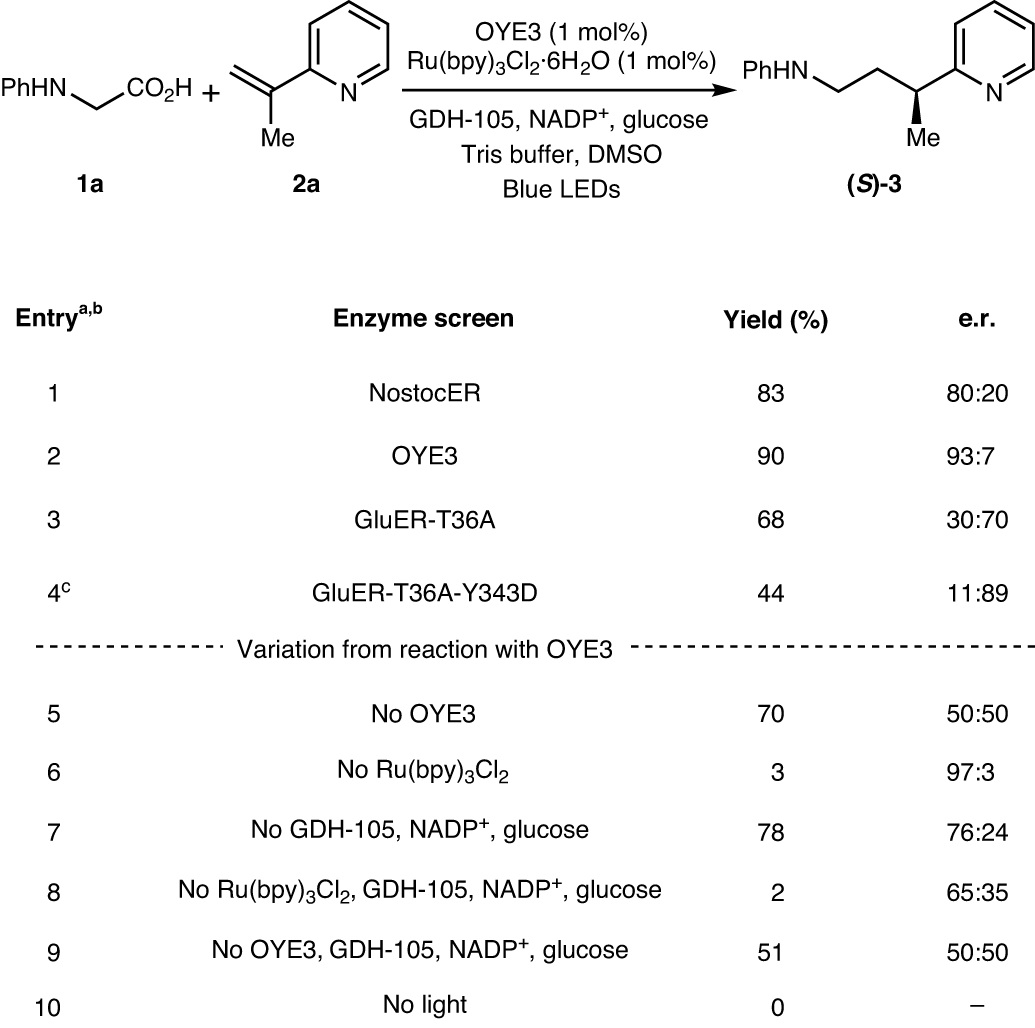
图2. 条件筛选。图片来源:Nat. Catal.
为了进一步探究反应机理,作者进行了一系列实验:1)在有无酶的情况下观察到几乎相同的速率,这说明酶不会加速羧酸氧化,Stern-Volmer猝灭研究进一步支持了这一观点,其研究表明N-苯基甘氨酸猝灭Ru(II)*的猝灭速率常数为Kq=41.4 M−1 s−1(图3a)。另外,将还原的OYE3加入到相同的猝灭实验后猝灭常数的变化可忽略不计,进而证实酶不会加速底物氧化;2)密度泛函理论(DFT)计算显示自由基二聚化的键合强度为35.4 kcal mol−1(图3b),尽管比典型的C-C键(80 kcal mol−1)弱,但它太强而不能可逆地形成,这表明自由基的生成和C-C键的形成没有在溶液中进行;3)荧光猝灭实验表明OYE3是Ru(bpy)32+激发态的稳态猝灭剂;而进行时间分辨荧光猝灭时并没有观察到猝灭,这表明Ru(bpy)32+与OYE3结合的静态猝灭机制;4)根据淬灭剂浓度计算得到KD值为7.94 μM(图3c),这表明酶和辅因子之间具有很强的键合,从而提供了一种在蛋白质活性位点附近进行自由基形成的机制;5)OYE3的静电图显示在黄素结合位点的两侧可能存在疏水口袋,从而实现酶与光催化剂的键合。在此基础上,作者提出了可能的反应机理(图3e):首先,辅因子周转混合物将ERED 从 FMNox(黄素醌)还原为FMNhq。随后,N-苯基甘氨酸和乙烯基吡啶与蛋白质活性位点结合。与此同时,Ru(bpy)32+在光作用下产生激发态并氧化羧酸生成α-氨基自由基和Ru(bpy)31+,接着α-氨基自由基与乙烯基吡啶反应生成苄基自由基。最后,通过HAT和SET过程便可获得所需产物,同时实现催化循环。
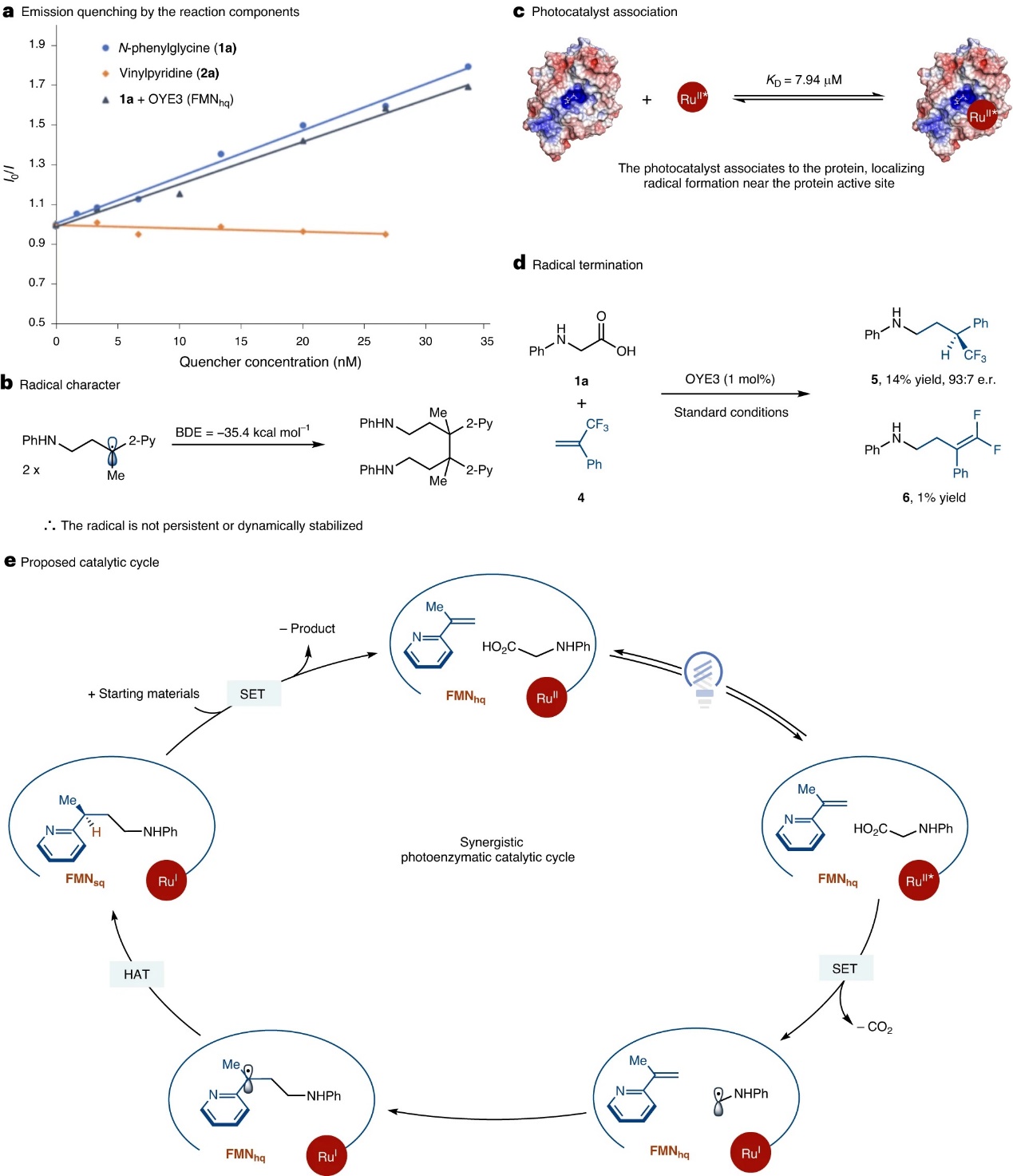
图3. 机理研究。图片来源:Nat. Catal.
另一方面,作者还通过一些实验验证了反应机理中的具体过程:1)为了确定光催化剂是否氧化胺或羧酸,作者测试了N-[(三甲基硅基)甲基]苯胺(1b)的反应效果,其可以76%的产率得到产物3并且对映选择性与羧酸相似,这表明自由基引发是通过胺氧化进行的;2)含有环丙基的乙烯基吡啶进行反应时观察到开环产物,这说明C-C键的形成是通过自由基机制进行的;3)α-三氟甲基苯乙烯在标准条件下进行反应时得到偶联产物,进而表明自由基的终止是通过氢原子转移发生的(图3d);4)作者推断酪氨酸的O-H键或黄素的N5-H键足够弱,从而可以作为氢原子供体。当将活性位点酪氨酸突变为苯丙氨酸(OYE3-Y83F、OYE3-Y197F和OYE3-Y376F)并在标准条件下进行反应时,仅观察到对映选择性的适度变化,这表明没有一个是氢原子供体。基于这些结果,作者使用D2O缓冲液时适度的氘掺入以及辅因子周转的重要性,他们假设FMNhq负责自由基终止,并且得到的FMNsq可以通过电子转移氧化Ru(bpy)31+,然后质子化以再生FMNhq和Ru(bpy)32+。基于上述机制,辅助周转组合应该是不必要的。事实上,当辅因子转换混合物被1 mol% NADPH取代时,能以64%的产率和86:14 e.r.值获得产物,其较低的产率归因于NADP+对[Ru(bpy)32+]*的竞争性猝灭。
在最优条件下,作者对α-杂环烯烃的底物范围进行了考察(图4),结果显示吡啶环上邻、间、对位带有不同取代基的2-乙烯基吡啶(3、7-17)、乙烯基嘧啶(18)、乙烯基吡嗪(19-20)、3-乙烯基吡啶(21)、4-乙烯基吡啶(22)、乙烯基噻唑(25-26)甚至1,2-二取代烯烃(31)均能兼容该反应,以良好的产率和良好至优异的对映选择性(e.r.值分别高达99:1和2:98)获得相应产物,特别是(S)-3能以1.0 mmol规模进行制备(产率:70%)并且对映选择性没有降低。然而,OYE3对烯烃α-位官能团尺寸的影响较大,稍大的杂环(23-24)和烷基(27-29)进行反应时立体选择性会显著降低。值得一提的是,杂芳基烯烃(30)和丙烯酰胺(32)也能有利于脱羧交叉偶联反应,进而表明该方法具有良好的化学选择性。其次,作者探索了氨基酸的底物适用性,结果显示N-芳基甘氨酸苯环上的取代基对反应性影响不大(33-40)。另外,二级N-苯基苯丙氨酸(41)和吲哚啉-2-羧酸(42)也可以良好的产率和高对映选择性获得相应产物,但没有非对映选择性,这说明立体选择性是由氢原子转移步骤而非C-C键形成步骤控制的。值得一提的是,具有较大空间位阻的三级羧酸可以中等的对映选择性转化为产物(43),但是产率很低。
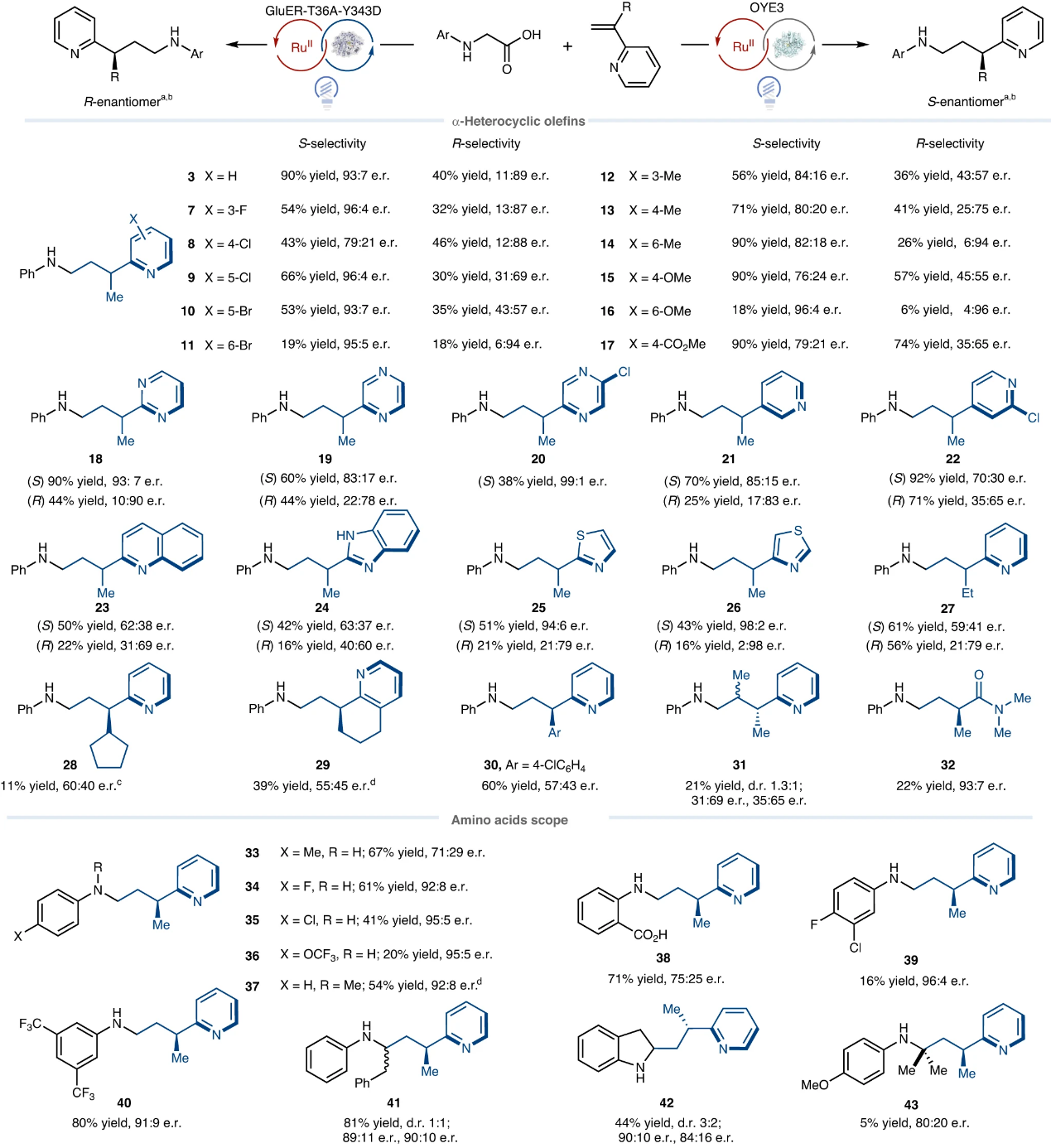
图4. 底物拓展。图片来源:Nat. Catal.
最后,作者对该方法的合成应用进行了研究,具体而言:1)从8-氨基喹啉出发,经三步转化合成了一种anti-human巨细胞病毒(HCMV)化合物(47,图5a);2)利用该方法实现甲基丙烯酸甲酯48与1a的脱羧交叉偶联反应,然后用乙醇钠(3.0 equiv)处理,便可以中等对映选择性得到γ-内酰胺(50,图5b)。
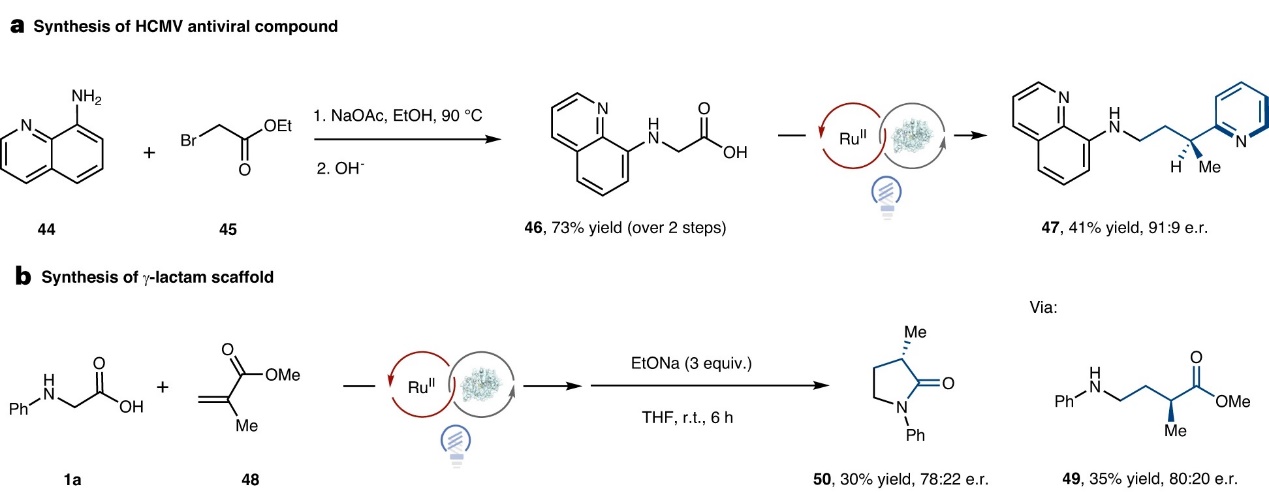
图5. 合成应用。图片来源:Nat. Catal.
总结
Todd K. Hyster教授课题组利用EREDs和光氧化还原催化的协同策略,成功地实现了氨基酸与α-杂环烯烃的对映发散式脱羧烷基化反应,并且立体互补酶可获得产物的两种对映异构体。此外,机理研究表明Ru(bpy)32+与蛋白质结合有助于将自由基的形成定位于酶的活性位点。总的来说,这种协同方法为自由基的产生提供了一种有意思的机制,并扩展了光酶催化不对称转化的研究领域。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantioselective decarboxylative alkylation using synergistic photoenzymatic catalysis
Shang-Zheng Sun, Bryce T. Nicholls, David Bain, Tianzhang Qiao, Claire G. Page, Andrew J. Musser, Todd K. Hyster
Nat. Catal., 2023. DOI: 10.1038/s41929-023-01065-5
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号